Титан, свойства атома, химические и физические свойства
Титан, свойства атома, химические и физические свойства.
Ti 22 Титан
47,867(1) 1s2 2s2 2p6 3s2 3p6 3d2 4s2
Титан — элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 22. Расположен в 4-й группе (по старой классификации — побочной подгруппе четвертой группы), четвертом периоде периодической системы.
Общие сведения
Свойства атома
Химические свойства
Физические свойства
Таблица химических элементов Д.И. Менделеева
Общие сведения | |
| Название | Титан/ Titanium |
| Символ | Ti |
| Номер в таблице | 22 |
| Тип | Металл |
| Открыт | У. Грегор, Англия, 1791 г., М. Г. Клапрот, Германия, 1795 г. |
| Внешний вид и пр. | Лёгкий прочный металл серебристо-белого цвета |
| Содержание в земной коре | 0,66 % |
| Содержание в океане | 1,0×10-7 % |
Свойства атома | |
| Атомная масса (молярная масса) | 47,867(1) а. е. м. (г/моль) |
| Электронная конфигурация | 1s2 2s2 2p6 3s2 3p6 3d2 4s2 |
| Радиус атома | 147 пм |
Химические свойства | |
| Степени окисления | +2, +3, +4 |
| Валентность | +2, +3, +4 |
| Ковалентный радиус | 132 пм |
| Радиус иона | (+4e)68 (+2e)94 пм |
| Электроотрицательность | 1,54 (шкала Полинга) |
| Энергия ионизации (первый электрон) | 657,8 кДж/моль (6,8281 эВ) |
| Электродный потенциал | -1,64 В |
Физические свойства | |
| Плотность (при нормальных условиях) | 4,54 г/см3 |
| Температура плавления | 1668° C (1941 K) |
| Температура кипения | 3287 °C (3560 K) |
| Уд. теплота плавления | 18,8 кДж/моль |
| Уд. теплота испарения | 422,6 кДж/моль |
| Молярная теплоёмкость | 25,51 Дж/(K·моль) |
| Молярный объём | 10,6 см³/моль |
| Теплопроводность (при 300 K) | 21,9 Вт/(м·К) |
| Электропроводность в твердой фазе | 2,5х106 См/м |
| Сверхпроводимость при температуре | |
| Твёрдость | 6 по шкале Мооса, 970 МПа по Виккерсу |
| Структура решётки | гексагональная плотноупакованная (α-Ti) |
| Параметры решётки | a = 2,951 Å, с = 4,697 Å (α-Ti) |
| Отношение c/a | 1,587 |
| Температура Дебая | 380 К |
Таблица химических элементов Д.И. Менделеева
- 1. Водород
- 2. Гелий
- 3. Литий
- 4. Бериллий
- 5. Бор
- 6. Углерод
- 7. Азот
- 8. Кислород
- 9. Фтор
- 10. Неон
- 11. Натрий
- 12. Магний
- 13. Алюминий
- 14. Кремний
- 15. Фосфор
- 16. Сера
- 17. Хлор
- 18. Аргон
- 19. Калий
- 20. Кальций
- 21. Скандий
- 22. Титан
- 23. Ванадий
- 24. Хром
- 25. Марганец
- 26. Железо
- 27. Кобальт
- 28. Никель
- 29. Медь
- 30. Цинк
- 31. Галлий
- 32. Германий
- 33. Мышьяк
- 34. Селен
- 35. Бром
- 36. Криптон
- 37. Рубидий
- 38. Стронций
- 39. Иттрий
- 40. Цирконий
- 41. Ниобий
- 42. Молибден
- 43. Технеций
- 44. Рутений
- 45. Родий
- 46. Палладий
- 47. Серебро
- 48. Кадмий
- 49. Индий
- 50. Олово
- 51. Сурьма
- 53. Йод
- 54. Ксенон
- 55. Цезий
- 56. Барий
- 57. Лантан
- 58. Церий
- 59. Празеодим
- 60. Неодим
- 61. Прометий
- 62. Самарий
- 63. Европий
- 64. Гадолиний
- 65. Тербий
- 66. Диспрозий
- 67. Гольмий
- 68. Эрбий
- 69. Тулий
- 70. Иттербий
- 71. Лютеций
- 72. Гафний
- 73. Тантал
- 74. Вольфрам
- 75. Рений
- 76. Осмий
- 77. Иридий
- 78. Платина
- 79. Золото
- 80. Ртуть
- 81. Таллий
- 82. Свинец
- 83. Висмут
- 84. Полоний
- 85. Астат
- 86. Радон
- 87. Франций
- 88. Радий
- 89. Актиний
- 90. Торий
- 91. Протактиний
- 92. Уран
- 93. Нептуний
- 94. Плутоний
- 95. Америций
- 96. Кюрий
- 97. Берклий
- 98. Калифорний
- 99. Эйнштейний
- 100. Фермий
- 101. Менделеевий
- 102. Нобелий
- 103. Лоуренсий
- 104. Резерфордий
- 105. Дубний
- 106. Сиборгий
- 107. Борий
- 108. Хассий
- 109. Мейтнерий
- 110. Дармштадтий
- 111. Рентгений
- 112. Коперниций
- 113. Нихоний
- 114. Флеровий
- 115. Московий
- 117. Теннессин
- 118. Оганесон
Таблица химических элементов Д.И. Менделеева
Примечание: © Фото https://www.pexels.com, https://pixabay.com
карта сайта
титан атомная масса степень окисления валентность плотность температура кипения плавления физические химические свойства структура теплопроводность электропроводность кристаллическая решетка
атом нарисовать строение число протонов в ядре строение электронных оболочек электронная формула конфигурация схема строения электронной оболочки заряд ядра состав масса орбита уровни модель радиус энергия электрона переход скорость спектр длина волны молекулярная масса объем атома
электронные формулы сколько атомов в молекуле титана
сколько электронов в атоме свойства металлические неметаллические термодинамические
Коэффициент востребованности 63
comments powered by HyperCommentsxn--80aaafltebbc3auk2aepkhr3ewjpa.xn--p1ai
Титан. Описание, свойства, происхождение и применение металла

Брусок кристаллического титана
Титан — лёгкий прочный металл серебристо-белого цвета. Существует в двух кристаллических модификациях: α-Ti с гексагональной плотноупакованной решёткой, β-Ti с кубической объёмно-центрированной упаковкой, температура полиморфного превращения α↔β 883 °C.Титан и титановые сплавы сочетают легкость, прочность, высокую коррозийную стойкость, низкий коэффициент теплового расширения, возможность работы в широком диапазоне температур.
СТРУКТУРА
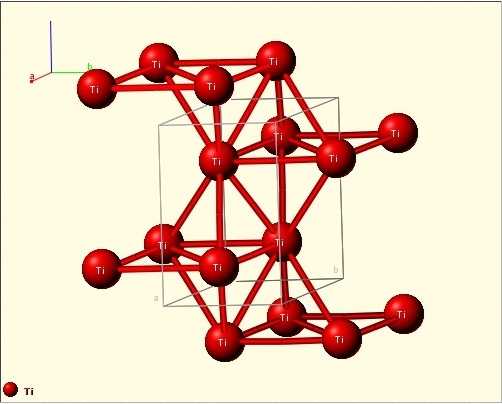
Кристаллическая структура кристалла
Титан имеет две аллотропические модификации. Низкотемпературная модификация, существующая до 882 °C, имеет гексагональную плотноупакованную решетку с периодами а = 0,296 нм и с = 0,472 нм. Высокотемпературная модификация имеет решетку объемноцентрированного куба с периодом а = 0,332 нм.
Полиморфное превращение (882 °C) при медленном охлаждении происходит по нормальному механизму с образованием равноосных зерен, а при быстром охлаждении — по мартенситному механизму с образованием игольчатой структуры.
Титан обладает высокой коррозионной и химической стойкостью благодаря защитной окисной пленке на его поверхности. Он не корродирует в пресной и морской воде, минеральных кислотах, царской водке и др.
СВОЙСТВА
 Кристаллы титана
Кристаллы титанаТочка плавления 1671 °C, точка кипения 3260 °C, плотность α-Ti и β-Ti соответственно равна 4,505 (20 °C) и 4,32 (900 °C) г/см³, атомная плотность 5,71×1022 ат/см³. Пластичен, сваривается в инертной атмосфере.
Применяемый в промышленности технический титан содержит примеси кислорода, азота, железа, кремния и углерода, повышающие его прочность, снижающие пластичность и влияющие на температуру полиморфного превращения, которое происходит в интервале 865-920 °С. Для технического Титана марок ВТ1-00 и ВТ1-0 плотность около 4,32 г/см3, предел прочности 300-550 Мн/м2 (30-55кгс/мм2), относительное удлинение не ниже 25%, твердость по Бринеллю 1150-1650 Мн/м2 (115-165 кгс/мм2). Является парамагнетиком. Конфигурация внешней электронной оболочки атома Ti 3d24s2.
Имеет высокую вязкость, при механической обработке склонен к налипанию на режущий инструмент, и поэтому требуется нанесение специальных покрытий на инструмент, различных смазок.
При обычной температуре покрывается защитной пассивирующей пленкой оксида TiO2, благодаря этому коррозионностоек в большинстве сред (кроме щелочной). Титановая пыль имеет свойство взрываться. Температура вспышки 400 °C.
ЗАПАСЫ И ДОБЫЧА

Кристаллы титана
Основные руды: ильменит (FeTiO3), рутил (TiO2), титанит (CaTiSiO5).
На 2002 год, 90 % добываемого титана использовалось на производство диоксида титана TiO2. Мировое производство диоксида титана составляло 4,5 млн т. в год. Подтвержденные запасы диоксида титана (без России) составляют около 800 млн т. На 2006 год, по оценке Геологической службы США, в пересчёте на диоксид титана и без учёта России, запасы ильменитовых руд составляют 603—673 млн т., а рутиловых — 49.7—52.7 млн т. Таким образом, при нынешних темпах добычи мировых разведанных запасов титана (без учёта России) хватит более чем на 150 лет.
Россия обладает вторыми в мире, после Китая, запасами титана. Минерально-сырьевую базу титана России составляют 20 месторождений (из них 11 коренных и 9 россыпных), достаточно равномерно рассредоточенных по территории страны. Самое крупное из разведанных месторождений находится в 25 км от города Ухта (Республика Коми). Запасы месторождения оцениваются в 2 миллиарда тонн.
Концентрат титановых руд подвергают сернокислотной или пирометаллургической переработке. Продукт сернокислотной обработки — порошок диоксида титана TiO2. Пирометаллургическим методом руду спекают с коксом и обрабатывают хлором, получая пары тетрахлорида титана их при 850 °C восстанавливают магнием.
Полученную титановую «губку» переплавляют и очищают. Ильменитовые концентраты восстанавливают в электродуговых печах с последующим хлорированием возникающих титановых шлаков.
ПРОИСХОЖДЕНИЕ

Титановая руда
Титан находится на 10-м месте по распространённости в природе. Содержание в земной коре — 0,57 % по массе, в морской воде — 0,001 мг/л. В ультраосновных породах 300 г/т, в основных — 9 кг/т, в кислых 2,3 кг/т, в глинах и сланцах 4,5 кг/т. В земной коре титан почти всегда четырёхвалентен и присутствует только в кислородных соединениях. В свободном виде не встречается. Титан в условиях выветривания и осаждения имеет геохимическое сродство с Al2O3. Он концентрируется в бокситах коры выветривания и в морских глинистых осадках.
Перенос титана осуществляется в виде механических обломков минералов и в виде коллоидов. До 30 % TiO2 по весу накапливается в некоторых глинах. Минералы титана устойчивы к выветриванию и образуют крупные концентрации в россыпях. Известно более 100 минералов, содержащих титан. Важнейшие из них: рутил TiO2, ильменит FeTiO3, титаномагнетит FeTiO3 + Fe3O4, перовскит CaTiO3, титанит CaTiSiO5. Различают коренные руды титана — ильменит-титаномагнетитовые и россыпные — рутил-ильменит-цирконовые.
Месторождения титана находятся на территории ЮАР, России, Украины, Китая, Японии, Австралии, Индии, Цейлона, Бразилии, Южной Кореи, Казахстана. В странах СНГ ведущее место по разведанным запасам титановых руд занимает РФ (58.5%) и Украина (40.2%).
ПРИМЕНЕНИЕ

Изделия из титана
Титановые сплавы играют большую роль в авиационной технике, где стремятся получить наиболее легкую конструкцию в сочетании с необходимой прочностью. Титан легок по сравнению с другими металлами, но в то же время может работать при высоких температурах. Из титановых сплавов изготовляют обшивку, детали крепления, силовой набор, детали шасси, различные агрегаты. Также данные материалы применяются в конструкциях авиационных реактивных двигателей. Это позволяет уменьшить их массу на 10-25%. Из титановых сплавов производят диски и лопатки компрессора, детали воздухозаборника и направляющего аппарата, крепеж.
Также титан и его сплавы используют в ракетостроении. Ввиду кратковременной работы двигателей и быстрого прохождения плотных слоев атмосферы в ракетостроении в значительной мере снимаются проблемы усталостной прочности, статической выносливости и отчасти ползучести.
Технический титан из-за недостаточно высокой теплопрочности не пригоден для применения в авиации, но благодаря исключительно высокому сопротивлению коррозии в ряде случаев незаменим в химической промышленности и судостроении. Так его применяют при изготовлении компрессоров и насосов для перекачки таких агрессивных сред, как серная и соляная кислота и их соли, трубопроводов, запорной арматуры, автоклав, различного рода емкостей, фильтров и т.п. Только титан обладает коррозионной стойкостью в таких средах, как влажный хлор, водные и кислые растворы хлора, поэтому из данного металла изготовляют оборудование для хлорной промышленности. Из титана делают теплообменники, работающие в коррозионно активных средах, например в азотной кислоте (не дымящей). В судостроении титан используется для изготовления гребных винтов, обшивки морских судов, подводных лодок, торпед и т.д. На титан и его сплавы не налипают ракушки, которые резко повышают сопротивление судна при его движении.
Титановые сплавы перспективны для использования во многих других применениях, но их распространение в технике сдерживается высокой стоимостью и дефицитностью титана.
Титан (англ. Titanium) — Ti
| Молекулярный вес | 47.88 г/моль |
| Происхождение названия | Минерал получил своё название в честь титанов, персонажей древнегреческой мифологии, детей Геи. |
| IMA статус | подтвержден в 2010 году |
КЛАССИФИКАЦИЯ
| Strunz (8-ое издание) | 1/A.06-05 |
| Dana (7-ое издание) | 1.1.36.1 |
| Nickel-Strunz (10-ое издание) | 1.AB.05 |
ФИЗИЧЕСКИЕ СВОЙСТВА
| Цвет минерала | Серебристо-серый |
| Цвет черты | серовато черный |
| Прозрачность | непрозрачный |
| Блеск | металлический |
| Спайность | нет |
| Твердость (шкала Мооса) | 4 |
| Излом | в зазубринах |
| Прочность | податливый |
| Плотность (измеренная) | 4.503 г/см3 |
| Радиоактивность (GRapi) | 0 |
| Магнетизм | парамагнетик |
ОПТИЧЕСКИЕ СВОЙСТВА
| Люминесценция в ультрафиолетовом излучении | не флюоресцентный |
КРИСТАЛЛОГРАФИЧЕСКИЕ СВОЙСТВА
| Точечная группа | 6/mmm (6/m 2/m 2/m) — дигексагональный дипирамидальный |
| Пространственная группа | P63/mmc |
| Сингония | гексагональная |
| Параметры ячейки | a=2,951 с=4,697 (α-Ti) |
Интересные статьи:
mineralpro.ru 13.07.2016mineralpro.ru
Титан
| Титан | |
|---|---|
| Атомный номер | 22 |
| Внешний вид простого вещества | |
| Свойства атома | |
|
Атомная масса (молярная масса) |
47,88 а. е. м. (г/моль) |
| Радиус атома | 147 пм |
|
Энергия ионизации (первый электрон) |
657,8(6,82) кДж/моль (эВ) |
| Электронная конфигурация | [Ar] 3d2 4s2 |
| Химические свойства | |
| Ковалентный радиус | 132 пм |
| Радиус иона | (+4e)68 (+2e)94 пм |
|
Электроотрицательность (по Полингу) |
1,54 |
| Электродный потенциал | -1,63 |
| Степени окисления | 4, 3 |
| Термодинамические свойства простого вещества | |
| Плотность | 4,54 г/см? |
| Молярная теплоёмкость | 25,1 Дж/(K·моль) |
| Теплопроводность | 21.9 Вт/(м·K) |
| Температура плавления | 1933 K |
| Теплота плавления | 18.8 кДж/моль |
| Температура кипения | 3560 K |
| Теплота испарения | 422,6 кДж/моль |
| Молярный объём | 10,6 см3/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки |
гексагональная плотноупакованная (?-Ti) |
| Параметры решётки | a=2,951 с=4,697 (?-Ti) A |
| Отношение c/a | 1,587 |
| Температура Дебая | 380 K |
| Ti | 22 |
| 47,88 | |
| [Ar]3d24s2 | |
| Титан | |
Титан — элемент побочной подгруппы четвёртой группы, четвёртого периода периодической системы химических элементов, с атомным номером 22. Обозначается символом Ti (лат. Titanium). Простое вещество титан (CAS-номер: 7440-32-6) — лёгкий металл серебристо-белого цвета. Существует в двух кристаллических модификациях: ?-Ti с гексагональной плотноупакованной решёткой, -Ti с кубической объёмно-центрированной упаковкой, температура перехода α↔β 883 °C
История открытия элемента Титан
Схема атома титанаОткрытие TiO2 сделали практически одновременно и независимо друг от друга англичанин У. Грегор и немецкий химик М. Г. Клапрот. У. Грегор, исследуя состав магнитного железистого песка (Крид, Корнуолл, Англия, 1789), выделил новую «землю» (окись) неизвестного металла, которую назвал менакеновой. В 1795 г. немецкий химик Клапрот открыл в минерале рутиле новый элемент и назвал его титаном. Спустя два года Клапрот установил, что рутил и менакеновая земля — окислы одного и того же элемента, за которым и осталось название «титан», предложенное Клапротом. Через 10 лет открытие титана состоялось в третий раз. Французский учёный Л. Воклен обнаружил титан в анатазе и доказал, что рутил и анатаз — идентичные окислы титана.
Первый образец металлического титана получил в 1825 году Й. Я. Берцелиус. Из-за высокой химической активности титана и сложности его очистки чистый образец Ti получили голландцы А. ван Аркел и И. де Бур в 1925 термическим разложением паров иодида титана TiI4.
Происхождение названия
Металл получил своё название в честь титанов, персонажей древнегреческой мифологии, детей Геи. Название элементу дал Мартин Клапрот, в соответствии со своими взглядами на химическую номенклатуру в противоход французской химической школе, где элемент старались называть по его химическим свойствам. Поскольку немецкий исследователь сам отметил невозможность определения свойств нового элемента только по его оксиду, он подобрал для него имя из мифологии, по аналогии с открытым им ранее ураном.
Однако согласно другой версии, публиковавшейся в журнале «Техника-Молодежи» в конце 80-х, новооткрытый металл обязан своим именем не могучим титанам из древнегреческих мифов, а Титании — королеве фей в германской мифологии (жена Оберона в шекспировском «Сне в летнюю ночь»). Такое название связано с необычайной «лёгкостью» (малой плотностью) металла.
Нахождение в природе
Титан находится на 10-м месте по распространённости в природе. Содержание в земной коре 0,57 % по массе. В свободном виде не встречается. Известно более 100 минералов, содержащих титан. Важнейшие из них: рутил TiO2, ильменит FeTiO3, титаномагнетит FeTiO3 + Fe3O4, перовскит CaTiO3, титанит CaTiOSiO4, танталит (Fe,Mn)2+Ta2O6 и манганотанталит MnT2O6. Различают коренные руды титана — ильменит-титаномагнетитовые и россыпные — рутил-ильменит-цирконовые.
Запасы и добыча
Основные руды: ильменит (FeTiO3), рутил (TiO2), титанит (CaTiSiO5).
На 2002 год, 90 % добываемого титана использовалось на производство диоксида титана TiO2. Мировое производство диоксида титана составляло 4,5 млн т. в год. Подтвержденные запасы диоксида титана (без России) составляют около 800 млн т.[2]. На 2006 год, по оценке Геологической службы США, в пересчёте на диоксид титана и без учёта России, запасы ильменитовых руд составляют 603—673 млн т., а рутиловых — 49.7—52.7 млн т. При современных темпах добычи мировых разведанных запасов титана (без учёта России) хватит более чем на 150 лет.
Россия обладает вторыми в мире, после Китая, запасами титана. Минерально-сырьевую базу титана России составляют 20 месторождений (из них 11 коренных и 9 россыпных), достаточно равномерно рассредоточенных по территории страны. Самое крупное из разведанных месторождений находится в 25 км от города Ухта (Республика Коми). Запасы месторождения оцениваются в 2 миллиарда тонн.
Крупнейший в мире производитель титана — российская компания «ВСМПО-АВИСМА».
Получение
Брусок кристаллического титана (чистота 99,995 %, вес ?283 г, длина ?14 см, диаметр ?25 мм), изготовленный на заводе «Уралредмет» иодидным методом ван Аркеля и де БураКонцентрат титановых руд подвергают сернокислотной или пирометаллургической переработке. Продукт сернокислотной обработки — порошок диоксида титана TiO2. Пирометаллургическим методом руду спекают с коксом и обрабатывают хлором, получая пары тетрахлорида титана TiCl4: TiO2 + 2C + 2Cl2 =TiCl4 + 2CO
Образующиеся пары TiCl4 при 850 °C восстанавливают Mg: TiCl4+ 2Mg = 2MgCl2+ Ti
Полученную титановую «губку» переплавляют и очищают. Ильменитовые концентраты восстанавливают в электродуговых печах с последующим хлорированием возникающих титановых шлаков. Рафинируют титан иодидным способом или электролизом, выделяя Ti из TiCl4. Для получения титановых слитков применяют дуговую, электроннолучевую или плазменную переработку.
Физические свойства
Титан — легкий серебристо-белый металл. Существует в двух кристаллических модификациях: ?-Ti с гексагональной плотноупакованной решёткой (a=2,951 A; с=4,697 A; z=2; пространственная группа C6mmc), ?-Ti с кубической объёмноцентрированной упаковкой (a=3,269 A; z=2; пространственная группа Im3m), температура перехода ?-? 883 °C, ?H перехода 3,8 кДж/моль. Точка плавления 1671 °C, точка кипения 3260 °C, плотность ?-Ti и ?-Ti соответственно равна 4,505 (20 °C) и 4,32 (900 °C) г/см?, атомная плотность 5,71×1022 ат/см³. Пластичен, сваривается в инертной атмосфере.
Имеет высокую вязкость, при механической обработке склонен к налипанию на режущий инструмент, и поэтому требуется нанесение специальных покрытий на инструмент, различных смазок.
При обычной температуре покрывается защитной пассивирующей пленкой оксида TiO2, благодаря этому коррозионностоек в большинстве сред (кроме щелочной).
Титановая пыль имеет свойство взрываться. Температура вспышки 400°С.
Химические свойства
Устойчив к коррозии благодаря оксидной плёнке, но при измельчении в порошок горит на воздухе.
Титан устойчив к разбавленным растворам многих кислот и щелочей (кроме HF,H3PO4 и концентрированной H2SO4).
Легко реагирует даже со слабыми кислотами в присутствии комплексообразователей, например, с плавиковой кислотой HF он взаимодействует благодаря образованию комплексного аниона [TiF6]2-.
При нагревании на воздухе до 1200°C Ti загорается с образованием оксидных фаз переменного состава TiOx. Из растворов солей титана осаждается гидроксид TiO(OH)2·xH2O, осторожным прокаливанием которого получают оксид TiO2. Гидроксид TiO(OH)2·xH2O и диоксид TiO2амфотерны.
TiO2 взаимодействует с серной кислотой при длительном кипячении. При сплавлении с содой Na2CO3 или поташом K2CO3 оксид TiO2 образует титанат: TiO2+K2CO3=K2TiO3+CO2.
При нагревании Ti взаимодействует с галогенами. Тетрахлорид титана TiCl4 при обычных условиях — желтоватая, сильно дымящая на воздухе жидкость, что объясняется сильным гидролизом TiCl4 содержащимися в воздухе парами воды и образованием мельчайших капелек HCl и взвеси гидроксида титана.
Восстановлением TiCl4водородом, Al, Si, другими сильными восстановителями, получен трихлорид и дихлорид титана TiCl3 и TiCl2 — твердые вещества с сильно восстановительными свойствами. Ti взаимодействует с Br2 и I2.
С N2 выше 400 °C титан образует нитрид TiNx(x=0,58-1,00). При взаимодействии титана с C образуется карбид титана TiCx (x=0,49-1,00).
При нагревании Ti поглощает H2 с образованием соединения переменного состава TiHх (x=1,0). При нагревании эти гидриды разлагаются с выделением H2. Титан образует сплавы со многими металлами.
Применение
Часы из титанового сплаваВ виде сплавов
- Металл применяется в химической промышленности (реакторы, трубопроводы, насосы), лёгких сплавах, остеопротезах. Является важнейшим конструкционным материалом в авиа-, ракето-, кораблестроении.
- Используется в художественном литье[5]
- Титан является легирующей добавкой в некоторых марках стали.
- Нитинол (никель-титан) — сплав, обладающий памятью формы, применяемый в медицине и технике.
- Алюминиды титана являются очень стойкими к окислению и жаропрочными, что в свою очередь определило их использование в авиации и автомобилестроении в качестве конструкционных материалов.
В виде соединений
- Белый диоксид титана (TiO2) используется в красках (например, титановые белила), а также при производстве бумаги и пластика. Пищевая добавка E171.
- Титанорганические соединения (напр. тетрабутоксититан) применяются в качестве катализатора и отвердителя в химической и лакокрасочной промышленности.
- Неорганические соединения титана применяются в химической электронной, стекловолоконной промышленности в качестве добавки или покрытий.
- Диборид титана — важный компонент сверхтвердых материалов для обработки металлов.
- Нитрид титана применяется для покрытия инструментов.
- Титанат бария BaTiO3, титанат свинца PbTiO3 и ряд других титанатов —- сегнетоэлектрики.
Анализ рынков потребления
В 2005 компания Titanium Corporation опубликовала следующую оценку потребления титана в мире:
60 % — краска;
20 % — пластик;
13 % — бумага;
7 % — машиностроение.
Цены
15-25 $ за килограмм, в зависимости от чистоты.
Чистота и марка чернового титана (титановой губки) обычно определяется по степени её пластичности.
Физиологическое действие
Нитрид титана
Соединения титана
himsnab-spb.ru
Титан — свойства, характеристики, сплаты
 В периодической системе химический элемент титан обозначается, как Ti (Titanium) и располагается в побочной подгруппе IV группы, в 4 периоде под атомным номером 22. Это серебристо-белый твёрдый металл, который входит в состав большого количества минералов. Купить титан вы можете на нашем сайте.
В периодической системе химический элемент титан обозначается, как Ti (Titanium) и располагается в побочной подгруппе IV группы, в 4 периоде под атомным номером 22. Это серебристо-белый твёрдый металл, который входит в состав большого количества минералов. Купить титан вы можете на нашем сайте.
Открыли титан в конце 18 века химики из Англии и Германии Ульям Грегор и Мартин Клапрот, причём независимо друг от друга с шестилетней разницей. Название элементу дал именно Мартин Клапрот в честь древнегреческих персонажей титанов (огромных, сильных, бессмертных существ). Как оказалось, название стало пророческим, но чтобы познакомиться со всеми свойствами титана, человечеству понадобилось ещё больше 150 лет. Только через три десятилетия удалось получить первый образец металла титана. На тот момент времени его практически не использовали из-за хрупкости. В 1925 году после ряда опытов, при помощи йодидного метода химики Ван Аркель и Де Бур добыли чистый титан.
Благодаря ценным свойствам металла, на него сразу же обратили внимание инженеры и конструкторы. Это был настоящий прорыв. В 1940 году Кролль разработал магниетермический способ получения титана из руды. Этот способ актуален и на сегодняшний день.
Физические и механические свойства
Титан является довольно тугоплавким металлом. Температура его плавления составляет 1668±3°С. По этому показателю он уступает таким металлам, как тантал, вольфрам, рений, ниобий, молибден, тантал, цирконий. Титан – это парамагнитный металл. В магнитном поле он не намагничивается, но не выталкивается из него. Изображение 2
Титан обладает низкой плотностью (4,5 г/см³) и высокой прочностью (до 140 кг/мм²). Эти свойства практически не меняются при высоких температурах. Он более чем в 1,5 раза тяжелее алюминия (2,7 г/см³), зато в 1,5 раза легче железа (7,8 г/см³). По механическим свойствам титан намного превосходит эти металлы. По прочности титан и его сплавы располагаются в одном ряду со многими марками легированных сталей.
По стойкости к коррозии титан не уступает платине. Металл обладает отличной устойчивостью в условиях кавитации. Пузырьки воздуха, образующиеся в жидкой среде при активном движении титановой детали, практически не разрушают её.
Это прочный металл, способный сопротивляться разрушению и пластической деформации. Он в 12 раз твёрже алюминия и в 4 раза — меди и железа. Ещё один важный показатель – это предел текучести. С увеличением этого показателя улучшается сопротивление деталей из титана эксплуатационным нагрузкам.
В сплавах с определёнными металлами (особенно с никелем и водородом) титан способен «запоминать» форму изделия, созданную при определённой температуре. Такое изделие потом можно деформировать и оно надолго сохранит это положение. Если же изделие нагреть до температуры, при которой оно было сделано, то изделие примет первоначальную форму. Называют это свойство «памятью».
Теплопроводность титана сравнительно низкая и коэффициент линейного расширения соответственно тоже. Из этого следует, что металл плохо проводит электричество и тепло. Зато при низких температурах он является сверхпроводником электричества, что позволяет ему передавать энергию на значительные расстояния. Также титан обладает высоким электросопротивлением.
Чистый металл титан подлежит различным видам обработки в холодном и горячем состоянии. Его можно вытягивать и делать проволоку, ковать, прокатывать в ленты, листы и фольгу с толщиной до 0,01 мм. Из титана изготавливают такие виды проката: титановая лента, титановая проволока, титановые трубы, титановые втулки, титановый круг, титановый пруток.
Химические свойства
Чистый титан – это химически активный элемент. Благодаря тому, что на его поверхности формируется плотная защитная плёнка, металл обладает высокой устойчивостью к коррозии. Он не подвергается окислению на воздухе, в соленой морской воде, не меняется во многих агрессивных химических средах (например: разбавленная и концентрированная азотная кислота, царская водка). При высоких температурах титан взаимодействует с реагентами намного активнее. На воздухе при температуре 1200°С происходит его воспламенение. Возгораясь, металл даёт яркое свечение. Активная реакция происходит и с азотом, с образованием нитридной плёнки желто-коричневого цвета на поверхности титана.
Реакции с соляной и серной кислотами при комнатной температуре слабые, но при нагреве металл усиленно растворяется. В результате реакции образуются низшие хлориды и моносульфат. Также происходят слабые взаимодействия с фосфорной и азотной кислотами. Металл реагирует с галогенами. Реакция с хлором происходит при 300°С.
Активная реакция с водородом протекает при температуре чуть выше комнатной. Титан активно поглощает водород. 1 г титана может поглотить до 400 см³ водорода. Нагретый металл разлагает двуокись углерода и пары воды. Взаимодействие с парами воды происходит при температуре более 800°С. В результате реакции образуется окисел металла и улетучивается водород. При более высокой температуре горячий титан поглощает углекислый газ и образует карбид и окисел.
Способы получения
Титан является одним из самых распространённых элементов на Земле. Содержание его в недрах планеты по массе составляет 0,57%. Самая большая концентрация металла наблюдается в «базальтовой оболочке» (0,9%), в гранитных породах (0,23%) и в ультраосновных породах (0,03%). Существует около 70 минералов титана, в которых он содержится в виде титановой кислоты или двуокиси. Главные минералы титановых руд это: ильменит, анатаз, рутил, брукит, лопарит, лейкоксен, перовскит и сфен. Основные мировые производители титана – это Великобритания, США, Франция, Япония, Канада, Италия, Испания и Бельгия.
Существует несколько способов получения титана. Все они применяются на практике и вполне эффективны.
1. Магниетермический процесс.
Добывают руду, содержащую титан и перерабатывают его в диоксид, который медленно и при очень высоких температурных значениях подвергают хлорированию. Хлорирование проводят в углеродной среде. Затем хлорид титана, образовавшийся в результате реакции, восстанавливают магнием. Полученный металл нагревают в вакуумном оборудовании при высокой температуре. В результате магний и хлорид магния испаряются, остаётся титан с множеством пор и пустот. Губчатый титан переплавляют для получения качественного металла.
2. Гидридно-кальциевый метод.
Сначала получают гидрид титана, а затем разделяют его на компоненты: титан и водород. Процесс происходит в безвоздушном пространстве при высокой температуре. Образуется оксид кальция, который проходит отмывку слабыми кислотами.
Гидридно-кальциевый и магниетермический методы обычно используются в промышленных масштабах. Эти методы позволяют получить значительное количество титана за небольшой промежуток времени, с минимальными денежными затратами.
3. Электролизный метод.
Хлорид или диоксид титана подвергается воздействию высокой силы тока. В результате происходит разложение соединений.
4. Йодидный метод.
Диоксид титана взаимодействует с парами йода. Далее на титановый йодид воздействуют высокой температурой, в результате чего получается титан. Этот метод является наиболее эффективным, но и самым дорогостоящим. Титан получается очень высокой чистоты без примесей и добавок.
Применение титана
Благодаря хорошим антикоррозионным свойствам титан используют для изготовления химической аппаратуры. Высокая жаростойкость металла и его сплавов способствует применению в современной технике. Сплавы титана – это прекрасный материал для самолётостроения, ракетостроения и судостроения.
Из титана создают памятники. А колокола из этого металла известны необычайным и очень красивым звучанием. Двуокись титана является компонентом некоторых лекарственных препаратов, например: мази против кожных заболеваний. Также большим спросом пользуются соединения металла с никелем, алюминием и углеродом.
Титан и его сплавы нашли применение в таких сферах, как химическая и пищевая промышленность, цветная металлургия, электроника, ядерная техника, энергомашиностроение, гальванотехника. Вооружение, броневые плиты, хирургические инструменты и имплантаты, оросительные установки, спортинвентарь и даже украшения делают из титана и его сплавов. В процессе азотирования на поверхности металла образуется золотистая плёнка, не уступающая по красоте даже настоящему золоту.
cu-prum.ru
Титан в астрономии
Титан
Диаметр
5150 км.
Расстояние до Сатурна
1 221 865 км.
Период обращения
15,95 дня
Титан был открыт 25 марта 1655 года голландским физиком, математиком и астрономом Христианом Гюйгенсом. После открытия Джованни Кассини ещё четырёх спутников Сатурна астрономы стали называть Титан как Сатурн IV, так как он находился в четвёртой позиции от планеты. Название Титан происходит с древнегреческого и назван именем брата Кроноса (греческого аналога римского бога Сатурна).
Титан — крупнейший спутник Сатурна, второй по величине спутник в Солнечной системе (после спутника Юпитера Ганимеда), является единственным, кроме Земли, телом в Солнечной системе, для которого доказано стабильное существование жидкости на поверхности, и единственным спутником планеты, обладающим плотной атмосферой.
Титан стал первым известным спутником Сатурна — в 1655 году его обнаружил голландский астроном Христиан Гюйгенс.
Диаметр Титана — 5152 км, это на 50 % больше, чем у Луны, при этом Титан на 80 % превосходит спутник Земли по массе. Титан также превосходит размерами планету Меркурий, хотя и уступает ей по массе. Сила тяжести на нём составляет приблизительно одну седьмую земной. Масса Титана составляет 95 % массы всех спутников Сатурна.
Поверхность Титана в основном состоит из водяного льда и осадочных органических веществ, геологически молодая, в основном ровная, за исключением небольшого количества горных образований и кратеров, а также нескольких криовулканов. Плотная атмосфера, окружающая Титан, долгое время не позволяла увидеть поверхность спутника вплоть до прибытия аппарата «Кассини-Гюйгенс» в 2004 году.
Атмосфера преимущественно состоит из азота, также имеется небольшое количество метана и этана, которые образуют облака, являющиеся источником жидких и, возможно, твёрдых осадков. На поверхности имеются метан-этановые озёра и реки. Давление у поверхности примерно в 1,5 раза превышает давление земной атмосферы. Температура у поверхности — минус 170—180 °C.
Несмотря на низкую температуру, Титан сопоставляется с Землёй на ранних стадиях развития, и нельзя исключать, что на спутнике возможно существование простейших форм жизни, в частности, в подземных водоёмах, где условия могут быть гораздо комфортнее, чем на поверхности.
Орбита и вращение
Как Луна и многие другие спутники планет в Солнечной системе, Титан имеет синхронное вращение относительно планеты, ставшее результатом действия приливных сил. Это означает, что периоды вращения вокруг своей оси и обращения вокруг Сатурна совпадают, и спутник повёрнут к планете всегда одной и той же стороной. От меридиана, проходящего через центр этой стороны, ведётся отсчёт долготы.
Наклон оси вращения Сатурна составляет 26,73°, что обеспечивает смену времён года на планете и её спутниках в южных и северных полушариях. Каждый сезон длится примерно 7,5 земных лет, поскольку Сатурн делает полный оборот вокруг Солнца примерно за 30 лет. Ось вращения Титана, перпендикулярная плоскости его орбиты, почти сонаправлена оси вращения Сатурна. Последнее лето в южном полушарии Титана закончилось в августе 2009 года.
Центр масс Сатурна и Титана находится на удалении всего 30 км от центра Сатурна вследствие его превосходства по массе в 4227 раз, поэтому влияние спутника на движение планеты ничтожно мало.
Строение Титана
Титан состоит примерно наполовину из водяного льда и наполовину — из скальных пород. По составу Титан схож с некоторыми другими крупными спутниками газовых планет: Ганимедом, Европой, Каллисто, Тритоном, но сильно отличается от них составом и структурой своей атмосферы.
Атмосфера Титана
При сопоставимых размерах с Меркурием и Ганимедом, Титан обладает обширной атмосферой, толщиной более 400 км. По современным оценкам атмосфера Титана состоит на 95 % из азота и оказывает давление на поверхность в 1,5 раза больше, чем атмосфера Земли. Наличие метана в атмосфере приводит к процессам фотолиза в верхних слоях и образованию нескольких слоёв углеводородного «смога», из-за чего Титан является единственным спутником в Солнечной системе, поверхность которого невозможно наблюдать в оптическом диапазоне.
Не существует единого мнения о происхождении атмосферы. Есть несколько различных версий, но к каждой из них имеются серьёзные контраргументы.
Так, по одной теории, атмосфера Титана изначально состояла из аммиака (Nh4), затем началась дегазация спутника под действием ультрафиолетового солнечного излучения с длиной волны в основном ниже 260 нм; это привело к тому, что аммиак стал разлагаться на атомарные азот и водород, которые соединялись в молекулы азота (N2) и водорода (h3). Более тяжёлый азот опускался вниз к поверхности, а более лёгкий водород улетучивался в космическое пространство, так как низкая гравитация Титана не способна удержать и привести к накоплению этого газа в атмосфере. Однако, критики подобной теории замечают, что для подобного процесса необходимо, чтобы Титан формировался при относительно высокой температуре, при которой могло бы произойти разделение составляющих спутник веществ на каменистую сердцевину и замёрзший ледяной верхний слой.
Согласно другой теории, азот мог сохраниться со времён формирования Титана, однако в этом случае в атмосфере должно также присутствовать и много изотопа аргона-36, который тоже входил в состав газов в протопланетном диске, из которого образовались планеты и спутники Солнечной системы. Однако наблюдения показали, что в атмосфере Титана очень мало этого изотопа.
Граница атмосферы Титана находится примерно в 10 раз выше, чем на Земле. Граница тропосферы располагается на высоте 35 км. До высоты 50 км простирается обширная тропопауза, где температура остаётся практически постоянной, а затем температура начинает расти. Минимальная температура около поверхности составляет −180 °C, при увеличении высоты температура постепенно повышается и на расстоянии 500 км от поверхности достигает −121 °C. Ионосфера Титана имеет более сложную структуру, чем земная, её основная часть располагается на высоте 1200 км. Неожиданностью стало существование на Титане второго, нижнего слоя ионосферы, лежащего между 40 и 140 км (максимум электропроводности на высоте 60 км).
Единственными телами в Солнечной системе с плотной атмосферой, состоящей в основном из азота, являются Земля и Титан (разрежёнными азотными атмосферами обладают также Тритон и Плутон). Атмосфера Титана состоит из азота на 98,4 % и примерно на 1,6 % из аргона и метана, которые преобладают в основном в верхних слоях атмосферы, где их концентрация достигает 43 %. Имеются также следы этана, диацетилена, метилацетилена, цианоацетилена, ацетилена, пропана, углекислого газа, угарного газа, циана, гелия. Практически отсутствует свободный кислород.
Так как Титан не обладает существенным магнитным полем, то его атмосфера, особенно верхние слои, сильно подвержена воздействию солнечного ветра. Кроме того, она также подвержена действию космического излучения и солнечному облучению, под воздействием которых, в частности, ультрафиолета, молекулы азота и метана разлагаются на ионы или углеводородные радикалы. Эти фрагменты, в свою очередь, образуют сложные органические соединения азота или соединения углерода, в том числе ароматические соединения (например, бензол). Также в верхних слоях атмосферы образуется полиин — полимер с сопряжённой тройной связью.
Органические соединения, включающие в себя атомы азота, придают поверхности Титана и атмосфере оранжевый цвет (в частности, таков цвет неба, если смотреть с поверхности). Под воздействием Солнца весь метан был бы преобразован за 50 млн лет (очень небольшой срок по сравнению с возрастом Солнечной системы), однако этого не происходит. Это означает, что запасы метана в атмосфере постоянно пополняются. Одним из возможных источников метана может быть вулканическая активность.
Климат на Титане
Температура у поверхности Титана составляет в среднем −180 °C. Из-за плотной и непрозрачной атмосферы разница температуры между полюсами и экватором составляет всего 3 градуса. Такие низкие температуры и высокое давление противодействуют таянию водяного льда, вследствие чего в атмосфере практически нет воды.
В высоких слоях атмосферы содержится много метана; он должен был бы приводить к возникновению парникового эффекта и, как следствие, повышению температуры на спутнике. Однако оранжевый туман, состоящий из органических молекул, распространённый повсеместно в нижних слоях атмосферы, хорошо поглощает солнечное излучение и пропускает инфракрасное от поверхности, что приводит к антипарниковому эффекту и охлаждает поверхность примерно на 10 градусов.
Ветер у поверхности Титана обычно довольно слабый и составляет примерно 0,3 м/с, на небольших высотах направление ветра меняется. На высотах более 10 км в атмосфере Титана постоянно дуют довольно сильные ветры. Их направление совпадает с направлением вращения спутника, а скорость растёт с высотой с нескольких метров в секунду на высоте 10—30 км до 30 м/с на высоте 50—60 км, что приводит к образованию дифференциального вращения. На высотах более 120 км имеет место сильная турбулентность.
Метан конденсируется в облака на высоте нескольких десятков километров. Согласно данным, полученным «Гюйгенсом», относительная влажность метана повышается с 45 % у поверхности до 100 % на высоте 8 км (при этом общее количество метана, наоборот, уменьшается). На высоте 8—16 км простирается очень разреженный слой облаков, состоящих из смеси жидкого метана с азотом, покрывающий половину поверхности спутника. Слабая изморось постоянно выпадает из этих облаков на поверхность, компенсируемая испарением.
Поверхность Титана
В целом рельеф Титана относительно ровный — вариация по высоте не более 2 км, однако локальные перепады высот, могут быть весьма значительными; крутые склоны на Титане не редкость. Это является результатом интенсивной эрозии при участии ветра и жидкости. Ударных кратеров на Титане немного. Это следствие того, что их относительно быстро скрывают осадки и сглаживает ветровая эрозия. Поверхность Титана в умеренных широтах менее контрастна.
В районе экватора на ведущем полушарии расположен светлый регион размером с Австралию. Он получил название Ксанаду (Xanadu). Видны горные хребты высотой более 1 км, долины, русла рек, стекающих с возвышенностей, а также тёмные пятна (заполненные или высохшие озера). Заметна сильная эрозия горных вершин, потоки жидкого метана во время сезонных ливней могли образовать пещеры в горных склонах. К юго-востоку от Ксанаду расположено загадочное образование Hotei Arcus, представляющее собой яркую (особенно на некоторых длинах волн) дугу.
В экваториальном светлом регионе Адири обнаружены протяжённые цепи гор (или холмов) высотой до нескольких сотен метров. Предположительно, в южном полушарии может существовать массивный горный хребет протяжённостью около 150 км и высотой до 1,6 км. В горах Митрим обнаружен пик высотой 3337 метра. На вершинах гор есть светлые отложения — возможно, залежи метана и других органических материалов. Все это свидетельствует о тектонических процессах, формирующих поверхность Титана.
Имеются схожие с Ксанаду по размерам тёмные области, опоясывающие спутник по экватору, которые поначалу идентифицировались как метановые моря. Радарные исследования, однако, показали, что тёмные экваториальные регионы почти повсеместно покрыты длинными параллельными рядами дюн, вытянутых в направлении преобладающих ветров (с запада на восток) на сотни километров — т. н. «кошачьи царапины».
Тёмный цвет низменностей объясняется скоплением частиц углеводородной «пыли», выпадающей из верхних слоёв атмосферы, смываемой метановыми дождями с возвышенностей и приносимой в экваториальные районы ветрами. Пыль может быть перемешана с ледяным песком.
Возможно существование на поверхности Титана рек и озёр, наполненных жидким метаном.
Внутреннее строение Титана
Согласно расчётам, Титан имеет твёрдое ядро, состоящее из скальных пород, диаметром около 3400 км, которое окружено несколькими слоями водяного льда. Внешний слой мантии состоит из водяного льда и гидрата метана, внутренний из спрессованного, очень плотного льда. Между этими слоями возможно существование прослойки из жидкой воды.
Как и на другие спутники Юпитера и Сатурна, такие, например, как Ио и Энцелад, на Титан действуют значительные приливные силы, которые играют значительную роль в тектонических процессах спутника, разогревают его ядро и поддерживают вулканическую активность.
astroson.com
Титан строение — Справочник химика 21
Положение титана в периодической системе химических элементов и строение атома. Титан — элемент главной подгруппы IV группы. Его электронная формула следующая [c.109]Гидроксиды титана, циркония и гафния в зависимости от условий получения имеют неодинаковые состав, строение и свойства. Обычно щелочи осаждают из кислых растворов, содержащих четырехвалентный титан, гидроксид Т1(0Н)4 (наиболее часто в виде гидратов), называе- [c.82]
Благодаря тому, что атомы и ионы аналогичных элементов побочных подгрупп пятого и шестого периодов имеют не только сходное электронное строение, но и практически совпадающие размеры,— а их химических свойствах наблюдается гораздо более близкое сходство, чем в случае элементов четвертого и пятого периодов. Так, цирконий по своим свойствам значительно ближе к гафнию, чем к титану, ниобий сходен с танталом в большей степени, чем с ванадием и т. д. [c.642]
Ванадий, ниобий и тантал между собой и с металлами, близко расположенными к ним Q периодической системе (подгрупп железа, титан,1 и хрома), образуют металлические твердые растворы. По мере /величения различий в электронно.м строении взаимодействую- [c.541]
Если процесс восстановления протекает на катоде с малым перенапряжением выделения водорода, первая стадия процесса не должна определять кинетику суммарного процесса, а потенциал катода можно считать близким к равновесному. В этом случае строение двойного электрического слоя и адсорбция поверхностноактивных веществ не будут сказываться на кинетике процесса, и определять закономерности последней будет замедленность химической стадии восстановления органического вещества атомарным водородом. Если же процесс протекает на катоде с высоким перенапряжением выделения водорода, определять кинетику восстановления будет замедленность первой электрохимической стадии, и кинетические закономерности восстановления не будут отличаться от наблюдаемых для перенапряжения выделения водорода на этом металле. Плотность тока в этом случае не будет существенно зависеть от концентрации органического вещества в электролите. Подобные кинетические закономерности наблюдаются также при использовании, так называемых, переносчиков водорода, каталитических добавок ионов металлов переменной валентности, таких как титан, ванадий, хром, церий и т. д. Подобные добавки применяют в тех случаях, когда электродный процесс восстановления органического соединения требует значительно большего перенапряжения, чем восстановление иона металла переменной валентности, например в то время как восстановление органического вещества происходит без затруднений в растворе под действием который окисляется до Естественно, что кинетика суммарного процесса восстановления органического соединения в этом случае будет определяться замедленностью процесса восстановления ионов металла переменной валентности. [c.445]
Между титаном и цирконием имеется несомненное сходство, но есть и различие. Между цирконием и гафнием наблюдается исключительное химическое родство, объясняемое не только подобием строения электронных оболочек, но и тем, что их атомные и ионные радиусы почти одинаковы (следствие лантаноидного сжатия ). Атом же титана значительно меньше, поэтому валентные электроны у циркония и гафния расположены на больших расстояниях от ядра, более эффективно экранированы от него внутренними электронными оболочками и, следовательно, менее прочно связаны с ядром. Потенциалы иониза- [c.208]
Основными легирующими элементами стали являются хром, никель, молибден, вольфрам, ванадий, титан, алюминий, марганец, кремний, бор. Неизбежными примесями в сталях являются марганец, кремний, фосфор, сера. Легирующие элементы, вводимые в углеродистую сталь, изменяют состав, строение, дисперсность и количество структурных составляющих и фаз. Фазами легированной стали могут быть твердые растворы — легированный феррит и аустенит, специальные карбиды и нитриды, интерметаллиды, неметаллические включения — окислы, сульфиды, нитриды. Как правило, за счет легирования повышаются прочностные характеристики стали (пределы прочности и текучести). [c.66]
Асфальтены являются высокомолекулярными гетероциклическими соединениями с высокой реакционной способностью, состоят из сильно конденсированных структур, богаты непредельными и представляют собой типичные коллоиды. Кроме того, в асфальтенах содержится наибольшая часть таких химически высокоактивных гетероатомов, как кислород, сера, железо, а также ванадий, никель, азот и титан в активной форме в виде порфириновых соединений. Строение кокса из асфальтенов отображает структуру исходных асфальтенов, так как распределение электрических (возможно, и спиновых) плотностей у исходного сырья оставляет свои следы [15] в виде структурных особенностей в карбоидных (полимерных) образованиях, несмотря на сложность последующих деструктивных превращений при коксовании. [c.27]
Металлы с гексагональной упаковкой атомов в кристаллической решетке (например, титан и некоторые его сплавы) в отношении механических свойств при низких температурах занимают промежуточное положение между двумя предыдущими группами, приближаясь к металлам с объемноцентрированной кубической решеткой. Однако металлы последней группы при низких температурах ведут себя так, как будто у них отсутствует диапазон превращения [137, 138]. Схематично строение элементарных кристаллических ячеек различного типа представлено на рис. 43 [141]. [c.132]
Строение полимера дивинила в сильной степени зависит от способа его получения. Полимер, полученный с помощью натрия в качестве катализатора (СКБ), имеет разветвленную структуру, а полимер, полученный с помощью комплексного катализатора типа триалкилалюминий + четыреххлористый титан, имеет линейную структуру. [c.51]
Рассмотренные теоретические соотношения представляют интерес не только мри изучении строения двойного электрического слоя на типичных полупроводниках. Большая группа металлических электродов, таких, как алюминий, тантал, ниобий, титан и др., в водных растворах покрывается толстым слоем фазовых окислов, обладающих полупроводниковыми свойствами. Поэтому изучение строения границы полупроводник — раствор может оказаться полезным при исследовании строения двойного слоя на таких электродах. [c.142]
В атомах, следующих за скандием элементов, продолжается заполнение электронами Зг/-уровпей. К этим элементам относятся титан, у которого два Зй-электрона, ванадий, имеющий Зс -электрона, т. е. V(l) (2) (3s) (Зр) (3d) (4s) . Строение атома следующего элемента — хрома— имеет вид Сг(1) (2) (3s) (3p) (3ii) (4s) так как оказывается, что одному s-электрону выгоднее возвратиться на 3 -уровень. Атом марганца имеет также пять Зс/-электронов и два 4s. В атоме железа шесть 3d-электронов Fe(l) (2) (3s)2(3p) (3d) (4s)2, в атоме кобальта — семь З -электронов и в никеле — восемь. Общее количество электронов, которое может поместиться на -оболочке, равно 10 [2(2-2+1)]. Заполнение Зс -уровня или оболочки завершается в атоме меди (2=29) Си(1) [c.317]
В некоторых материалах (железо, титан) могут происходить аллотропические превращения, т. е. изменение строения кристаллической решетки (см. 1.2, а также кн. 1 данной серии). В результа
www.chem21.info
Титан и его характеристики
Общая характеристика титана
Титан очень распространен в природе; содержание титана в земной коре составляет 0,6% (масс.), т.е. выше, чем содержание таких широко используемых в технике металлов, как медь, свинец и цинк.
Минералы, содержащие титан, находятся в природе повсеместно. Важнейшими из них являются: титаномагнетиты FeTiO3×nFe3O4, ильменит FeTiO3, сфен CaTiSiO5 и рутил TiO2.
В виде простого вещества титан представляет собой серебристо-белый металл (рис. 1). Относится к легким металлам. Тугоплавок. Плотность – 4,50 г/см 3. Температуры плавления и кипения равны 1668oС и 3330oС, соответственно. Коррозионно-устойчив при на воздухе при обычной температуре, что объясняется наличием на его поверхности защитной пленки состава TiO2.

Рис. 1. Титан. Внешний вид.
Атомная и молекулярная масса титана
Относительной молекулярная масса вещества (Mr) – это число, показывающее, во сколько раз масса данной молекулы больше 1/12 массы атома углерода, а относительная атомная масса элемента (Ar) — во сколько раз средняя масса атомов химического элемента больше 1/12 массы атома углерода.
Поскольку в свободном состоянии титан существует в виде одноатомных молекул Ti, значения его атомной и молекулярной масс совпадают. Они равны 47,867.
Изотопы титана
Известно, что в природе титан может находиться в виде пяти стабильных изотопов 46Ti, 47Ti, 48Ti, 49Ti и 50Ti. Их массовые числа равны 46, 47, 48, 49 и 50 соответственно. Ядро атома изотопа титана 46Ti содержит двадцать два протона и двадцать четыре нейтрона, а остальные изотопы отличаются от него только числом нейтронов.
Существуют искусственные изотопы титана с массовыми числами от 38-ми до 64-х, среди которых наиболее стабильным является 44Ti с периодом полураспада равным 60 лет, а также два ядерных изотопа.
Ионы титана
На внешнем энергетическом уровне атома титана имеется четыре электрона, которые являются валентными:
1s22s22p63s23p63d24s2.
В результате химического взаимодействия титан отдает свои валентные электроны, т.е. является их донором, и превращается в положительно заряженный ион:
Ti0 -2e → Ti2+;
Ti0 -3e → Ti3+;
Ti0 -4e → Ti4+.
Молекула и атом титана
В свободном состоянии титан существует в виде одноатомных молекул Ti. Приведем некоторые свойства, характеризующие атом и молекулу титана:
|
Энергия ионизации атома, эВ |
6,82 |
|
Относительная электроотрицательность |
1,54 |
|
Радиус атома, нм |
0,147 |
Сплавы титана
Главное свойство титана, способствующее его широкому применению в современной технике – высокая жаростойкость как самого титана, так и его сплавов с алюминием и другими металлами. Кроме того, эти сплавы жаропрочностью – стойкостью сохранять высокие механические свойства при повышенных температурах. Все это делает сплавы титана весьма ценными материалами для самолето- и ракетостроения.
При высоких температурах титан соединяется с галогенами, кислородом, серой, азотом и другими элементами. На этом основано применение сплавов титана с железом (ферротиттана) в качестве добавки к стали.
Примеры решения задач
ru.solverbook.com
