Тринитротолуол • Аркадий Курамшин • Научная картинка дня на «Элементах» • Химия

На фото — кристаллический препарат тринитротолуола (2,4,6-тринитротолуол, C7H5N3O6). Тринитротолуол, или ТНТ, или тротил, входит в первую десятку органических веществ, название которых легко вспоминает человек, далекий от химии. В начале ХХ века он интенсивно использовался в качестве бризантного взрывчатого вещества военного и промышленного назначения. Тринитротолуол-тротил до сих пор служит эквивалентом для оценки количества энергии, выделяемой при ядерных взрывах, подрывах химических взрывчатых устройств, падениях астероидов и комет, взрывах вулканов.
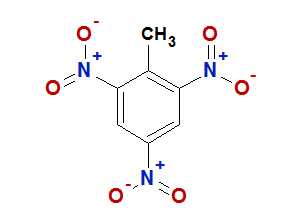
При комнатной температуре тринитротолуол представляет собой желтое кристаллическое вещество. Впервые он был получен в 1863 году немецким химиком Юлиусом Вильбрандом (на многих интернет-ресурсах этот синтез и открытие тринитротолуола ошибочно приписывают его отцу — немецкому врачу и судебному медику Йозефу Вильбранду). Тринитротолуол получают, обрабатывая толуол азотной кислотой в присутствии концентрированной серной кислоты и олеума — раствора SO
Непосредственно после первого успешного синтеза тринитротолуола его потенциал как нового взрывчатого вещества не был раскрыт. До 1890-х годов тринитротолуол, получаемый в скромных количествах, использовали только в качестве желтого красителя для текстиля. Исследователи не смогли разглядеть в нем взрывчатое вещество три десятка лет из-за того, что это соединение не так легко детонирует. По сравнению с основными взрывчатыми веществами, которые в те времена рассматривались как замена дымному пороху, — тринитроглицерином или нитроцеллюлозой — тринитротолуол считался исключительно устойчивым, да и мощность его взрыва меньше, чем у нитроцеллюлозы и нитроглицерина. Разглядеть в тринитротолуоле потенциальную взрывчатку удалось только в 1891 году другому немецкому химику — Карлу Хойссерманну (Karl Häussermann).
Стать «эталонным» взрывчатым веществом тринитротолуолу помогли относительная простота и дешевизна его промышленного получения, безопасность при хранении, транспортировке и легкость снаряжения им боеприпасов. Тротил можно расплавить, заполнить его расплавом любую емкость или придать обусловленную тем или иным применением форму. Такое возможно из-за того, что температура плавления тринитротолуола составляет 80°С, а температура разложения — 240°С, поэтому в отсутствие искр или источников открытого огня работа с расплавленным тротилом практически безопасна, чего нельзя сказать про работу с нитроглицерином или нитроцеллюлозой.

С 1890-х годов тринитротолуол стал использоваться как взрывчатое вещество гражданского назначения. Из него изготавливали тротиловые шашки для горных работ, расчистки ландшафта при прокладке железных и автодорог, сносе зданий. Снаряжение артиллерийских боеприпасов, мин и бомб тротилом началось в 1902 году, первыми были немцы, в 1907 году технологию производства тротиловых боеприпасов освоили британцы. Первое полномасштабное применение произошло во время Первой Мировой войны. Практика показала, что тринитротолуол оказался более удобным для ведения боевых действий, чем его основной конкурент того времени — пикриновая кислота (см. тринитрофенол). Боеприпасы с пикриновой кислотой, в отличие от снарядов с тринитротолуолом, могли самопроизвольно взрываться от удара. Это происходило из-за того, что пикриновая кислота могла реагировать с металлами, из которых изготавливали артиллерийские гильзы, образуя при этом взрывоопасные соли — пикраты. Также пикриновая кислота относительно хорошо растворяется в воде (при 20°С в 1 литре воды растворяется уже 12,7 г кислоты), а значит, она могла поглощать воду из влажного воздуха, теряя при этом взрывчатую способность. С тринитротолуолом такого не происходит: он плохо растворяется в воде (при 20°С в 1 литре воды растворяется всего 0,13 г вещества).
При взрыве тринитротолуол разлагается в соответствии со следующим уравнением:
2C7H5N3O6 → 3N2 + 5H2O + 7CO + 7C.
Если посчитать объем выделяющихся при взрыве тротила газов, даже занижая оценку (то есть приводя его к комнатной температуре и считая в этих условиях газами только азот и угарный газ), то объем продуктов детонации будет примерно в 800 раз больше объема самого тринитротолуола. Уже такая оценка говорит о тротиле как о мощном взрывчатом веществе (взрыв — химическая реакция, сопровождающаяся в том числе и значительным изменением объема). При взрыве тринитротолуола значительно увеличивается температура, при этом выделяющаяся при его разложении вода будет газообразной, а продукты взрыва займут больший объем, чем при комнатной температуре. Поэтому на самом деле объем продуктов разложения будет в тысячи раз превосходить объем самого взрывчатого вещества. Резкое увеличение объема и определяет мощность взрывчатки. Точно рассчитать или измерить энергию взрыва образца тринитротолуола невозможно: эту величину можно знать, только зная температуру взрыва, а она, в свою очередь, зависит от типа взрыва — при детонации в замкнутом объеме температура выше, чем в открытом. Для стандартизации принято считать, что при взрыве килограмма тротила выделяется 4,2×10
Хотя основное применение тринитротолуола — снаряжение боеприпасов, не нужно забывать, что он использутся и в мирных целях: при строительстве туннелей, для сноса старых зданий и расчистки земли под реновацию инфраструктуры городов. Из тринитротолуола получают 1,3,5-тринитробензол и 1,3-динитробензол, которые тоже являются взрывчатыми веществами, но, в отличие от тротила, используются не самостоятельно, а в композициях с нитроцеллюлозой при изготовлении бездымного пороха. Тринитротолуол считается канцерогеном и веществом, вызывающим анемию и поражение печени. Также он оказывает раздражающее действие на кожу, окрашивая ее в желтый или оранжевый цвет, так что совсем уж безопасной работу с тринитротолуолом назвать нельзя.
Фото с сайта aiexplosives.com.
Аркадий Курамшин
elementy.ru
Тринитротолуол — Википедия. Что такое Тринитротолуол
 | |
| Общие | |
|---|---|
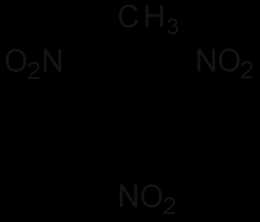
| Систематическое наименование | 2,4,6-тринитрометилбензол |
| Традиционные названия | тротил, тол |
| Хим. формула | C7H5N3O6 |
| Физические свойства | |
| Состояние | твёрдое |
| Молярная масса | 227,13 г/моль |
| Плотность | 1,65 ± 0,01 г/см³[1] и 1600 ± 100 кг/м³ |
| Энергия ионизации | 10,59 ± 0,01 эВ[1] |
| Термические свойства | |
| Т. плав. | 80,85 °C |
| Т. кип. | 295 °C |
| Давление пара | 0,0002 ± 0,0001 мм рт.ст.[1] |
| Классификация | |
| Рег. номер CAS | 118-96-7 |
| PubChem | 8376 |
| Рег. номер EINECS | 204-289-6 |
| SMILES | |
| InChI | |
| RTECS | XU0175000 |
| ChEBI | 46053 и 46051 |
| ChemSpider | 8073 |
| Безопасность | |
| Токсичность | Взрывоопасен, токсичен |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Тринитротолуо́л (2,4,6-тринитротолуол, 2,4,6-тринитрометилбензол, тротил,тол, TNT) — одно из наиболее распространённых бризантных взрывчатых веществ. Представляет собой желтоватое кристаллическое вещество с температурой плавления 80,85 °C (плавится в очень горячей воде).
Физические свойства
История
Тринитротолуол был получен в 1863 году немецким химиком Юлиусом Вильбрандом. В 1891 году в Германии началось промышленное производство тротила. С 1902 года в германской и американской армиях начали использовать боеприпасы, снаряжённые тротилом вместо пикриновой кислоты. В России промышленное производство тротила началось в 1909 году на Охтинском заводе по немецкой технологии.
Тротил стал основным взрывчатым веществом для снаряжения боеприпасов благодаря удачному сочетанию достаточной мощности с низкой чувствительностью, возможностью переработки литьем. Его массовое производство стало возможным в результате развития нефтехимической промышленности[3].
Получение
Первый этап: нитрование толуола смесью азотной и серной кислот до моно- и динитротолуолов. Серная кислота используется как водоотнимающий агент.
- 2C6H5Ch4→HNO3,h3SO4C6h5Ch4(NO2)+C6h4Ch4(NO2)2{\displaystyle {\mathsf {2C_{6}H_{5}CH_{3}{\xrightarrow[{}]{HNO_{3},H_{2}SO_{4}}}C_{6}H_{4}CH_{3}(NO_{2})+C_{6}H_{3}CH_{3}(NO_{2})_{2}}}}
Второй этап: смесь моно- и динитротолуола нитруют в смеси азотной кислоты и олеума. Олеум используется как водоотнимающий агент.
- C6h5Ch4(NO2)+C6h4Ch4(NO2)2→HNO3,h3SO4C6h3Ch4(NO2)3{\displaystyle {\mathsf {C_{6}H_{4}CH_{3}(NO_{2})+C_{6}H_{3}CH_{3}(NO_{2})_{2}{\xrightarrow[{}]{HNO_{3},H_{2}SO_{4}}}C_{6}H_{2}CH_{3}(NO_{2})_{3}}}}
Излишек кислоты от второго этапа можно использовать для первого.
Применение
Применяется в промышленности и военном деле как самостоятельно в гранулированном (гранулотол), прессованном или литом виде, так и в составе многих взрывчатых смесей (алюмотол, аммонал, аммонит, аммотол и другие).
Тротил менее чувствителен к трению и нагреванию, чем многие другие взрывчатые вещества, например, динамит, и загорается только при температуре 290 °C, поэтому может быть относительно безопасно нагрет до температуры плавления. Это очень удобно, так как позволяет легко придать нужную форму при помощи литья. Литой или прессованный тротил можно поджечь. Он горит без взрыва желтоватым пламенем. Для взрыва обычно необходимо использование детонатора, однако порошкообразный тротил с примесями может иметь повышенную чувствительность к внешним воздействиям, в том числе и к пламени.
Несмотря на широкую распространённость тринитротолуола, в настоящее время его стараются заменить на более экономичные и более безопасные малочувствительные взрывчатые вещества. Например, Вооружённые силы США, начиная с 2010 года, заменяют тротил в крупнокалиберных снарядах на вещество IMX-101.
Обладает свойствами антимикотика, ранее применялся в медицине в составе противогрибковых препаратов «Ликватол» и «Унгветол». Из-за токсичности и появления более эффективных лекарственных средств практически вышел из медицинского употребления, но иногда служит солдатам сырьём для изготовления кустарных противогрибковых мазей.
См. также
Примечания
- ↑ 1 2 3 http://www.cdc.gov/niosh/npg/npgd0641.html
- ↑ Тротил не взрывается, если его уронить, даже если его прострелить из винтовки. Для взрыва требуется сильная ударная волна (детонация)
Ландау Л. Д., Китайгородский А. И. Физика для всех: Молекулы. — 5-е изд., испр. — М.: Наука. Главная редакция физ.-мат. литературы, 1982. — с. 167—172. — 208 с. - ↑ 2,4,6- Тринитротолуол
Литература
- Поздняков З. Г., Росси Б. Д. Справочник по промышленным взрывчатым веществам и средствам взрывания. — М.: Недра, 1977.
- Орлова Е. Ю. Химия и технология бризантных взрывчатых веществ. Учебник для вузов. — Изд. 3-е, перераб. — Л.: Химия, ленинградское отделение, 1981. — 312 с.
- Бирюков М. Всех взрывчаток командир (рус.) // Оружие : журнал. — 2016. — № 05. — С. 50-53. — ISSN 1728-9203.
wiki.sc
Справочник, свойство взрывчатых веществ, получение ВВ
Физико-химические свойства:
Бесцветное кристаллическое вещество, желтеющее на свету. Твердость по Моосу 1.2. Технический имеет светло- или темно-желтый цвет и плавится при 76-77.5°С, его применяют для изготовления промышленных ВВ. Тротил, предназначенный для военного применения должен иметь температуру плавления не менее 80.2°С. Почти нерастворим в воде (0.015г на 100г воды при 25°С, 0.15г на 100г воды при 100°С). Хорошо растворим в ацетоне (при 20°С — 109 г /100 г растворителя, при 50°С — 346 г /100 г), дихлорэтане, пиридине, бензоле, толуоле, HNO3, хуже — в 95% спирте (1.23г на 100г при 20°С, 19.5г на 100г при 75°С), в конц. H2SO4. Токсичен, зарегистрированы многочисленные случаи отравления на производстве. ПДК в Чехии 1.5мг/м3, в США 0.5мг/м3. При частом контакте поражается печень и кроветворные органы. Плотность 1.663 г/см3, 1.467 г/см3 при 82°С (Плотность переплавленного 1.54 — 1.6 г/см3). С водными и спиртовыми растворами щелочей образует окрашенные комплексы — тротилаты, обладающие высокой чувствительностью к мех. и тепловым воздействиям с t всп. 50 — 60°С, поэтому при получении нельзя использовать содовую промывку. При длительном световом воздействии образуется смесь различных веществ коричневого цвета, имеющих довольно высокую чувствительность к мех. воздействиям.
Восприимчивость к нагреванию и внешним воздействиям:
Выше 50°С становится полупластичным. t пл. чистого продукта 80.9°С. t начала разл. 160°С, t нтр. 250°С. t всп. 290°С, проявляет термостойкость до 215°С. Чувствителен к огню, легко загорается, горит спокойно, ярким коптящим пламенем. При сжигании больших количеств может детонировать. Малочувствителен к механическим воздействиям. Не реагирует на прострел винтовочной пулей. При повышении температуры чувствительность к удару заметно увеличивается. Восприимчивость к детонации: минимальный инициирующий заряд 0.36г для гремучей ртути и 0.09г для азида свинца. Литой тротил менее восприимчив к детонации чем прессованный, не детонирует от детонатора №8, поэтому для его подрыва используют промежуточные детонаторы.
Табл. 19 Критический диаметр и время реакции для тротила.
Тротил |
Плотн. г/см3 | Крит. Д. мм | Время мксек |
|---|---|---|---|
Литой |
1.62 |
16 |
0.3 |
Прессованный |
— |
9 |
0.05 |
Молотый |
1.0 |
3 |
0.1 |
Чувствительность к удару при h=25 см и грузе 10 кг 4 — 8% (пикриновая кислота (тринитрофенол) -24-32%, тетрил — 50-60%, гексоген — 70-80%, октоген — 80%, ТЭН — 100%). 12tool 2.5кг (50%) — 148см Чувствительность к трению 29.5кгс (ТЭН — 4.5кгс, гексоген — 11.5кгс, октоген — 10кгс).
Энергетические характеристики:
Теплота образования -17.8 ккал/моль, энтальпия образования -70.6ккал/кг. Теплота взрыва 4.19 МДж/кг (860ккал/кг при 1.0г/см3, 1030ккал/кг при 1.6г/см3 ). Скорость детонации до 6950-7000 м/с при 1.64 г/см3. (при 1.60 г/см3 давление на фронте детонационной волны 19ГПа, Скорость детонации 6800 м/с. Температура взрыва 3000К). Бризантность по Гессу 16мм — заряд 50г при плотности 1.0г/см3 (гексоген -18мм, заряд 25г), по Касту 3.6 мм (гремучий студень -4.8мм, нитроглицерин — 4.6мм, тетрил -4.2мм, тринитрофенол 4.1мм, динитробензол 2.1мм, пироксилин -3.0мм, амматол 50/50 -2.5мм, 62% динамит -3.9мм), песочная проба — 48г раздробленного песка (гексоген — 59г, гремучая ртуть 23г). Объем продуктов взрыва 730 л/кг. Метательная способность по октогену 76% (плотн. 1.569 г/см3, торцевое метание). Фугасность 285мл (гексоген 490мл). При добавлении 5-10% серы сила взрыва и детонац. способность увеличивается, а t всп уменьшается.
Применение:
Впервые был получен в 1863г Вильбрандом (Wilbrand), в 1891г началось промышленное производство в Германии. С 1902г начал заменять пикриновую кислоту в германской и американской армиях, а в 1 мировую войну уже использовался всеми воюющими сторонами, хотя применение несколько сдерживалось с одной стороны большими накопленными запасами пикриновой кислоты, с другой стороны некоторым дефицитом толуола, получаемого в качестве побочного продукта из каменоугольной смолы. Непрерывная технология производства была освоена в 1918г. В России промышленное производство тротила началось в 1909г на Охтинском заводе по немецкой технологии, непрерывный процесс был внедрен в 1936г. После 1 мир. войны стал основным взрывчатым веществом для снаряжения боеприпасов благодаря удачному сочетанию удовлетворительной мощности с низкой чувствительностью, возможностью переработки литьем и наличием широкой сырьевой базы в результате развития нефтехимической промышленности. Тринитротолуол выпускается порошкообразный, чешуйчатый, гранулированный, прессованный и плавленый. Применяется в чистом виде и в смесях с аммиачной селитрой (См. также «аммониты», гексогеном, динитронафталином, ТЭНом, гексилом, алюминием и т.д., для производства боеприпасов, промежуточных детонаторов и взрывных работ, изредка как компонент твердых ракетных топлив. Для снаряжения крупнокалиберных бронебойных снарядов чувствительность чистого тротила оказывается достаточно высокой, поэтому его используют с добавкой неск. процентов флегматизатора — озокерита, воска или полимеров, в последнее время с веществами — «ловушками радикалов» (Подробнее см. раздел «Смеси мощных бризантных ВВ с флегматизатором «). Во время 2 мир войны в бронебойных снарядах применялся т.н. «Флегматизированный тротил», состоящий из 94% тротила, 4% нафталина и 2% динитробензола. Тротил-сырец и динитротолуол (обычно смесь разл. модификаций или тротиловое масло) используют для изготовления взрывчатых смесей, напр. аммонитов, очищенный от примесей динитротолуол — как пластификатор бездымного пороха. В России очень широко потребляется промышленностью так, в послевоенные годы, на снаряжение боеприпасов уходило менее 10% производимого тротила. В 90-х годах с окончанием холодной войны производство тротила стремительно сокращалось во многих странах. Армия же использовала тротил из резервов. С истощением старых запасов, полного восстановления производства так и не произошло, поэтому в настоящее время наблюдается дефицит тротила на мировом рынке и значительное повышение его цены, что заставило производителей ВВ искать альтернативу этому ВВ. Например в США литьевые смеси на базе тротила начали заменять более дешевыми композициями на основе динитроанизола.
Получение:
В лаборатории тротил получают трехстадийным нитрованием толуола C6H5CH3 нитрующей смесью, в пром-ти — непрерывным противоточным нитрованием. От несимметричных изомеров, динитропроизводных, следов тетранитрометана ТНТ очищают обработкой водным раствором сульфита натрия Na2SO3 или перекристаллизацией из горячего спирта (1:3) или толуола. (аналогичную очистку используют и для многих других ароматических нитросоединений). В последнее время применяется перекристаллизация из азотной кислоты средней концентрации. В Советском Союзе использовался также метод очистки тротила от основного кол-ва маслянистых примесей последовательной промывкой тротила-сырца 70 и 45% серной кислотой в кол-ве по 800 кг на 1000кг ТНТ. Плохо очищенный тротил содержит легкоплавкие примеси динитропроизводных и несимметричных изомеров (т.н. тротиловое масло), которые могут вытекать из заряда при хранении, и послужить причиной отказов или возникновения опасных перегрузок при выстреле. Поэтому тротил, подлежащий продолжительному хранению должен быть обязательно очищен.При медленном охлаждении расплава тринитротолуола — сырца, формируются крупные кристаллы достаточно чистого тротила, а тротиловое масло остается на поверхности кристаллов, что тоже используется для очистки. Тротиловое масло можно отделить выдержкой продукта при 60°С в течение неск. часов, при этом легкоплавкие примеси выделяются на поверхности и стекают вниз в специальную емкость.
Также тринитротолуол может быть получен нитрованием толуола смесями нитрата калия (натрия, аммония) с конц. серной кислотой, однако в этом случае образуется большее количество изомеров чем при использовании серно-азотных смесей, и поэтому требуется тщательная очистка.
1) Получение нитрованием толуола в 3 стадии:
Для синтеза берут 20г толуола. Количество нитрующей смеси состава 65% серной кислоты, 10% азотной кислоты, 25% воды определяют из условия что азотной кислоты необходимо взять на 5-7% больше теоретического (в пересчете на получение мононитротолуола). К помещенной в колбу кислотной смеси из капельной воронки приливают толуол при постоянном помешивании. Приливание ведут таким образом чтобы температура смеси поднялась до 40-45°С, время слива 30мин. Затем в течение 30 мин температуру повышают до 50°С, выдерживают при этой температуре и перемешивании еще полчаса. Смесь охлаждают и отделяют верхний слой мононитротолуола. Выход 95-97%.
Мононитротолуол, полученный на первой стадии приливают к кислотной смеси состава 75% серной кислоты, 10% азотной кислоты, 15% воды. Количество нитросмеси определяют из условия что азотной кислоты необходимо взять на 15-20% больше теоретического. В колбу наливают кислотную смесь, нагревают ее на водяной бане до 30°С и при перемешивании приливают мононитротолуол таким образом, чтобы температура к концу смешения достигла 75°С. Время слива 45мин. Т.к. теплоты реакции недостаточно для указанного повышения температуры, одновременно осторожно нагревают водяную баню. После окончания слива мононитротолуола реакционную массу в течение получаса нагревают до 95°С, выдерживают 30мин, охлаждают до комнатной температуры и выливают в 5-ти кратный объем воды. Осадок отфильтровывают, промывают водой и сушат. Выход динитротолуола 93-95% по МНТ.
Динитротолуол, полученный на второй стадии добавляют к кислотной смеси состава 83% серной кислоты, 17% азотной кислоты. Количество нитросмеси определяют из условия что азотной кислоты необходимо взять на 100% больше теоретического. Смесь нагревают до 80°С и выдерживают при перемешивании до тех пор, пока температура смеси не начнет падать. Затем реакционную смесь в течение часа нагревают до 110°С и дают часовую выдержку. По окончании, смесь охлаждают до 80°С и при работающей мешалке приливают по каплям 100мл воды для выделения тротила из отработанной кислоты. Отделение продукта проводят в делительной воронке с подогревом. Расплавленный продукт выливают в чашку и взвешивают. Добавляют трехкратное по весу кол-во горячей воды и перемешивают при 90-92°С в течение 10 мин. Промывку повторяют несколько раз. Выход 87-90% по ДНТ.
Следует отметить, что для хорошей скорости реакции на стадиях получения МНТ и ДНТ необходимо интенсивное перемешивание, т.к. нитрование идет, в основном, по поверхности производных толуола. На третьей стадии, при образовании ТНТ из ДНТ на скорость реакции перемешивание влияет мало.
Очистка: Тротил полученный в результате нитрования содержит примеси в кол-ве более 5% (несимметричные тринитротолуолы, динитротолуолы, продукты окисления и др.), которые придают продукту маслянистость. Используются следующие виды очистки:
Перекристаллизация из спирта: В колбу с обратным холодильником загружают тротил и взятую в 3-5 кратном избытке смесь 95% спирта и 5% толуола. Смесь нагревают в водяной бане и кипятят до полного растворения тротила. Раствор фильтруют (если в нем есть мех. примеси) и медленно охлаждают до комнатной температуре при перемешивании. Выделившиеся кристаллы отфильтровывают, дважды промывают небольшим кол-вом спирта и сушат.
Перекристаллизация из 63% азотной кислоты: 1 ч тротила смешивают с 3 ч 63% азотной кислоты, нагревают суспензию до 65-70°С и при перемешивании выдерживают до полного растворения. Затем дают массе в течение получаса охладиться до 23-30°С. Кристаллы отфильтровывают, 2 раза промывают 63% азотной кислотой и холодной водой до нейтральной реакции на лакмус.
Очистка расплавленного тротила сульфитом натрия Na2SO3: В колбу помещают тротил (отмытый от кислот) и воду в соотношении 1:2 по весу, нагревают до 78-79°С и приливают 10% р-р сульфита натрия (0.1 моля на моль тротила) Время слива раствора сульфита 5-7мин. Затем выдержка 15мин при 78-79°С. Тротил отделяют от маточника, помещают снова в воронку и промывают при интенсивном перемешивании 3-мя порциями воды с температурой 79-80°С, 80-85°С и 85-90°С. Продукт сушат. Выход около 85% от исходного.
2) Получение тринитротолуола в одной емкости из 70% азотной кислоты: К 3820 г 70% азотной кислоты постепенно в течение 2 часов добавляют 8404г 98% серной кислоты. Затем 1910 мл нитросмеси наливают в отдельную емкость и эту емкость помещают в миску с холодной водой. Когда смесь охладится до 10-15°С, медленно добавляют 920г толуола в течение 4 часов при постоянном помешивании и удерживании указанной температуры. Продолжают перемешивание еще 2 часа. Затем добавляют оставшуюся кислоту и нагревают до 70°С и выдерживают при этой температуре и постоянном помешивании 2 часа. Подогревают еще до 80°С и выдерживают еще 2 часа, смеси дают остыть до комнатной температуры и выливают в 5л холодной воды. Осадок отфильтровывают, промывают 2л холодной воды и отжимают. Для очистки помещают 1.6кг 70% серной кислоты в стакан и добавляют тринитротолуол. Смесь перемешивают 2 часа при комнатной температуре, отфильтровывают тринитротолуол, промывают его 2л холодной воды и сушат.
3) Получение тринитротолуола без использования серной кислоты: 920г толуола, смешивают с 2700г 99% азотной кислоты и 3000г бензина, смесь помещают в колбу с обратным холодильником, полость холодильника заполнена снизу кусочками битого стекла, а сверху безводным сульфатом натрия. Смесь нагревают до 80°С (не допуская перегрева выше 85°С). Приблизительно через 3 часа нижний слой азотной кислоты исчезнет нагрев прекращают и дают смеси остыть до комнатной температуры. Затем добавляют 3000мл горячей воды и перемешивают в течение 2 часов. Выпавший в осадок тринитротолуол отфильтровывают, декантируют верхний слой бензина и испаряют его до 20% от первоначального объема. Смесь охлаждают, отфильтровывают тротил, объединяют его с первой порцией тротила, промывают 2л хол. воды и сушат. Очистка как и в методе 2). Метод основан на способности бензина образовывать с водой азеотропную смесь.
Литература:
- T. Urbanski — Chemistry and Technology of Explosives Vol 1 — Pergamon Press. Oxford. 1964- P. 265-393.
- Encyclopedia of explosives and related items./ Basil T. Fedoroff & Oliver E. Sheffield. Vol 9 — Piccatiny Arsenal Dover, New Jersey, USA — 1980. T235-T298.
- Rudolf Meyer «Explosives», Fifth Edition. Wiley-VCH Verlag GmbH. (Electronic) 2002 p339.
- Dobratz B.M. LLNL Explosives Handbook Properties of Chemical Explosives and Explosive Simulants -LLNL University of California, Livermore, California — (UCRL — 52997, 1985).
- Jared B. Ledgard. The Preparatory manual of explosives. Washington. Second Edition p180-185.
- Хмельницкий Л.И. Справочник по бризантным взрывчатым веществам Ч2 — М 1962 С 506.
- Энергетические конденсированные системы. Краткий энциклопедический словарь/ Под Ред. Б.П.Жукова. Изд 2-е исправл — М. Янус К. 2000 с. 552.
- Орлова Е.Ю. и др. Руководство к лабораторному практикуму по получению нитросоединений. М. 1969 Стр. 75.
- Взрывчатые вещества, пиротехника, средства инициирования в послевоенный период. Научное издание. Издательство «Гуманистика», М-СПб, 2001.
Автор: Vandal (2012-04-01)
exploders.info
Тротил применение — Справочник химика 21
В качестве взрывчатых веществ применяют нитроглицерин, аммиачно-селитренный динамит, тротил и другие. Известны исследования по проведению взрыва в самом пласте. Для этого в пласт нагнетают раствор нитроглицерина в спирте, а затем производят взрыв. Выдвигались предложения применять для этой цели атомные взрывы. Известно также применение взрывных торпед направленного действия. [c.129]Применение. Бензол служит исходным продуктом в производстве красящих и лекарственны х веществ, синтетического волокна, ряда пластмасс. Из него получают фенол, нитробензол, анилин и многие ароматические углеводороды. Толуол применяют для получения взрывчатого вещества тротила (тринитротолуола) [c.325]
Во время второй мировой войны тротил являлся основным бризантным взрывчатым веществом. Если в первую мировую войну наряду с тротилом применялись в значительных количествах и другие нитропроизводные ароматических соединений, то во вторую мировую войну исключительное применение имели тротил или смесн на его основе (аммо- [c.80]
Производство тротила без применения кислотооборота имело место в самый ранний период при этом все три кислотных смеси— для 1-й, 2-й и 3-й фаз нитрации — готовились на свежих кислотах. Впоследствии начали применять часть отработанной кислоты [c.114]
Применение тротила. Требования к качеству тротила, применяемого для снаряжения артиллерийских снарядов. Рассмотрим тротил с точки зрения требований, обусловленных характером службы боеприпасов. [c.140]
Применение тротила. Тротил применяется во многих странах для снаряжения всех видов боеприпасов артиллерийских снарядов, авиабомб, морских мин, для изготовления подрывных патронов и др. Во время империалистической войны 1914— 1918 гг. тротил применялся в огромных количествах в смесях с аммиачной селитрой для снаряжения многих видов боеприпасов (амма- [c.141]
При промывке тротила без водооборота расход воды составляет р JK и более на 1 пг тротила. С применением водооборота расход [c.163]
Кристаллизация тротила из отработанной кислоты. Этот метод был впервые предложен и применен в Ита-, ЛИИ- Он состоит в следующем. [c.191]
Качество тротила, полученного по этому способу, ниже, чем полученного перекристаллизацией из спирта или сульфитной очисткой. Для получения тротила нормального качества кристаллический продукт после промывки водой (без расплавления тротила) подвергается дополнительной сульфитной очистке с применением вдвое или втрое меньшего количества сульфита натрия, чем при сульфитной промывке тротила-сырца. После этого тротил промывается горячей водой и сушится в расплавленном виде. [c.192]
Процесс был усовершенствован применением фенола тринитротолуол смешивался с фенолом и медленно охлаждался. При этом фенол образует эвтектику с примесями тринитротолуола. Эвтектика отжималась на центрифуге, а тротил промывался затем водой для полного удаления фенола. Получался тротил с температурой затвердевания 80°. [c.194]
Перекристаллизация тетрила из дихлорэтана. Как при перекристаллизации тротила, так и при перекристаллизации тетрила применение горючих летучих растворителей вносит значительный дополнительный источник возможности возникновения пожара и взрыва в производстве. Поэтому издавна стремились к замене этих растворителей негорючими. В Америке применяют для перекристаллизации тетрила менее горючий дихлорэтан. Вследствие большей растворимости тетрила в дихлорэтане, чем в бензоле, тетрил и ди- хлорэтан берутся в отношениях 1 1,7, что позволяет уменьшить [c.361]
Особый интерес, проявленный в Германии к тротилу, обусловлен требованием морской артиллерии на бронебойный снаряд, для которого требовалось очень мало чувствительное к механическим воздействиям взрывчатое вещество, не взрывающееся в момент удара снаряда о броню. Применение для этой цели тротила позволило наилучшим образом разрешить эту задачу. [c.416]
Большое значение имеют процессы, в которых все компоненты, участвующие в горении, первоначально находятся в конденсированной (твердой или жидкой) фазе. Это может быть как химическое соединение, так и механическая смесь. Взрывчатым веществом может быть любое эндотермическое соединение, способное к быстрому распаду. Наибольшее практическое значение имеют органические нитросоединения, содержащие слабо связанный кислород в виде нитрогруппы Здесь в одной молекуле содержатся одновременно горючее й окислитель. Сюда относятся такие классические взрывчатые вещества, как нитроглицерин, тринитротолуол (тротил), тетранитропентаэритрит (ТЭН), а также основа бездымных коллоидных порохов — нитроклетчатка (пироксилин). К соединениям со слабо связанным кислородом относятся также органические перекиси и озониды многие из них являются сильными взрывчатыми веществами, но практического применения не получили из-за слишком высокой чувствительности. [c.271]
Ароматические амины. Бевингтон и Трот [73] подробно исследовали поведение дифениламина в реакциях передачи цепи методом меченых атомов. Замена аминного водорода на дейтерий привела к выводу, что первичная реакция — отщепление аминного водорода. Применение дифениламина, меченного тритием в кольце, позволило установить долю полимерных молекул, содержащих осколки дифениламина. Сопоставление этих данных с кинетическими измерениями привело к выводу, что радикал дифенилазота с полимерным радикалом реагирует в основном по механизму диспропорционирования, что приводит к регенерации исходного дифенила. [c.170]
Ароматические углеводороды, содержащиеся в продуктах нефтепереработки, в настоящее время находят пшрокое применение в качестве исходного сырья для нефтехимической промышленности. Так, бензол служит исходным продуктом для получения полиамидных волокон типа капрон и нейлон, синтетического каучука и пластических масс на базе фенола. Параксилол используется в качестве сырья для получения нового высокопрочного полиэфирного волокна типа терилена. Ортоксилол служит исходным материалом для производства фталевого ангидрида, метаксилол — для получения изофталевой кислоты и на ее основе алкидных смол. Этилбензол используется для получения стирола, служащего совместно с бутадиеном для получения сополимерного стирольного каучука, а также для получения полистирольных пластмасс. Толуол используется для получения взрывчатых веществ — нитротолуола и тринитротолуола (тротила). Кроме этого, ароматические углеводороды служат исходным материалом для промышленного получения большого ассортимента органических красителей, фармацевтических препаратов, душистых и вкусовых веществ, отравляющих веществ, синтетических моющих средств и т. п. 13]. [c.271]
Т о л у о л — жидкость, т. пл. — 93°, т. кип. 110,6°. Главное применение — производство взрывчатых веществ (тринитротолуол, тротил), бензойного альдегида и хлористого бензила — полупродуктов анилокрасочной, парфюмерной, пищ
www.chem21.info
Тротил — Справочник химика 21
Толуол обычно пользуется большим спросом в военное время как сырье для производства тринитротолуола (тротила). Использование толуола для органического синтеза по масштабам значительно уступает использованию бензола. Метилстирол можно получать не только через кумол, но и путем алкилирования толуола этиленом с последующим дегидрированием. Алкилирование то- [c.588]Гомологи бензола (толуол, ксилолы) нитруются еш,е легче, чем бензол. Из толуола образуются преимущественно о- и -нитротолуолы (орто-соединения получается несколько больше) и-нитротолуол содержится в реакционной смеси лишь в незначительном количестве. При дальнейшем нитровании орто- и пара-соединения превращаются в ди-нитротолуолы и, наконец, в 2,4,6-тринитротолуол ( тротил ) [c.527]
Толуол может быть использован в качестве высокооктановой добавки к бензинам и как сырье для производства взрывчатого вещества тринитротолуола (тротила). [c.23]
ТРОТИЛОВЫЙ ЭКВИВАЛЕНТ, ТНТ-ЭКВИВАЛЕНТ количество тринитротолуола (тротила, ТНТ), имеющее с рассматриваемым явлением какую-то равную количественную характеристику. [c.605]
Нитрованием толуола получают взрывчатое вещество — тринитротолуол тротил, или тол) [c.568]
Нитрованием толуола получают нитротолуол тротил, или тол) [c.476]
Как выше указывалось, некоторые фирмы США, используя разработанные советскими учеными основы химической кинетики и катализа реакций ароматизации, в том числе каталитической дегидрогенизации цикланов и каталитической циклизации алканов и алкенов, реализовали целый ряд технологических процессов в крупном масштабе. Особенно бурное развитие промышленной ароматизации нефтяного сырья было вызвано войной 1940—1945 гг. в связи с необходимостью расширения производства высокооктановых компонентов и толуола как сырья для синтеза тротила. [c.290]
В производстве взрывчатых веществ (нитроглицерина, нитроклетчатки, тротила и др.), органических красителей [c.147]
Характеристика важнейших элементов контроля основывается на регламентах и стандартах, которые объединяют требования технических условий на материалы к основным стадиям операционного кон-трота и методам испытания готовой продукции. [c.275]
Сосуд емкостью 0.5 л выдерживает максимальное давление 500 ата. Какое наименьшее количество тротила может разорвать сосуд, если разложение тротила при взрыве протекает по реакции [c.64]
Ароматические углеводороды широко используются в качестве добавок, повышающих качества карбюраторных топлив. Толуол применяют в производстве тринитротолуола (тротила), являющегося, как известно, одним из важных бризантных взрывчатых веществ. [c.34]
При вскрытии установки оказалось, что 70% труб конденсатора были повреждены. Трубы были раздавлены большим внешним давлением, наиболее сильно вблизи корпуса конденсатора. Примерно половина тарелок в колонне низкого давления была полностью или частично смещена вверх. Характер повреждения указывал на то, что общая взрывная сила была эквивалентна взрыву 906 г тринитротолуола (тротила), или 453 г ацетилена. В ходе обследования-было выяснено, что причиной взрыва на кислородной установке послужила совместная кристаллизация ацетилена и закиси азота на дне конденсатора, продолжавшаяся в течение шести месяцев. Выпавшие кристаллы были равномерна распределены в виде тонкого слоя по всей поверхности нижней трубной решетки конденсатора. В лабораторных условиях было определено, что кристаллы ацетилена и закиси азота одновременно оседают в жидком кислороде, если они содержат менее 50 /о (мол.) ацетилена, а взрыв может наступить при содержании ацетилена более 25%. [c.372]
Один из методов, рассмотренных в отчете, заключается в попытке установить расстояние, на котором достигается определенный уровень разрушения здания в зависимости от заданной массы ВВ. Для достижения максимального взрывного эффекта в качестве источника взрыва принимался стандартный заряд ТНТ (тринитротолуол, тротил). Результаты выражаются в значениях массы ВВ, а не массы всего заряда. [c.531]
В качестве взрывчатых веществ применяют нитроглицерин, аммиачно-селитренный динамит, тротил и другие. Известны исследования по проведению взрыва в самом пласте. Для этого в пласт нагнетают раствор нитроглицерина в спирте, а затем производят взрыв. Выдвигались предложения применять для этой цели атомные взрывы. Известно также применение взрывных торпед направленного действия. [c.129]
Из и и т р о т о, ч у о л о в ннтерес прелстав.тяют орто- и пара-соединения, исиоль-г уемые в качестве исхо,1пых веществ для производства красителей (ср. толуидин). Симметричный тринитротолуол (тротил) является одним из важнейших взрывчатых веществ (применяется для наполнения снарядов и при взрывных работах.). [c.529]
ТРИНИТРОТОЛУОЛ (тротил, ТНТ, тол, 2,4,6-тринитротолуол) ,H5NзO — белые кристаллы (технический продукт-желтого цвета), температура затвердевания 80,85 С, н гигроскопичен, малорастворим в во е, лучше растворяется в органических растворителях. Т.— самое распространенное вторичное взрывчатое вещество, теплота сгорания 3596 ккал/кг, объем газообразных продуктов взрыва 730 л кг. Т. менее чувствителен к удару и трению, чем другие вторичные взрывчатые вещества. Получают Т. нитрованием толуола смесью серной н азотной кислот. Т. применяют для заряжения снарядов, мин, торпед, боевых частей ракет и др., для взрывных работ в промышленности в виде смесей — аммонитов, предохранительных взрывчатых веществ и др. [c.253]
В. С. Гутырей, А. А. Кудиновым, В. П. Крамским и С. Д. Мехтиевым (впоследствии академиком АН АзССР) разработан и реализован на заводе пм. С. М. Буденного метод получения мононитротолуола из природных ароматических углеводородов и бензинов бакинских нефтей. Силами небольшого коллектива, возглавляемого В. С. Гутырей, был организован выпуск тротила, налажено производство водорода для аэростатов заграждения. За работы оборонного характера в апреле 1942 г. В. С. Гутыря был награжден орденом Ленина, в мае 1942 г.— медалью За оборону Кавказа , а позднее — медалями За доблестный труд в Ве.тикой Отечественной войне 1941 —1945 гг. и Тридцать лет Победы в Великой Отечественной войне 1941 —1945 гг. . [c.9]
Аммиачная селитра является взрывчатым веществом с температурой плавления 169,6 °С. Она обладает низкой чувствительностью к инициирующим импульсам и крайне низкой — к детонационяому импульсу к механическим воздействиям она вообще не чувствительна. Например, чтобы вызвать детонацию в расплаве аммиачной селитры, необходим заряд вторичного взрывчатого вещества (ВВ) типа тротила массой десятки и сотни граммов. Давление же на фронте детонации вторичного ВВ составляет примерно 10 ГПа (100 000 кгс/см ). При инициировании детонации осколком скорость последнего должна превышать 1500 м/с. Однако при сочетании ряда факторов возможны детонация и взрыв аммиачной селитры. Например, при нагреве в сосуде без отвода продуктов термического разложения селитра может взорваться. Она может детонировать также от ударов, возникающих при локальных взрывах других систем. Поскольку при производстве, хранении и транспортировке в обращении находятся огромные объемы аммиачной селитры, непринятие соответствующих мер предосторожности может привести к серьезным авариям.
www.chem21.info
Сайт про оружие, оружие всех времен и народов, виды оружия
Тротил (тринитротолуол) получается нитрацией толуола смесью азотной и серной кислот. В плавленом и прессованном видах тротил в мирное время идет на снаряжение большинства снарядов. Для детонации порошкообразного тротила требуется капсюль-детонатор с зарядом 0,8—1,0 г. В плавленом виде тротил не детонирует даже от капсюля с зарядом 3 г. Детонация в этом случае возможна лишь при условии применения промежуточного детонатора из прессованного тротила или тетрила. По взрывчатым свойствам тротил немного уступает пикриновой кислоте, но обладает меньшей чувствительностью к удару и не взаимодействует с металлами.
Малая чувствительность тротила к удару позволяет применять его для снаряжения снарядов к системам с большими начальными скоростями и давлениями.
Тротил представляет собой твердое вещество кристаллического строения с температурой затвердевания в чистом виде 80,8° С. Цвет его (в зависимости от способов выработки) бывает от слабожелтого до желтовато-коричневого. Тротил почти не растворим в воде, но растворяется в спирте, бензоле, толуоле, эфире и ацетоне.
Температура вспышки тротила 295—300° С. Скорость детонации 6700 м/сек.
От луча огня тротил воспламеняется н медленно сгорает сильно коптящим пламенем.
Горение небольшого количества тротила можно потушить водой.
Горение тротила в прочной оболочке, например в снаряде, может перейти во взрыв. Подобное же явление может случиться при быстром нагревании тротила выше 300 С и при сильном ударе молотом по тротилу.
При хранении чистый тротил не подвергается никаким изменениям, но от действия прямого солнечного света темнеет, сохраняя свои первоначальные химические свойства.
Разрывные заряды снарядов, изготовленные из тротила недостаточной очистки, с низкой температурой затвердевания, могут давать течь тротилового масла.
Появление течи нарушает монолитность разрывного заряда, что при стрельбе может привести к преждевременным разрывам снарядов, а скопление тротилового масла в гнезде под содержатель взрывателя — к неполным разрывам.
Похожие записи:
Запись опубликована автором admin в рубрике Порох и взрывчатка. Добавьте в закладки постоянную ссылку.tsdr.ru
Тротил Википедия
Запросы «Тротил» и «TNT» перенаправляются сюда; см. также другие значения терминов Тротил и TNT.| Тринитротолуол | |
|---|---|
 | |
 | |
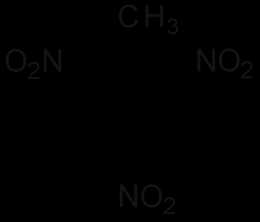
| Систематическое наименование | 2,4,6-тринитрометилбензол |
| Традиционные названия | тротил, тол |
| Хим. формула | C7H5N3O6 |
| Состояние | твёрдое |
| Молярная масса | 227,13 г/моль |
| Плотность | 1,65 ± 0,01 г/см³[1] и 1600 ± 100 кг/м³ |
| Энергия ионизации | 10,59 ± 0,01 эВ[1] |
| Т. плав. | 80,85 °C |
| Т. кип. | 295 °C |
| Давление пара | 0,0002 ± 0,0001 мм рт.ст.[1] |
| Рег. номер CAS | 118-96-7 |
| PubChem | 8376 |
| Рег. номер EINECS | 204-289-6 |
| SMILES | |
| InChI | |
| RTECS | XU0175000 |
| ChEBI | 46053 и 46051 |
| ChemSpider | 8073 |
| Токсичность | Взрывоопасен, токсичен |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
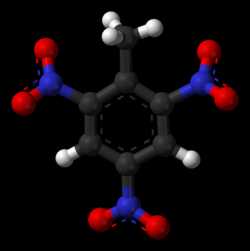
Тринитротолуо́л (2,4,6-тринитротолуол, 2,4,6-тринитрометилбензол, тротил,тол, TNT) — одно из наиболее распространённых бризантных взрывчатых веществ. Представляет собой желтоватое кристаллическое вещество с температурой плавления 80,85 °C (плавится в очень горячей воде).
Физические свойства
История
Тринитротолуол был получен в 1863 году немецким химиком Юлиусом Вильбрандом. В 1891 году в Германии началось промышленное производство тротила. С 1902 года в германской и американской армиях начали использовать боеприпасы, снаряжённые тротилом вместо пикриновой кислоты. В России промышленное производство тротила началось в 1909 году на Охтинском заводе по немецкой технологии.
Тротил стал основным взрывчатым веществом для снаряжения боеприпасов благодаря удачному сочетанию достаточной мощности с низкой чувствительностью, возможностью переработки литьем. Его массовое производство стало возможным в результате развития нефтехимической промышленности[3].
Получение
Первый этап: нитрование толуола смесью азотной и серной кислот до моно- и динитротолуолов. Серная кислота используется как водоотнимающий агент.
- 2C6H5Ch4→HNO3,h3SO4C6h5Ch4(NO2)+C6h4Ch4(NO2)2{\displaystyle {\mathsf {2C_{6}H_{5}CH_{3}{\xrightarrow[{}]{HNO_{3},H_{2}SO_{4}}}C_{6}H_{4}CH_{3}(NO_{2})+C_{6}H_{3}CH_{3}(NO_{2})_{2}}}}
Второй этап: смесь моно- и динитротолуола нитруют в смеси азотной кислоты и олеума. Олеум используется как водоотнимающий агент.
- C6h5Ch4(NO2)+C6h4Ch4(NO2)2→HNO3,h3SO4C6h3Ch4(NO2)3{\displaystyle {\mathsf {C_{6}H_{4}CH_{3}(NO_{2})+C_{6}H_{3}CH_{3}(NO_{2})_{2}{\xrightarrow[{}]{HNO_{3},H_{2}SO_{4}}}C_{6}H_{2}CH_{3}(NO_{2})_{3}}}}
Излишек кислоты от второго этапа можно использовать для первого.
Применение
Применяется в промышленности и военном деле как самостоятельно в гранулированном (гранулотол), прессованном или литом виде, так и в составе многих взрывчатых смесей (алюмотол, аммонал, аммонит, аммотол и другие).
Тротил менее чувствителен к трению и нагреванию, чем многие другие взрывчатые вещества, например динамит, и загорается только при температуре 290 °C, поэтому может быть относительно безопасно нагрет до температуры плавления. Это очень удобно, так как позволяет легко придать нужную форму при помощи литья. Литой или прессованный тротил можно поджечь. Он горит без взрыва желтоватым пламенем. Для взрыва обычно необходимо использование детонатора, однако порошкообразный тротил с примесями может иметь повышенную чувствительность к внешним воздействиям, в том числе и к пламени.
Несмотря на широкую распространённость тринитротолуола, в настоящее время его стараются заменить на более экономичные и более безопасные малочувствительные взрывчатые вещества. Например, Вооружённые силы США, начиная с 2010 года, заменяют тротил в крупнокалиберных снарядах на вещество IMX-101.
Обладает свойствами антимикотика, ранее применялся в медицине в составе противогрибковых препаратов «Ликватол» и «Унгветол». В 90-е годы профессором В. Ф. Можаровским были проведены исследования влияния тротила на грибки, вирусы и микроорганизмы, которые выявили его крайнюю эффективность при лечении разных заболеваний. Были созданы и запатентованы препараты «Тринол», «Ликвацид», «Тротицид»[4].
См. также
Примечания
Литература
- Поздняков З. Г., Росси Б. Д. Справочник по промышленным взрывчатым веществам и средствам взрывания. — М.: Недра, 1977.
- Орлова Е. Ю. Химия и технология бризантных взрывчатых веществ. Учебник для вузов. — Изд. 3-е, перераб. — Л.: Химия, ленинградское отделение, 1981. — 312 с.
- Бирюков М. Всех взрывчаток командир (рус.) // Оружие : журнал. — 2016. — № 05. — С. 50—53. — ISSN 1728-9203.
wikiredia.ru
