3.1. Строение, свойства атома и ядра
Лекция 3. ФИЗИЧЕСКАЯ ПРИРОДА ИОНИЗИРУЮЩИХ ИЗЛУЧЕНИЙ
3.1. Строение, свойства атома и ядра. 3.2. Энергия связи атомных ядер.
3.3.Радиоактивность. Закон радиоактивного распада.
3.4.Активность и единицы ее измерения.
3.5.Деление тяжелых ядер и цепная реакция деления.
Ионизирующее излучение – излучение, которое образуется при радиоактивном распаде, ядерных превращениях, торможении заряженных частиц в веществе и образует при взаимодействии со средой ионы разных знаков. Ионизирующее излучение не воспринимается органами чувств: мы его не видим и не слышим, не ощущаем воздействия на наши тела. Ионизирующие излучения разделяют на электромагнитное и корпускулярное.
Кэлектромагнитным (фотонным) относят рентгеновское и гамма-излучения, которые представляют собой поток электромагнитной энергии с разной (преимущественно короткой) длиной волны. Солнце является природным источником ультрафиолетового и рентгеновского излучения. Рентгеновское излучение поглощается земной атмосферой; если бы этого не происходило, то оно губительно действовало бы на все живое на Земле.
Корпускулярное ионизирующее излучение – поток элементар-
ных частиц, образующихся при радиоактивном распаде, ядерных превращениях, либо генерируемых на ускорителях. К нему относятся: бе- та-частицы (электроны и позитроны), нейтроны, протоны и альфачастицы (ядра атома гелия).
Кионизирующим относятся также космические излучения, которые приходят на Землю из космического пространства.
Воздействие ионизирующих излучений на вещества называется
облучением.
Чтобы понять, каким образом при ядерных реакциях освобождается колоссальное количество энергии, заключенной в ядрах атомов, необходимо знать строение атома и его ядра.
38
Атом – это наименьшая частица химического элемента. Он состоит из положительно заряженного ядра, вокруг которого вращаются отрицательно заряженные частицы – электроны, составляющие электронную оболочку атома (рис. 1).
|
| 1 | |
|
| 2 | |
1 | |||
| 3 | ||
2 |
| ||
|
| ||
|
| ||
|
|
| |
|
|
| |
3 |
|
| |
4 |
|
| |
|
|
Рис. 1. Строение атома: | Рис. 2. Схема атомных |
1 – протон; 2 – нейтрон; | электронных оболочек: |
3 – электрон; 4 – орбиты | 1 – ядро; 2 – электроны; |
| 3 – электронные оболочки |
Электрон – это элементарная частица с массой покоя, равной
0,000548 а. е. м. (1 а. е. м. = 1,66 10–27 кг).
Заряд электрона е = 1,602 10–19 Кл.
Электроны в атомах могут двигаться без потери энергии только по определенным орбитам (рис. 2). Количество орбит, по которым вращаются электроны, может быть произвольно, но они группируются в электронные слои. Слоев может быть семь: K, L, М, N, O, P, Q.
Каждый слой содержит строго определенное число электронов. Чем он ближе к ядру, тем выше энергия связи с ядром, и наоборот. Поэтому электроны с орбит внешних электронных слоев сорвать значительно легче, чем с орбит внутренних электронных слоев. Переход электрона с ближайшей к ядру орбиты на более удаленную происходит с поглощением порции (кванта) энергии. При возвращении электрона на ближайшую орбиту происходит выделение такого же количества энергии.
Ядро при аналогичных переходах излучает гамма-кванты. Как и для всякой системы, наибольшая энергетическая устойчивость атома соответствует его наименьшей энергии. Состояние атома с наименьшей энергией называется нормальным, или основным, ему соответствует нахождение электрона на ближайшей к ядру, нормальной орбите.
В нормальном, т. е. устойчивом, состоянии атом не выделяет и не поглощает энергии. При воздействии на атом, например рентгеновскими
39
лучами, происходит возбуждение атома, т. е. один из электронов переходит на какую-либо из внешних орбит, в результате чего энергия атома увеличивается.
Возбужденный атом неустойчив, поэтому он через очень короткий промежуток времени (миллионные доли секунды) вновь возвращается в устойчивое состояние, при этом восстанавливается первоначальная структура электронной оболочки.
При переходе атома в энергетически более устойчивое состояние освобождается энергия в виде фотона – элементарной частицы, электромагнитного излучения (видимого света, ультрафиолетового или рентгеновского излучения).
Обычно атом электрически нейтрален, т. к. суммарный отрицательный заряд всех электронов по абсолютной величине равен заряду ядра. Если увеличить энергию, передаваемую электрону, то он может оторваться от атома, в результате чего атом превращается в положительно заряженный ион. Этот процесс называется ионизацией. На ионизацию атома затрачивается энергия, равная энергии связи электрона в атоме. Обратный процесс, т. е. захват положительно заряженным ионом свободного электрона, называется рекомбинацией: при этом выделяется энергия, равная энергии связи электрона с ядром.
Ядро – центральная часть атома, в которой сосредоточена практически вся масса атома и его положительный электрический заряд.
Ядро состоит из протонов – положительно заряженных частиц (р) и нейтронов (n), частиц, не имеющих заряда. Обе частицы, протоны и нейтроны, носят общее название – нуклоны. Диаметр ядра составляет
примерно 10–15 м. Плотность вещества в ядре 2 1014 г/см3, т. е. 1 см3 ядерного вещества имеет массу 108 т.
Протон (от греч. protos – первый) – это элементарная частица, она имеет положительный заряд, равный по абсолютной величине заряду
электрона е = 1,602 10–19 Кл, и массу покоя mp = 1,6726 10–27 кг = = 1836 mе. Зарядом протонов объясняется положительный заряд ядра в целом.
Нейтрон – нейтральная элементарная частица, которая не имеет электрического заряда, он чуть тяжелее протона и имеет массу покоя
mn = 1,6748 10–27 кг = 1839 mе. Поэтому, хотя ядро в десятки тысяч раз меньше атома, в нем сосредоточена почти вся масса атома.
Масса ядра определяется суммарным количеством нуклонов (протонов и нейтронов), а заряд ядра равен сумме зарядов входящих в его состав протонов. Число, равное общему количеству нуклонов и характеризующее массу ядра, называется массовым числом (А), которое
40
численно равно общему числу протонов (Z) и нейтронов (N), входящих в состав ядра: А = Z + N. Заряд же ядра, выраженный в элементарных единицах, численно равен порядковому номеру элемента в периодической таблице Д. И. Менделеева и называется зарядовым числом ядра. Поскольку Z выражает число протонов, а А – число нуклонов в ядре, то число нейтронов в атомном ядре N = А – Z.
Для химических элементов принято следующее обозначение ZA Х: слева вверху у символа химического элемента пишется массовое число, а внизу – зарядовое число. Например, изотоп плутония 23994 Pu
означает, что массовое число А = 239, зарядовое число Z = 94, число нейтронов N = А – Z.
В ядре атома каждого химического элемента находится строго определенное количество протонов. Например, в ядре атома водорода содержится 1 протон, в ядре атома He – 2 протона, Li – 3 протона и т. д. Число же нейтронов в ядрах атомов одного и того же химического элемента может быть различным.
Атомы одного и того же элемента с одинаковым числом протонов, но с различным числом нейтронов в ядре называются изотопами. Электронные оболочки изотопов одного и того же химического элемента одинаковые. Поэтому изотопы имеют одинаковые химические свойства и располагаются в одной клетке периодической таблицы Менделеева.
Большинство химических элементов состоит из нескольких изотопов. Так, наряду с обычным водородом существует тяжелый водород (дейтерий), ядро которого содержит один протон и нейтрон, а также сверхтяжелый водород (тритий), ядро которого содержит протон и два нейтрона (рис. 3).
Протон | Нейтрон | Электрон |
а | б | в |
Рис. 3. Схема строения атомов изотопов водорода: а – водород; б – дейтерий; в – тритий
41
studfiles.net
Модель ядерных оболочек. Одночастичные состоянияВ модели ядерных оболочек нуклоны рассматриваются как независимые частицы в самосогласованном потенциале, создаваемом всей совокупностью нуклонов в ядре. Уровни энергии нуклонов Ei определяются собственными значениями решений уравнения Шредингера
где
ψi
– волновая функция нуклона с энергией Ei,
Ĥ –
оператор гамильтона,
и
– операторы кинетической и
потенциальной энергии.
где
μ – приведенная масса нуклона,
ω
– осцилляторная частота (ħω
≈ 41A-1/3),
где N = 2n + l – осцилляторное главное квантовое
число, n – радиальное квантовое число (число узлов функции, кроме
нуля), l – орбитальное квантовое число.
где V0 – глубина потенциала, R = r0A1/3 – радиус ядра и a – параметр, характеризующий диффузность (размытие) края потенциала.
Потенциал Вудса-Саксона представляет нечто
среднее между осцилляторным потенциалом и потенциалом прямоугольной ямы. В
потенциале Вудса-Саксона снимаются вырождения, свойственные гармоническому
осциллятору. Однако реалистический потенциал (5), также как и осцилляторный
потенциал, не в состоянии объяснить наблюдаемые в эксперименте
магические числа нуклонов.
Спин-орбитальное взаимодействие приводит к расщеплению уровня с данным значением l на два состояния l + 1/2 и l — 1/2. При этом состояние с l + 1/2 смещается вниз по энергии, а
состояние с l — 1/2 — вверх. Величина спин-орбитального расщепления уровней
пропорциональна величине орбитального момента l. Поэто уровни с большими
значениями орбитального момента l > 3 сильно смещаясь вниз по энергии
оказываются среди уровней предыдущей оболочки, что позволяет правильно
воспроизвести магические числа.
Cостояния нуклонов характеризуются квантовыми
числами, которые определяют физические величины, сохраняющиеся при движении в
сферически-симметричном поле (см. рис. 2). Обозначения состояний — 1d5/2
означает, что радиальное квантовое число n = 1, орбитальный момент l = 2
(d-состояние), полный момент j = l + s = 5/2.
где li – орбитальный момент i-го нуклона.
На рис. 3 показаны результаты расчетов
нейтронных одночастичных состояний с потенциалом Вудса-Саксона, с небольшой
зависимостью его глубины от нейтронного избытка. Радиус ядерного потенциала
пропорционален A1/3. Это приводит к тому, что с ростом A уменьшается
расстояние между одночастичными состояниями. Кроме увеличения плотности
одночастичных состояний с ростом A, видно, что меняется последовательность
состояний.
Основные положения одночастичной оболочечной модели
Наилучшие предсказания оболочечная модель дает
для ядер вблизи заполненных оболочек, для которых самосогласованный
потенциал сферически-симметричный. Простейший вариант оболочечной
модели – одночастичная оболочечная модель.
где x1, x2 и x3 —
координаты нуклона во внутренней системе координат.
ЗАДАЧИ
Модель оболочек |
nuclphys.sinp.msu.ru
Размеры ядра
Лептоны
Открытая в 1937 году частица тоже была названа мезоном, μ-мезоном. Он имеет массу ~106 МэВ и существует в двух разновидностях — отрицательно заряженная частица и положительно заряженная античастица. Сегодня μ-мезон предпочитают называть мюоном. Мюоны — нестабильные частицы и распадаются по схеме
μ−→ e− + e + νμ, μ+→ e+ + νe + μ ,
с образованием в конечном состоянии электрона (позитрона), электронного антинейтрино e (нейтрино νe) и мюонного нейтрино νμ (антинейтрино μ ). На то, что электронные и мюонные нейтрино разные частицы, впервые было указано в 1957 году М. Марковым и Ю. Швингером. Эта гипотеза была подтверждена в 1962 году в экспериментах на ускорителе в Брукхейвене. Было показано, что при взаимодействии мюонных нейтрино рождаются мюоны
νμ + n → p + μ—
и не рождаются электроны
νμ + n p + е−.
Мюоны, электроны и нейтрино относятся к семейству лептонов. Еще одна частица
этого семейства -лептон
(таон) была открыта
М. Перлом
в 1979 году в реакции e+ + e−
τ+
+
τ−. Она почти в два раза тяжелее
протона и может распадаться не только подобно мюону на лептоны, но и на адроны.
Таким образом, семейство лептонов состоит из трех
отрицательно заряженных частиц (e−, μ−,
τ−) и соответствующих им трех типов нейтрино (νe,
νμ,
ντ). Лептоны e−,
μ−,
τ− и их античастицы e+,
μ+, τ+ участвуют в
электромагнитных и слабых взаимодействиях, лептоны
νe,
νμ,
ντ и их античастицы e, μ, τ — только
в слабых.
Принципиальное значение имеет вопрос о массе нейтрино. Масса
каждого типа нейтрино много меньше массы соответствующего заряженного лептона.
Современные экспериментальные оценки масс нейтрино следующие
m(νe) < 2 эВ, m(νμ) < 0.17 МэВ, m(ντ) < 15.5 МэВ.
Существует космологическое ограничение на суммарную массу всех типов нейтрино
m(νe) + m(νμ) + m(ντ) < 0.28 эВ.
Если нейтрино имеет массу, то возможны распады и осцилляции нейтрино, смешивание нейтрино различных типов. Гипотеза об осцилляции нейтрино была выдвинута в 1957 году Б. Понтекорво. В настоящее время интенсивно проводятся эксперименты по измерению массы покоя нейтрино и определению параметров осцилляций нейтрино.
17.01.2017
nuclphys.sinp.msu.ru
Атомное ядро
Состав и характеристика атомного ядра.
Ядро простейшего атома — атома водорода — состоит из одной элементарной частицы, называемой протоном. Ядра всех остальных атомов состоят из двух видов элементарных частиц — протонов и нейтронов. Эти частицы носят название нуклонов.
Протон. Протоно (p) обладает зарядом +eи массой
mp= 938,28 МэВ
Для сравнения укажем, что масса электрона равна
me= 0,511 МэВ
Из сопоставления и следует, что mp= 1836me
Протон имеет спин, равный половине (s= 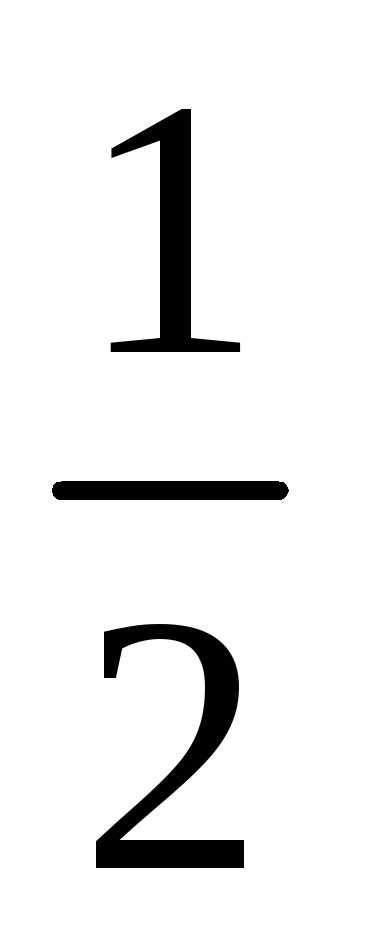 ),
и собственный магнитный момент
),
и собственный магнитный момент
где
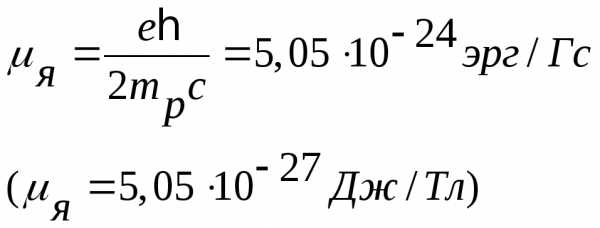
— единица магнитного момента, называемая ядерным магнетоном. Из сравнения масс протона и электрона вытекает, что μяв 1836 раз меньше магнетона Бора μб. Следовательно, собственный магнитный момент протона примерно в 660 раз меньше, чем магнитный момент электрона.
Нейтрон. Нейтрон (n) был открыт в 1932 г. английским физиком
Д. Чедвиком. Электрический заряд этой частицы равен нулю, а масса
mn = 939,57МэВ
очень близка к массе протона. Разность масс нейтрона и протона (mn–mp)
составляет 1,3 МэВ, т.е. 2,5 me.
Нейтрон обладает спином, равным половине
(s= 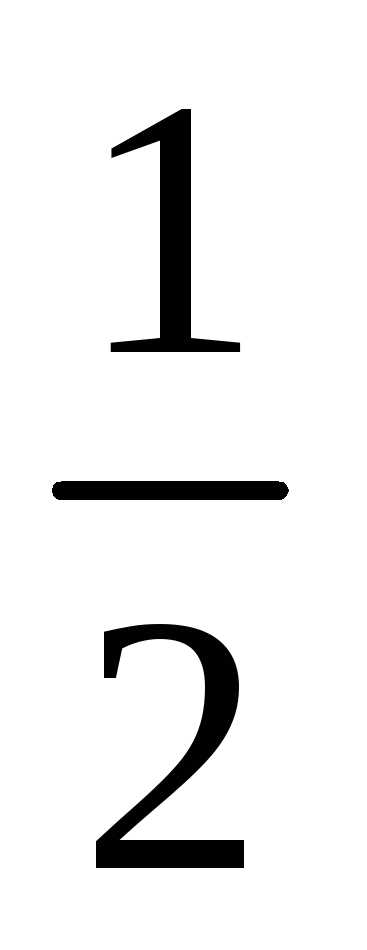 )
и (несмотря на отсутствие электрического
заряда) собственным магнитным моментом
)
и (несмотря на отсутствие электрического
заряда) собственным магнитным моментом
μn = — 1,91μя
(знак минус указывает на то, что направления собственных механического и магнитного моментов противоположны). Объяснение этого удивительного факта будет дано позже.
Отметим, что отношение экспериментальных значений μpи μnс большой степенью точности равно — 3/2 . Это было замечено лишь после того, как такое значение было получено теоретически.
В свободном состоянии нейтрон нестабилен
(радиоактивен) – он самопроизвольно
распадается, превращаясь в протон и
испуская электрон (e—)
и еще одну частицу, называемую антинейтрино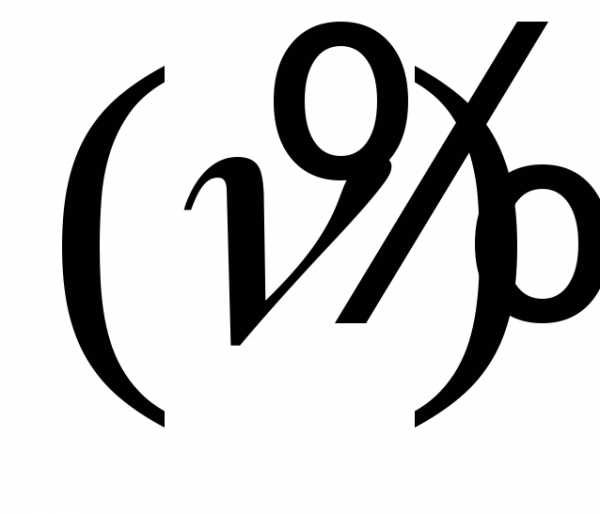 .
Период полураспада (т.е. время, за которое
распадается половина первоначального
количества нейтронов) равен примерно
12 мин. Схему распада можно написать
следующим образом:
.
Период полураспада (т.е. время, за которое
распадается половина первоначального
количества нейтронов) равен примерно
12 мин. Схему распада можно написать
следующим образом:
Масса покоя антинейтрино равна нулю. Масса нейтрона больше массы протона на 2,5me. Следовательно, масса нейтрона превышает суммарную массу частиц, фигурирующих в правой части уравнения на 1,5me, т.е. на 0,77 МэВ. Эта энергия выделяется при распаде нейтрона в виде кинетической энергии образующихся частиц.
Характеристики атомного ядра. Одной из важнейших характеристик атомного ядра является зарядовое числоZ. Оно равно количеству протонов, входящих в состав ядра, и определяет его заряд, который равен +Ze. ЧислоZопределяет порядковый номер химического элемента в периодической таблице Менделеева. Поэтому его также называют атомным номером ядра.
Число нуклонов (т.е. суммарное число протонов и нейтронов) в ядре обозначается буквой А и называется массовым числом ядра. Число нейтронов в ядре равно N=A–Z.
Для обозначения ядер применяется символ
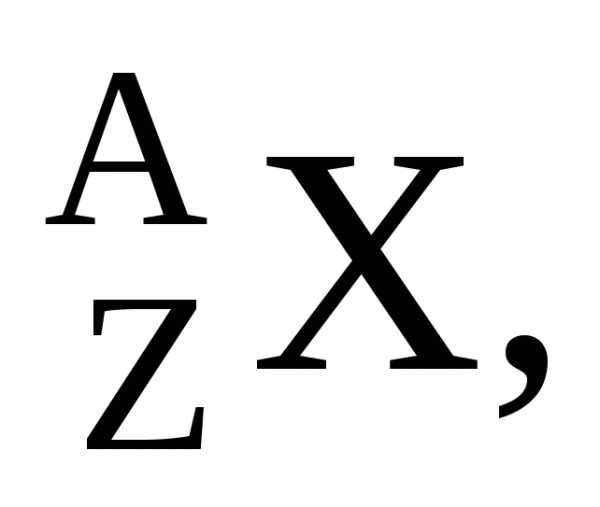
где под Xподразумевается химический символ
данного элемента. Слева вверху ставится
массовое число, слева внизу – атомный
номер (последний значок часто опускают).
Иногда массовое число пишут не слева,
а справа от символа химического элемента 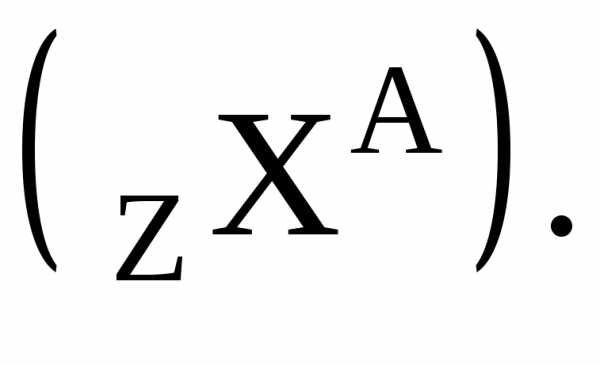
Ядра с одинаковым Z, но разными А называютсяизотопами. Большинство химических элементов имеет по несколько стабильных изотопов. Так, например, у кислорода имеется три стабильных изотопа:
, у олова — десять, и т.д.
Водород имеет три изотопа:
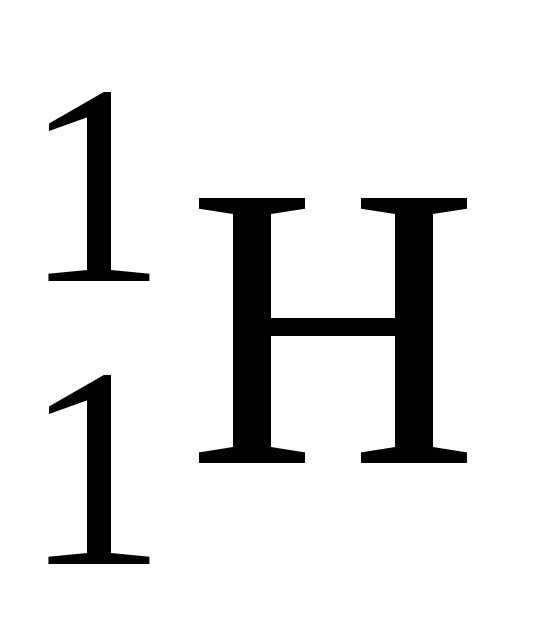 – обычный водород, или протий (Z=1,
N=0),
– обычный водород, или протий (Z=1,
N=0),
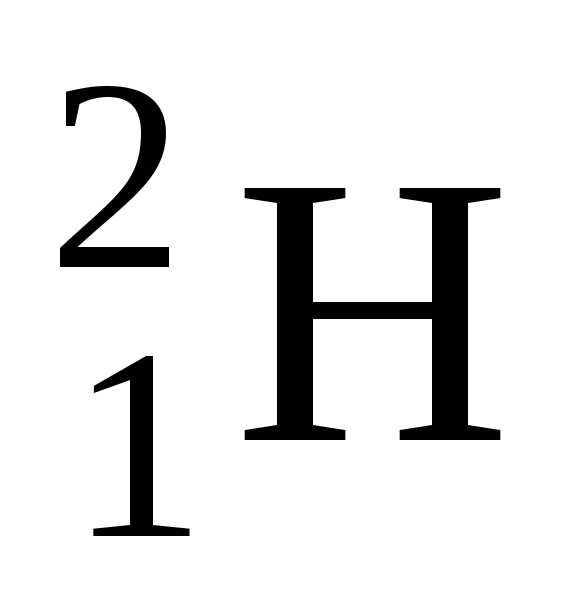 – тяжелый водород, или дейтерий
(Z=1, N=1),
– тяжелый водород, или дейтерий
(Z=1, N=1),
 – тритий (Z=1,
N=2).
– тритий (Z=1,
N=2).
Протий и дейтерий стабильны, тритий радиоактивен.
Ядра с
одинаковым массовым числом А называются изобарами.
В качестве примера
можно привести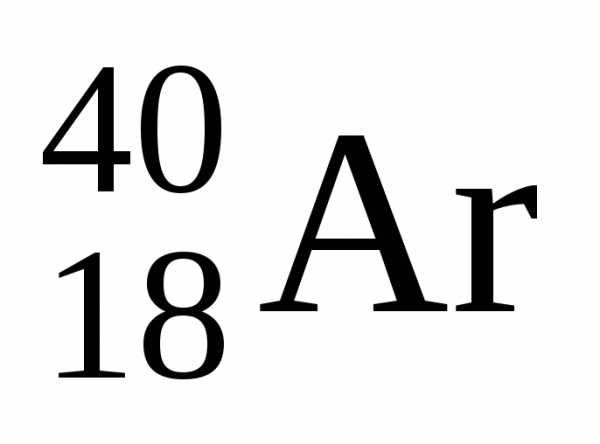 и
и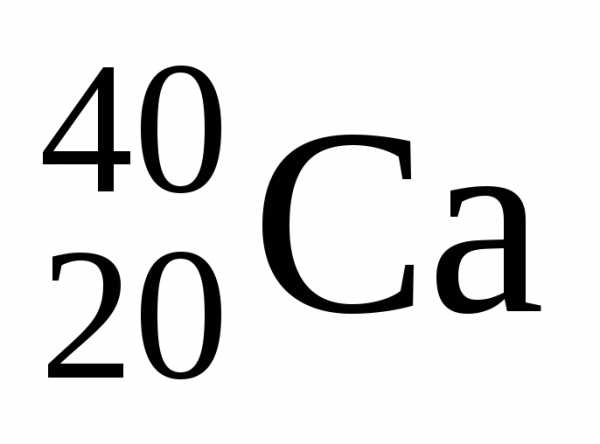 .
Ядра с одинако-
вым числом нейтроновN
= A – Z носят названиеизотонов (
.
Ядра с одинако-
вым числом нейтроновN
= A – Z носят названиеизотонов ( ,
, ).Наконец,
существуют радиоактивные ядра с
одинаковымиZ и
A,
отличающиеся периодом полураспада.
Они называютсяизомерами. Напри-
мер,
имеются два изомера ядра
).Наконец,
существуют радиоактивные ядра с
одинаковымиZ и
A,
отличающиеся периодом полураспада.
Они называютсяизомерами. Напри-
мер,
имеются два изомера ядра ,
у одного из них период полу-распада
равен 18 мин, у другого – 4,4
часа.
,
у одного из них период полу-распада
равен 18 мин, у другого – 4,4
часа.
Известно около 1500 ядер, различающихся либо Z, либо А, либо и тем и другим. Примерно 1/5 часть этих ядер устойчивы, остальные радиоактивны. Многие ядра были получены искусственным путем с помощью ядерных реакций.
В природе встречаются элементы с атомным номером Z от1до 92, исключая технеций (Tc, Z = 43) и прометий (Pm, Z = 61). Плутоний (Pu, Z = 94) после получения его искусственным путем был обнаружен в ничтожных количествах в природном минерале – смоляной обманке. Остальные трансурановые (т.е. заурановые) элементы (сZ от 93 до 107) были получены искусственным путем посредством различных ядерных реакций.
Трансурановые элементы кюрий (96 Cm), эйнштейний (99 Es),фермий (100 Fm) и менделевий (101 Md) получили название в честь выдающихся ученыхII. и М. Кюри, А. Эйнштейна, З. Ферми и Д.И. Менделеева. Лоуренсий (103 Lw) назван в честь изобретателя циклотрона Э. Лоуренса. Курчатовий (104 Ku) получил свое название в честь выдающегося физика И.В. Курчатова.
Некоторые трансурановые элементы, в том числе курчатовий и элементы с номерами 106 и 107, были получены в Лаборатории ядерных реакций Объединенного института ядерных исследований в Дубне ученым
Н.Н. Флеровым и его сотрудниками.
Размеры ядер. В первом приближении ядро можно считать шаром, радиус которого довольно точно определяется формулой
(ферми – название применяемой в ядерной физике единицы длины, равной
10-13см). Из формулы следует, что объем ядра пропорционален числу нуклонов в ядре. Таким образом, плотность вещества во всех ядрах примерно одинакова.
Спин ядра. Спины нуклонов складываются в результирующий спин ядра. Спин нуклона равен 1/2. Поэтому квантовое число спина ядра будет полуцелым при нечетном числе нуклонов А и целым или нулем при четном А. Спины ядерJне превышают нескольких единиц. Это указывает на то, что спины большинства нуклонов в ядре взаимно компенсируют друг друга, располагаясь антипараллельно. У всех четно-четных ядер (т.е. ядро с четным числом протонов и четным числом нейтронов) спин равен нулю.
Механический момент ядра MJскладывается с моментом электронной
оболочки  в полный момент импульса атомаMF,
который определяется квантовым числом
F.
в полный момент импульса атомаMF,
который определяется квантовым числом
F.
Взаимодействие магнитных моментов
электронов и ядра приводит к тому, что
состояния атома, соответствующие
различным взаимным ориентациям MJ и  (т.е. различнымF), имеют
немного отличающуюся энергию.
Взаимодействием моментов μL иμSобусловливается тонкая структура
спектров. ВзаимодействиемμJ и
(т.е. различнымF), имеют
немного отличающуюся энергию.
Взаимодействием моментов μL иμSобусловливается тонкая структура
спектров. ВзаимодействиемμJ и  определяется сверхтонкая структура
атомных спектров. Расщепление
спектральных линий, соответствующее
сверхтонкой структуре, настолько мало
(порядка нескольких сотых ангстрема),
что может наблюдаться лишь с помощью
приборов самой высокой разрешающей
силы.
определяется сверхтонкая структура
атомных спектров. Расщепление
спектральных линий, соответствующее
сверхтонкой структуре, настолько мало
(порядка нескольких сотых ангстрема),
что может наблюдаться лишь с помощью
приборов самой высокой разрешающей
силы.
studfiles.net
Д.Е. ЛанскойАдроны и ядра
|
nuclphys.sinp.msu.ru
При энергии ионов криптона вблизи кулоновского барьера
наблюдалось три случая образования 118 элемента [V. Nilov et al Phys Rev Lett
83, 1104 (1999)]. Ядра 293118 имплантировались в кремниевый детектор и
наблюдалась цепочка шести последовательных α-распадов, которая заканчивалась на
изотопе 269Sg. Сечение образования 118 элемента составляло ~2
пикобарна. Период полураспада изотопа 293118 равен 120 мс. На рис. 3
показана цепочка последовательных α-распадов изотопа 293118 и
приведены периоды полураспада дочерних ядер, образующихся в результате
α-распадов.
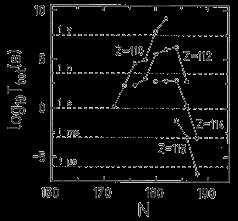
На основе различных теоретических моделей были рассчитаны распадные характеристики сверхтяжелых ядер. Результаты одного из таких расчетов показаны на рис. 4. Приведены периоды полураспада четно-четных сверхтяжелых ядер относительно спонтанного деления (а), α-распада (б), β-распада (в) и для всех возможных процессов распада (г). Наиболее устойчивым ядром по отношению к спонтанному делению (рис. 4а) является ядро с Z = 114 и N = 184. Для него период полураспада по отношению к спонтанному делению ~1016 лет. Для изотопов 114-го элемента, отличающихся от наиболее устойчивого на 6-8 нейтронов, периоды полураспада уменьшаются на 10-15 порядков. Периоды полураспада по отношению к α-распаду приведены на рис. 4б. Наиболее устойчивое ядро расположено в области Z < 114 и N = 184 (T1/2 = 1015 лет). Для изотопа 298114 период полураспада составляет около 10 лет.
Стабильные по отношению к β-распаду ядра показаны на рис. 4в темными точками. На рис. 4г приведены полные периоды полураспада. Для четно-четных ядер, расположенных внутри центрального контура, составляют ~105 лет. Таким образом, после учета всех типов распада оказывается, что ядра в окрестности Z = 110 и N = 184 образуют «остров стабильности». Ядро 294110 имеет период полураспада около 109 лет. Отличие величины Z от предсказываемого оболочечной моделью магического числа 114 связано с конкуренцией между делением (относительно которого ядро с Z = 114 наиболее стабильно) и α-распадом (относительно которого устойчивы ядра с меньшими Z). У нечетно-четных и четно-нечетных ядер периоды полураспада по отношению к α-распаду и спонтанному делению увеличиваются, а по отношению к β-распаду уменьшаются. Следует отметить, что приведенные оценки сильно зависят от параметров, использованных в расчетах, и могут рассматриваться лишь как указания на возможность существования сверхтяжелых ядер, имеющих времена жизни достаточно большие для их экспериментального обнаружения.
Результаты еще одного расчета равновесной формы сверхтяжелых ядер и их периодов полураспада показаны на рис. 5, 11.11 [R. Smolan’czuk Phys. Rev C56, 1997, p.812]. На рис. 11.10 показана зависимость энергии равновесной деформации от количества нейтронов и протонов для ядер с Z = 104-120. Энергия деформации определяется как разность энергий ядер в равновесной и сферической форме. Из этих данных видно, что в области Z = 114 и N = 184 должны располагаться ядра, имеющие в основном состоянии сферическую форму. Все обнаруженные на сегодня сверхтяжелые ядра (они показаны на рис. 5 темными ромбами) деформированы. Светлыми ромбами показаны ядра стабильные по отношению к β-распаду. Эти ядра должны распадаться в результате α-распада или деления. Основным каналом распада должен быть α-распад.
Периоды полураспада для четно-четных β-стабильных изотопов
показаны на рис. 6. Согласно этим предсказаниям для большинства ядер ожидаются
периоды полураспада гораздо большие, чем наблюдались для уже обнаруженных
сверхтяжелых ядер (0.1-1 мс). Так например, для ядра 292110
предсказывается время жизни ~ 51 год.
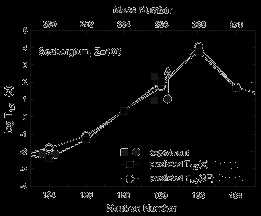
На рис. 7 показано измеренное время жизни изотопов сиборгия Sg (Z = 106)
в сравнении с предсказаниями различных теоретических моделей [Z. Patyk et al.
Nucl. Phys. A533, 1991, p.132; R. Smolanczuk et al. Phys. Rev. C52, 1995,
p.1871]. Обращает на себя внимание уменьшение почти на порядок времени жизни
изотопа с N = 164 по сравнению с временем жизни изотопа с N = 162.
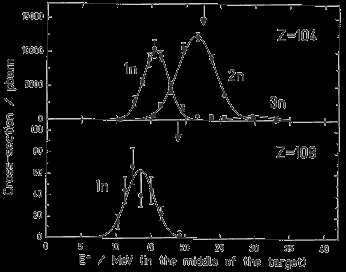
На рис. 8 показаны экспериментально измеренные функции
возбуждения реакции образования элементов Rf (Z = 104) и Hs (Z = 108)для реакций
слияния налетающих ионов 50Ti и 56Fe с ядром-мишенью
208Pb.
Реакции слияния с испусканием минимального числа нейтронов
(1-2) представляют особый интерес, т.к. в синтезируемых сверхтяжелых ядрах
желательно иметь максимально большое отношение N/Z. На рис. 9 показан потенциал
слияния для ядер в реакции Идентификация ядра 289114 проводилась по
цепочке α-распадов. Экспериментальная оценка периода полураспада изотопа
289114 ~30 с. Полученный результат находится в хорошем согласии с ранее
выполненными расчетами [Cherepanov E.A. Sub to Proc. Int VI Int. Conf on
Dynamical Aspects on Nuclear Fission. Slovac Respublic. 1998].
Ядро 296116 охлаждается испусканием четырех нейтронов и превращается в изотоп 292116, который далее с 5% -ой вероятностью в результате двух последовательных e-захватов превращается в изотоп 292114. В результате α-распада (T1/2 = 85 дней) изотоп 292114 превращается в изотоп 288112. Образование изотопа 288112 происходит и по каналу . Конечное ядро 288112, образующееся в результате
обеих цепочек, имеет период полураспада около 1 часа и распадается в результате
спонтанного деления. Примерно с 10%-ой вероятностью в результате α-распада
изотопа 288114 может образовываться изотоп 284112.
Приведенные выше периоды и каналы распада получены расчетным путем.
Весьма перспективным методом получения сверхтяжелых ядер являются реакции типа 238U + 238U, 238U + 248Cm, 238U + 249Cf, 238U + 254Es. На рис. 11 приведены оценочные сечения образования трансурановых элементов при облучении ускоренными ионами 238U мишеней из 248Cm, 249Cf и 254Es. В этих реакциях уже получены первые результаты по сечениям образования элементов с Z > 100. Для увеличения выходов исследуемых реакций толщины мишеней выбирались таким образом, чтобы продукты реакции оставались в мишени. После облучения из мишени сепарировались отдельные химические элементы. В полученных образцах в течение нескольких месяцев регистрировались продукты α-распада и осколки деления. Данные, полученные с помощью ускоренных ионов урана, ясно указывают на увеличение выхода тяжелых трансурановых элементов по сравнениюю с более легкими бомбардирующими ионами. Этот факт чрезвычайно важен для решения проблемы синтеза сверхтяжелых ядер. Несмотря на трудности работы с соответствующими мишенями прогнозы продвижения к большим Z выглядят довольно оптимистично.
Продвижение в область сверхтяжелых ядер в последние годы оказалось ошеломляюще впечатляющим. Однако, пока все попытки обнаружить остров стабильности не увенчались успехом. Поиск его интенсивно продолжается. См. также Ядерные реакции с тяжелыми ионами и синтез новых ядер |
nuclphys.sinp.msu.ru
Тяжелые ядра (Z < 100) Наиболее тяжелыми стабильными ядрами являются изотопы
свинца (Z = 82) и висмут (Z = 83). Химические элементы с Z > 83 нестабильны и
распадаются в результате α-, β-распадов или спонтанного деления. Таблица 1. Долгоживущие тяжелые изотопы урана и тория
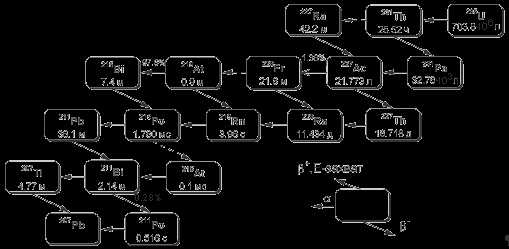
Выделенность изотопов Th и U обусловлена их большим периодом полураспада, сравнимым со временем существования Земли. Для обозначения таких ядер существует специальный термин — Primordial Nuclide. Так как, с одной стороны, времена жизни таких ядер велики по сравнению с земными масштабами времен, а, с другой стороны, эти ядра все же нестабильны, они являются источником существования целой группы ядер, расположенных между ураном и свинцом. Так например, изотоп 235U является родоначальником одного из четырех радиоактивных семейств (рис. 1).
Последовательные превращения элементов в этих семействах происходят либо путем α-распада, либо β -распада. Следовательно, для каждого радиоактивного семейства массовое число при последовательном распаде либо не меняется, либо меняется на четыре единицы. Из рисунка видно, что большое количество ядер с массовыми числами A = 209-234, обнаруженное в настоящее время на Земле и имеющее времена жизни значительно меньшие, чем время существования Земли, обязаны своим происхождением изотопу 235U. Аналогичная ситуация имеет место и для других радиоактивных семейств. Изотопы с Z >92Химические элементы с Z > 92 были получены искусственным путем. Химические элементы Z = 93,94 были получены в результате облучения 238U нейтронами. В результате β—-распада изотопа 239U (Z = 93) образуется изотоп нептуния 239Np, который затем, распадаясь, образует изотоп плутония 239Pu (Z = 94). Химический элемент с атомным номером Z = 95 америций был получен в 1944 году в результате реакции Четвертый трансурановый элемент кюрий (Z = 95) также был получен в 1944 году в результате реакции Это ядро является α-излучателем с периодом полураспада T1/2 = 162.79 дня. Оно было затем обнаружено как продукт β−-распада 242Am. . Элемент с порядковым номером Z = 97 был получен в 1949 году и назван берклием. Химический элемент калифорний с Z = 98 был получен в 1950 году в реакции Этот химический элемент был выделен в количестве 5000 атомов и образовался в
результате облучения ~10-6 г. кюрия. , , . В табл. 2 приведены реакции, в которых впервые были получены элементы тяжелее урана вплоть до Z = 101. Таблица 2. Реакции, в которых впервые были получены трансурановые элементы
Первые трансурановые элементы были получены в результате
облучения 238U нейтронами. В результате захвата нейтрона и
последующего β—-распада
заряд первоначального ядра увеличивается на единицу. С созданием ядерных
реакторов большой мощности стало возможным накапливать необходимые количества
трансурановых элементов и использовать их в качестве мишеней для продвижения к
большим Z путем облучения на циклотронах легкими заряженными частицами. В
частности, таким способом удалось получить достаточно большие количества изотопа
239Pu, так как период полураспада его составляет 2.4·104 лет.
Продвижение к элементам с большим Z оказывается таким
способом практически невозможным не только из-за того, что образующиеся изотопы
имеют малые периоды полураспада, но главным образом потому, что основными видами
распада образующихся изотопов химических элементов тяжелее урана — трансурановых
элементов, являются α-распад, β-распад и спонтанное деление. Весь имеющийся запас эйнштейния, полученный путем облучения в ядерных
реакторах к 1995 году, составлял около 10-12 г. Поэтому несмотря на
то, что сечение реакции (α,n) довольно велико
Облучение 238U различными пучками тяжелых ионов
(гелий, углерод, изотопы кислорода) привели к открытию большого числа изотопов с
Z = 95-100. В 1951 году
Э. Макмиллан и
Г. Сиборг
получили Нобелевскую премию по химии за открытие и исследование в химии
трансурановых элементов. |
nuclphys.sinp.msu.ru