Гексагидроксостаннат(IV) натрия
07.02.2021
Гексагидроксостаннат(IV) натрия — неорганическое соединение, соль щелочного металла натрия и гексагидроксооловянной кислоты с формулой Na2[Sn(OH)6] (или Na2SnO3•3h3O), бесцветные кристаллы, хорошо растворимые в воде, растворимость снижается с повышением температуры.
Получение
- Кипячение в концентрированном растворе едкого натра порошка олова:
S n + 2 N a O H + 4 H 2 O → 100 o C N a 2 [ S n ( O H ) 6 ] + 2 H 2 {displaystyle {mathsf {Sn+2NaOH+4H_{2}O {xrightarrow {100^{o}C}} Na_{2}[Sn(OH)_{6}]+2H_{2}}}}
- или оксида олова:
S n O 2 + 2 N a O H + 2 H 2 O → 60 − 70 o C N a 2 [ S n ( O H ) 6 ] {displaystyle {mathsf {SnO_{2}+2NaOH+2H_{2}O {xrightarrow {60-70^{o}C}} Na_{2}[Sn(OH)_{6}]}}}
Физические свойства
Гексагидроксостаннат(IV) натрия выделяется из раствора в виде бесцветных кристаллов, ромбоэдрической сингонии, пространственная группа R 3, параметры ячейки a = 0,595 нм, c = 1,417 нм, Z = 3. Устойчивый на воздухе, растворимый в воде.
Устойчивый на воздухе, растворимый в воде.
Химические свойства
- При нагревании разлагается:
N a 2 [ S n ( O H ) 6 ] → 140 o C N a 2 S n O 3 + 3 H 2 O {displaystyle {mathsf {Na_{2}[Sn(OH)_{6}] {xrightarrow {140^{o}C}} Na_{2}SnO_{3}+3H_{2}O}}} N a 2 [ S n ( O H ) 6 ] → 900 o C N a 2 O + S n O 2 + 3 H 2 O {displaystyle {mathsf {Na_{2}[Sn(OH)_{6}] {xrightarrow {900^{o}C}} Na_{2}O+SnO_{2}+3H_{2}O}}}
- Реагирует с разбавленными кислотами:
N a 2 [ S n ( O H ) 6 ] + 2 H C l → S n O 2 ↓ + 2 N a C l + 4 H 2 O {displaystyle {mathsf {Na_{2}[Sn(OH)_{6}]+2HCl {xrightarrow {}} SnO_{2}downarrow +2NaCl+4H_{2}O}}}
- Реагирует с углекислым газом:
N a 2 [ S n ( O H ) 6 ] + C O 2 → S n O 2 ↓ + N a 2 C O 3 + 3 H 2 O {displaystyle {mathsf {Na_{2}[Sn(OH)_{6}]+CO_{2} {xrightarrow {}} SnO_{2}downarrow +Na_{2}CO_{3}+3H_{2}O}}}
- Вступает в обменные реакции:
N a 2 [ S n ( O H ) 6 ] + C a ( N O 3 ) 2 → C a [ S n ( O H ) 6 ] ↓ + 2 N a N O 3 {displaystyle {mathsf {Na_{2}[Sn(OH)_{6}]+Ca(NO_{3})_{2} {xrightarrow {}} Ca[Sn(OH)_{6}]downarrow +2NaNO_{3}}}}
- Балашов, Андрей Владимирович
- Коричневый соус
- Брюне, Каролин
- Либман, Саломон
- Сан-Франциско Раш
Химические свойства солей — реакции, определение и примеры
Поможем понять и полюбить химию
Начать учиться
102. 2K
2K
Впервые школьники знакомятся с химическими свойствами солей в 8 классе, и для понимания дальнейшего материала без этой темы никуда. Наша статья поможет освежить знания перед контрольной или экзаменом: вспомним, какие бывают соли и как они образуются, рассмотрим типичные реакции с ними.
Соли — это сложные вещества, в состав которых входят катионы металла и анионы кислотного остатка. Иногда в состав солей входят водород или гидроксид-ион.
Классификация и номенклатура солей
Так как соли — это продукт полного или частичного замещения металлом атома водорода в кислоте, по составу их можно классифицировать следующим образом.
Кислые соли
Образованы неполным замещением атомов водорода на металл в кислоте.
В наименованиях кислых солей указывают количество водорода приставками «гидро-» или «дигидро-», название кислотного остатка и название металла. Если металл имеет переменную валентность, то в скобках указывают валентность.
Если металл имеет переменную валентность, то в скобках указывают валентность.Примеры кислых солей и их наименования:
LiHCO3 — гидрокарбонат лития,
NaHSO4 — гидросульфат натрия,
NaH2PO4 — дигидрофосфат натрия.
Средние соли
Образованы полным замещением атомов водорода в кислоте на металл.
Наименования средних солей складываются из названий кислотного остатка и металла. При необходимости указывают валентность.
Примеры средних солей с названиями:
CuSO4 — сульфат меди (II),
CaCl2 — хлорид кальция.
Основные соли
Продукт неполного замещения гидроксогрупп на кислотный остаток.
В наименованиях основных солей указывают количество гидроксид-ионов приставкой «гидроксо-» или «дигидроксо-», название кислотного остатка и название металла с указанием валентности.
Пример: Mg(OH)Cl — гидроксохлорид магния.
Двойные соли
В состав входят два разных металла и один кислотный остаток.
Наименование складывается из названия аниона кислотного остатка и названий металлов с указанием валентности (если металл имеет переменную валентность).
Примеры двойных солей и их наименования:
KNaSO4 — сульфат калия-натрия,
KAl(SO4)2 — сульфат калия-алюминия.
Смешанные соли
Содержат один металл и два разных кислотных остатка.
Наименования смешанных солей складываются из названия кислотных остатков (по усложнению) и названия металла с указанием валентности (при необходимости).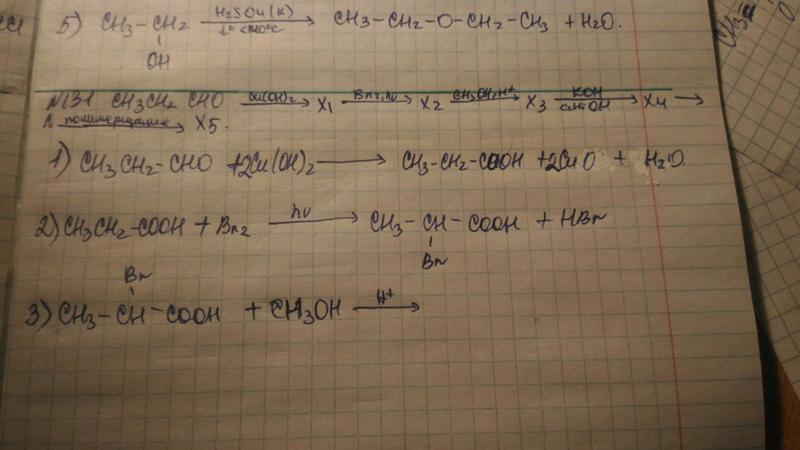
Примеры смешанных солей с наименованиями:
CaClOCl — хлорид-гиполхорит кальция,
PbFCl — фторид-хлорид свинца (II).
Комплексные соли
Образованы комплексным катионом или анионом, связанным с несколькими лигандами.
Называют комплексные соли по схеме: координационное число + лиганд с окончанием «-о» + комплексообразователь с окончанием «-ат» и указанием валентности + внешняя сфера, простой ион в родительном падеже.
Пример: K[Al(OH)4] — тетрагидроксоалюминат калия.
Гидратные соли
В состав входит молекула кристаллизационной воды.
Число молекул воды указывают численной приставкой к слову «гидрат» и добавляют название соли.
Пример: СuSO4∙5H2O — пентагидрат сульфата меди (II).
Твоя пятёрка по английскому.
С подробными решениями домашки от Skysmart
Получение солей
Получение средних солей
Средние соли можно образовать в ходе следующих реакций:
Металл + неметалл:
2Na + Cl2 = 2NaCl
Fe + S =FeS
Так получают только соли бескислородных кислот.
Металл, стоящий левее h3 в ряду активности, с раствором кислоты:
Mg + 2HCl = MgCl2 + h3
Металл с раствором соли менее активного металла:
Fe + CuCl2 = FeCl2 + Cu
Основный оксид + кислотный оксид:
Na2O + CO2 = Na2CO3
Основный оксид и кислота:
CuO + H2SO4= CuSO4 + H2O
Основание с кислотным оксидом:
2NaOH + SO3 = Na2
Основание с кислотой (реакция нейтрализации):
Ca(OH)2 + 2HCl = CaCl2 + 2H2O
Взаимодействие соли с кислотой:
MgCO3 + 2HCl = MgCl2 + H2O + CO2
BaCl2 + H2SO4 = BaSO4 + 2HCl
Взаимодействие возможно, если одним из продуктов реакции будет нерастворимая соль, вода или газ.

Реакция раствора основания с раствором соли:
2NaOH + CuSO4 = Na2SO4 + Ba(OH)2
Взаимодействие растворов двух солей с образованием новых солей:
NaCl + AgNO 3 = AgCl + NaNO3
Получение кислых солей
Кислые соли образуются при взаимодействии:
Кислот с металлами:
Zn + 2H2SO4 = H2 + Zn(HSO4)2
Кислот с оксидами металлов:
CaO + H3PO4 = CaHPO4 + H2O
Гидроксидов металлов с кислотами:
Ba(OH)2 + H3PO4 = BaHPO4 + 2H2O
Кислот с солями:
Ca3PO4 + 4H3PO4 = 3Ca(H2PO4)2
Аммиака с кислотами:
NH3 + H
Получение кислых солей возможно, если кислота в избытке.
Также кислые соли образуются в ходе реакции основания с избытком кислотного оксида:
KOH + CO2 = KHCO3
2SO2 + Ca(OH)2 = Ca(HSO3)2
Получение основных солей
Взаимодействие кислоты с избытком основания:
Fe(OH)3 + HCl = Fe(OH)2Cl + H2O
Добавление (по каплям) небольших количеств щелочей к растворам средних солей металлов:
Cu(NO3)2 + NaOH = CuOHNO3 + NaNO3
Взаимодействие солей слабых кислот со средними солями:
2MgCl2 + 2Na2CO3 + H2O = [Mg(OH)]2CO3 + CO2 + 4NaCl
Растворимые соли являются электролитами, следовательно, могут распадаться на ионы.
 Средние соли диссоциируют сразу:
Средние соли диссоциируют сразу:NaCl → Na+ + Cl—
Термическое разложение:
CaCO3 = CaO + CO2
Нитраты разлагаются в зависимости от активности металла соли:
Получение комплексных солей
Реакции солей с лигандами:
AgCl + 2Nh4 = [Ag(NH3)2]Cl
FeCl3 + 6KCN = K3[Fe(CN)6] + 3KCl
Zn(OH)2 + 2NaOH = Na2[Zn(OH)4]
Al2O3 + 2NaOH +3H2O = 2Na[Al(OH)4]
Получение двойных солей
Двойные соли получают совместной кристаллизацией двух солей:
Cr2(SO4)3 + K2SO4 + 24H2O = 2[KCr(SO4) 2 • 12H2O]
Химические свойства солей
Химические свойства средних солей
| Металл | Левее Mg, кроме Li | От Mg до Cu | Правее Cu |
| Продукты | MeNO3 + O2 | MexOy + NO2 + O2 | Me + NO2 + O2 |
| Пример | 2NaNO3 = 2NaNO2 + O2 | 2Cu(NO3)2 = 2CuO + 4NO2 + O2 | 2AgNO3= 2Ag + 2NO2 + O2 |
Соли аммония разлагаются с выделением азота или оксида азота (I), если в составе анион, проявляет окислительные свойства.
 В остальных случаях разложение солей аммония сопровождается выделением аммиака:
В остальных случаях разложение солей аммония сопровождается выделением аммиака:NH4Cl = NH3 + HCl
Взаимодействие солей с металлами:
Fe + CuSO4 = FeSO4 + Cu
Более активные металлы вытесняют менее активные металлы из растворов солей.
Некоторые соли подвержены гидролизу:
Na2CO3 + H2O = NaOH + NaHCO3
FeCl3+ H2O = Fe(OH)Cl2 + HCl
Обменные реакции соли и кислоты, соли с основаниями и взаимодействие солей с солями:
K2CO3 + 2HCl = 2KCl + CO2+H2O
Fe(NO3)3 + 3NaOH = Fe(OH)3 + 3NaNO3
AgCl + 2Na2S2O3 = Nа3[Ag(S2O3)2] + NaCl
Окислительно-восстановительные реакции, обусловленные свойствами катиона или аниона:
10FeSO4 + 2KMnO4 + 8H2SO4 = 5Fe2(SO4)3 + 2MnSO4 + K2SO4 + 8H2O
Химические свойства кислых солей
Диссоциация.
 Кислые соли диссоциируют ступенчато:
Кислые соли диссоциируют ступенчато:NaHCO3 → Na+ +HCO3−
HCO3− → H+ + CO32−
Термическое разложение с образованием средней соли:
Ca(HCO3)2 = CaCO3 + CO2 + H2O
Взаимодействие солей со щелочью. В результате образуется средняя соль:
Ba(HCO3)2 + Ba(OH)2 = 2BaCO3 + 2H2O
Химические свойства основных солей
Термическое разложение:
[Cu(OH)]2CO3 = 2CuO + CO2 + H2O
Реакции солей с кислотами — образование средней соли:
Sn(OH)Cl + HCl = SnCl2 + H2O
Диссоциация — так же как и кислые соли, основные соли диссоциируют ступенчато.

Химические свойства комплексных солей
Избыток сильной кислоты приводит к разрушению комплекса и образованию двух средних солей и воды:
Na[Al(OH)4] + 4HCl(изб.) = NaCl + AlCl3 + 4H2O,
Недостаток сильной кислоты приводит к образованию средней соли активного металла, амфотерного гидроксида и воды:
Na[Al(OH)4] + HCl = NaCl + Al(OH)3 + H2O,
Взаимодействие слабой кислоты с солью образует кислую соль активного металла, амфотерный гидроксид и воду:
Na[Al(OH)4] + H2S = NaHS + Al(OH)3 + H2O,
При действии углекислого или сернистого газа получаются кислая соль активного металла и амфотерный гидроксид:
K3[Cr(OH)6] + 3SO2 = 3KHSO3 + Cr(OH)3,
Реакция солей, образованных сильными кислотами с катионами Fe3+, Al3+ и Cr3+, приводит к взаимному усилению гидролиза.
 Продукты реакции — два амфотерных гидроксида и соль активного металла:
Продукты реакции — два амфотерных гидроксида и соль активного металла:K3[Cr(OH)6] +Al(NO3)3 = Al(OH)3 + Cr(OH)3 + 3KNO3
Разлагаются при нагревании:
K3[Cr(OH)6] =KCrO2 + 2H2O + 2KOH
Вопросы для самопроверки
С чем взаимодействуют средние соли?
Назовите типичные реакции солей.
Из предложенного списка солей выберите те, которые не реагируют с цинком: нитрит калия, бромид железа, карбонат цезия, сульфат меди.
Формула какого вещества пропущена в уравнении реакции:
MgO + … → MgCl2 + Н2O
HCl
Cl2
Cl2O7
HClO3
Татьяна Сосновцева
К предыдущей статье
Изомеры
К следующей статье
Качественные реакции
Получите план обучения, который поможет понять и полюбить химию
На вводном уроке с методистом
Выявим пробелы в знаниях и дадим советы по обучению
Расскажем, как проходят занятия
Подберём курс
Химия 311
Химия 31
Осень, 2017 — Dixon
Набор домашних заданий 2. 1 Решения
1 Решения
Ch. 6:8, 15-17, 19, 23, 25, 33, 36, 44, 49
8. Для реакция HCO 3 — ↔ H + + CO 3 2- , ΔG = +59кДж/моль при 298,15К. Найдите значение К для реакции.
K = exp(-ΔG/RT) = exp(-59000 Дж моль -1 /(8,314 Дж моль -1 К -1 *298,15 К)) = 5 x 10 -11 .
5 Гл. 7: 2, 7, 15
2. Различать между терминами конец точка и точка эквивалентности .
Точка эквивалентности относится к точке в титрование, когда реагенты были добавлены к точное стехиометрическое соотношение. Конечная точка относится к момент обнаружения эквивалентности.
7. Сколько потребуется миллилитров 0,100 М KI реагировать с 40,0 мл 0,0400 М Hg 2 (NO 3 ) 2 если реакция Hg 2 2+ + 2I — ↔ Hg 2 I 2 (s)?
н( КИ)/н(Hg 2 2+ ) = 2/1 или n(KI) = 2[Hg 2 (NO 3 ) 2 ]V(Hg 2 (NO 3 9)0024) 2 ) = 2(0,040 ммоль/мл)(40,0 мл)
n( KI) = 3,20 ммоль = [KI]V(KI) или V(KI) = 3,20 ммоль/(0,100 ммоль/мл) = 32,0 мл
15. Цианидный раствор объемом 12,73 мл обработан
с 25,00 мл раствора Ni 2+ (содержащего избыток Ni 2+ )
для превращения цианида в тетрацианоникелат(II):
Цианидный раствор объемом 12,73 мл обработан
с 25,00 мл раствора Ni 2+ (содержащего избыток Ni 2+ )
для превращения цианида в тетрацианоникелат(II):
4CN — + Ni 2+ ↔ Ni(CN) 4 2-
избыток никеля титруют 10,15 мл 0,01307 М этилендиаминтетрауксусной кислоты. кислота (ЭДТА):
Ni 2+ + ЭДТА 4- ↔ Ni(ЭДТА) 2-
Ni(CN) 4 2- не реагирует с ЭДТА. Если 39,35 мл ЭДТА требовалась для взаимодействия с 30,10 мл исходного Ni 2+ . раствора, рассчитайте молярность CN — в 12,73 мл цианида образец.
n(Ni 2+ ) ориг = n(Ni 2+ ) прореагировал + n(Ni 2+ ) избыток и n(CN — )/n(Ni 2+ ) прореагировал = 4/1
n(Ni 2+ ) прореагировало = n(Ni 2+ ) ориг — n(Ni 2+ ) избыток
[Ni 2+ ] ориг V
2 или 4 [ЭДТА]V ЭДТА
[Ni 2+ ] Orig = (0,01307 ммоль/мл) (39,35 мл)/(30,10 мл) = 0,017086 м
N (Ni 2+ ) ORIG = [NI 2+ ] ORINS = VIRY 4 VIRY VIRY VIRY VIRS VIOR ориг = (0,017086 ммоль/мл)(25,00 мл) = 0,42716 ммоль
n(Ni 2+ ) избыток = (0,01307 ммоль/мл)(10,15 мл) = 0,13266 ммоль
n(Ni 2+ ) прореагировало = 0,42716 ммоль — 0,13266 ммоль = 0,2945 ммоль
n(CN — ) = 4n(Ni 2+ ) прореагировало = 1,178 ммоль
[CN — ]
= 1. 178 mmol/12.73 mL = 0.09254 M
178 mmol/12.73 mL = 0.09254 M
The Bell UH-1 Huey & the Hughes OH-6 Loach
Знаменитые вертолеты Bell UH-1 Huey и Hughes OH-6 Cayuse Loach продемонстрировали универсальность вертолетов во время войны во Вьетнаме.
Автор Michael Haskew
Вертолет достиг совершеннолетия во время войны во Вьетнаме, выполняя множество задач от перевозки и развертывания войск до эвакуации раненых, доставки припасов, огневой мощи и наблюдения. Два самых известных вертолета, развернутых вооруженными силами США во Вьетнаме, иллюстрируют разнообразие выполняемых ими задач. Вертолеты Bell UH-1 Iroquois по прозвищу Huey и Hughes OH-6 Cayuse, обычно называемые Loach, были знакомы американским солдатам и гражданским лицам, которые смотрели телевизионные новости о войне в своих гостиных.
Разработка Huey началась с потребности современной армии США в высокопроизводительном универсальном вертолете, способном перевозить грузы и персонал, а также эвакуировать раненых из зон боевых действий. Прототип XH-40 Huey впервые поднялся в воздух в октябре 1956 года, а UH-1, первоначально называвшийся HU-1 (отсюда и прозвище «Хьюи»), был запущен в производство в 1960 году. завершено, и почти половина из них служила во Вьетнаме.
Прототип XH-40 Huey впервые поднялся в воздух в октябре 1956 года, а UH-1, первоначально называвшийся HU-1 (отсюда и прозвище «Хьюи»), был запущен в производство в 1960 году. завершено, и почти половина из них служила во Вьетнаме.
Было изготовлено множество военных и гражданских вариантов Huey, и одним из самых распространенных военных Huey во время войны во Вьетнаме был UH-1D, увеличенная версия оригинального UH-1, поступившего на вооружение в 1963 году. UH-1D был оснащен турбовальным двигателем Lycoming T53-L-11 с двухлопастным несущим и рулевым винтами, способным развивать крейсерскую скорость 125 миль в час или максимальную скорость 135 миль в час с дальностью полета 315 миль и практическим потолком больше чем 19000 футов.
Разработанный как военный транспорт, UH-1D мог вместить экипаж до четырех человек, максимум 14 солдат в боевой экипировке, шесть носилок или эквивалентный вес груза. Он был чуть более 57 футов в длину, чуть более 14 футов в высоту и имел максимальную взлетную массу 4,75 тонны. Обычно он был вооружен парой пулеметов калибра 7,62 или 30 мм, а иногда и парой 70-мм ракетных блоков.
Обычно он был вооружен парой пулеметов калибра 7,62 или 30 мм, а иногда и парой 70-мм ракетных блоков.
Фотографии американских боевых частей, входящих и выходящих из «Хьюи» или выгружаемых на его палубу раненых, являются одними из самых ярких изображений войны во Вьетнаме, и «Хьюи» был заметен в многочисленных художественных фильмах, посвященных американскому опыту во время затяжного конфликта на юго-востоке. Азия.
В отличие от этого, Loach был миниатюрным вертолетом с максимальной взлетной массой чуть более 1,5 тонны, одним турбовальным двигателем Allison T63A-5A или T63A-700, который приводил в движение четырехлопастный несущий винт и двухлопастный рулевой винт на максимальная скорость 175 миль в час, дальность полета 267 миль и практический потолок 16 000 футов. Лоуч длиной чуть более 30 футов и высотой девять футов имел экипаж из двух человек.
OH-6 Cayuse был разработан на основе спецификаций, выпущенных армией США в 1960 для легкого вертолета наблюдения (LOH), и знакомое прозвище Loach произошло от аббревиатуры.
