Человек генно-модифицированный / Homo genere mutatio
Статья на конкурс «био/мол/текст»: Когда Олдос Хаксли писал «Дивный новый мир», думал ли он, что на самом деле может наступить эра детей, созданных по заказу? «Дети здесь не рождаются. Их выращивают в специальных инкубаторах и делят на альфы, беты, гаммы, дельты и эпсилоны в зависимости от умственных способностей». На сегодняшний день вряд ли найдется более рьяно обсуждаемая в СМИ тема биомедицины, чем CRISPR/Cas. СМИ готовят общество к появлению в будущем фабрик по производству детей на заказ, ученые — к возможности создания генетической панацеи. Исследования на человеческих эмбрионах с применением генетических модификаций лишь подливают масла в огонь. Общественность строит догадки, какие перспективы дает этот инструмент генного редактирования в руках ученых. Ждет ли мир появление «отредактированных» людей? Станет ли Homo genere mutatio в эволюционный ряд после Homo sapiens sapiens? К чему бы ни привела технология CRISPR/Cas, несомненно, что это шаг в бездну новых возможностей.
Эта работа опубликована в номинации «Биомедицина сегодня и завтра» конкурса «био/мол/текст»-2017.

Генеральный спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Спонсором приза зрительских симпатий и партнером номинации «Биомедицина сегодня и завтра» выступила фирма «Инвитро».
«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Что такое CRISPR/Cas9 и с чем его едят
Хотя система CRISPR известна с 1980-х, активно о ней заговорили лишь несколько лет назад [1]. Повышенное внимание к технологии генной модификации связано с перспективами, которые она открывает. В частности, лечение генетических заболеваний. Это может изменить медицину. Освоение CRISPR/Cas9 в рамках человеческого тела подобно первым шагам в космосе.
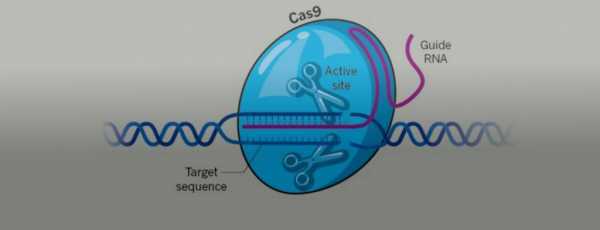
Технология CRISPR (от англ. Clustered Regularly Interspaced Short Palindromic Repeats — короткие палиндромные повторы, регулярно расположенные группами) основана на направленном редактировании генома с помощью эндонуклеазы Cas9. Словно умные ножницы, фермент Cas9 совершает двунитевые разрезы в нужных участках гена, удаляя дефекты генетической информации (рис. 1). После того как разрыв внесен, включаются системы восстановления ДНК, и нужная неповрежденная последовательность встает на место удаленной дефектной [2].
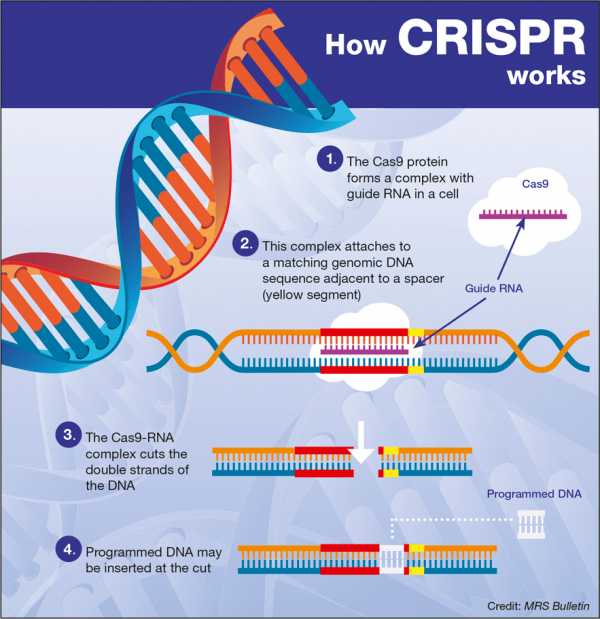
Рисунок 1. Схема работы CRISPR/Cas9.
Это позволяет не просто добавлять новую ДНК-последовательность в ген, а встраивать ее направленно, заменяя конкретный непригодный участок новым. CRISPR/Cas9 может стать мостиком над пропастью наследственных заболеваний. Сейчас известны тысячи генетических патологий, не подвластных лечению . Больным можно оказать только симптоматическую или паллиативную помощь. Вылечить генетический дефект врачам не под силу. А CRISPR как инструмент модификации дает шанс людям с генетическими патологиями. Становится возможным «ремонтировать» мутации, вызвавшие болезни.
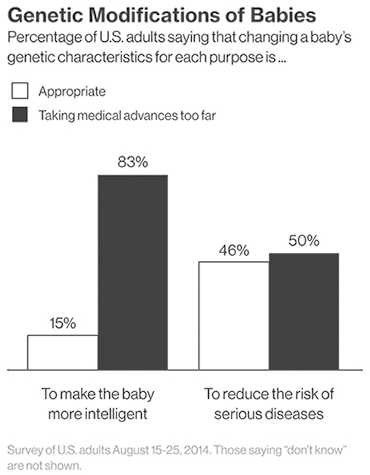
Рисунок 2. Общественное мнение относительно технологии CRISPR/Cas9.
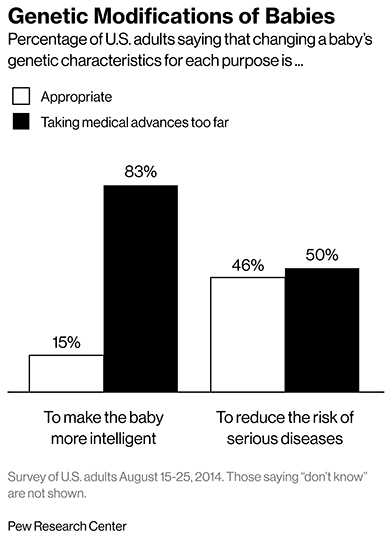
Другой стороной медали может стать использование технологии не по задуманному назначению. Общество страшится появления «дизайнерских» детей, сделанных на заказ родителями. Проведенный опрос среди американцев говорит о том, что люди еще не готовы принять возможности генной терапии. Так, 83% респондентов не хотят использовать технологию для совершенствования детей (рис 2).
Еще один шаг к совершенству
Однако технология генного «ремонтирования» не без изъянов. Она не доведена до совершенства. CRISPR/Cas9 — это не волшебная палочка, призванная исправлять любой генетический дефект. Генетический скальпель не отличается высоким уровнем точности. Эндонуклеаза может совершить разрезы и в нецелевых участках. При этом система CRISPR/Cas9 может не исправлять мутации, как задумывалось, а создавать новые.
Отсутствие стопроцентной точности в работе эндонуклеазы Cas9 делает технологию небезопасной и ненадежной. Пока система не станет более точной, она не получит широкое распространение в практической медицине. Однако маленькие шаги в сторону реальности метода совершаются. Работа ученых из Массачусетского технологического института выводит технологию CRISPR на новый уровень посредством создания улучшенной версии фермента — eSpCas9.
eSpCas9 имеет повышенную специфичность, что снижает вероятность побочных эффектов при редактировании генома. Разрезы этого фермента более точные. Это позволило снизить риск вероятных ошибок примерно в 10 раз. Несомненно, такое открытие — настоящий прорыв для генного редактирования. Оно стало более специфичным и точным, а значит, стало ближе к практической медицине, чем когда-либо [3].
Первый блин комом
В апреле 2015 года мир должен был ахнуть от удивления: впервые ученым удалось не просто прочитать, а еще и отредактировать геном человека (рис. 3). Удивительно, но это событие не привлекло к себе много внимания. Такие авторитетные издания, как Nature и Science, не пожелали публиковать данные об исследовании ввиду его неэтичности. Связано это с тем, что впервые методику генного редактирования CRISPR/Cas9 проверили на человеческих эмбрионах [4].

Рисунок 3. Человеческие эмбрионы с отредактированным геномом.
Китайские ученые из университета Гуанчжоу использовали нежизнеспособные эмбрионы. Их получили посредством ЭКО. На этапе их образования произошел сбой, который привел к формированию трипронуклеарных эмбрионов, которые содержат не два пронуклеуса — материнский и отцовский, — а три. Такие зародыши обычно погибают еще до имплантации и нежизнеспособны: они содержат аномальный тройной набор хромосом (69 шт.), тогда как в норме кариотип составляют 46 [5]. Лишние 23 хромосомы не дают плоду развиваться нормально, что приводит к его гибели [6].
Перед учеными не стояла задача продлить время жизни трипронуклеарных эмбрионов. Их целью было осуществить генный нокаут бета-талассемии, которой страдали эмбрионы. Задумку не вполне удалось реализовать. Из 86-и лишь полсотни эмбрионов удалось протестировать. Генная модификация произошла в 28 зародышах, но почти во всех случаях — не такая, как надо, или в неправильном месте. Дефектный ген бета-талассемии был успешно удален из клеток лишь четырех эмбрионов.
Эксперимент не только не принес ожидаемого эффекта, но и создал новые непредвиденные мутации в геноме множества клеток. По словам лидера научной группы, использованная технология пока слишком «сырая». Она не может быть использована на нормальных эмбрионах. Чтобы приступить к ее клиническому использованию, процент успеха должен приближаться к 100.
Модификация людей одобрена законом
Официальное разрешение от вневедомственного органа Министерства здравоохранения Соединенного Королевства — HFEA (Human fertilisation and embryology authority) — на редактирование человеческих эмбрионов с помощью технологии CRISPR/Cas9 в 2016 году получила исследовательская группа из Института Фрэнсиса Крика в Великобритании под руководством биолога Кэти Ниакан. В качестве объекта исследования будут использоваться лишние эмбрионы, которые получают при ЭКО, — те, что оказались не нужны семьям ввиду свершившегося успешного подсаживания других зародышей. Раньше такой материал просто утилизировали за ненадобностью.
Это первое разрешение на подобную деятельность в Великобритании, и ученых не ждет полная свобода действий. Эмбрионы могут быть использованы лишь для определенных целей, которые будут оценены экспертной комиссией (рис. 4). Применять можно семидневные эмбрионы. Срок жизни объектов исследования после начала эксперимента — 14 дней. После этого они должны быть утилизированы. Подсаживание их к суррогатной матери исключено. Пролонгировать беременность генномодифицированными эмбрионами запрещено [7].

Рисунок 4. Человеческому эмбриону вводят отредактированную ДНК в лондонской лаборатории Института Фрэнсиса Крика.
Успех CRISPR/Cas9
Первые полосы научных журналов в августе 2017 года вновь украшала аббревиатура CRISPR/Cas9. На этот раз новостями об успешном эксперименте спешили поделиться ученые из Орегонского университета здоровья и науки (OHSU). Группа ученых во главе с уроженцем Казахстана Шухратом Миталиповым применили технологии редактирования генов CRISPR/Cas9, чтобы изменить ДНК больных человеческих эмбрионов [8].
Среди безумного моря наследственных патологий выбор объекта исследования пал на гипертрофическую кардиомиопатию. Это серьезное генетическое заболевание сердца с аутосомно-доминантным типом наследования. Это значит, что патология проявится при наличии хотя бы одной дефектной копии гена. При этом данный ген не сцеплен с половой хромосомой, поэтому встречается как у мужчин, так и у женщин.
Каждый год гипертрофическая кардиомиопатия уносит жизни 50% больных ей. Мутации в гене MYBPC3, отвечающем за сокращение кардиомиоцитов (клеток сердца), приводят к хаотичному расположению мышечных волокон и их утолщению. Возникает нарушение ритма, сердечная недостаточность и как следствие — смерть.
Особенно часто заболевание поражает молодых спортсменов [9]. Технология CRISPR/Cas9 позволила группе ученых отредактировать дефектный ген. В исследовании использовали 12 здоровых яйцеклеток и сперму, несущую мутантный ген MYBPC3. С помощью CRISPR/Cas9 из ДНК сперматозоидов удалось вырезать дефект, словно ножницами (рис. 5) [10].
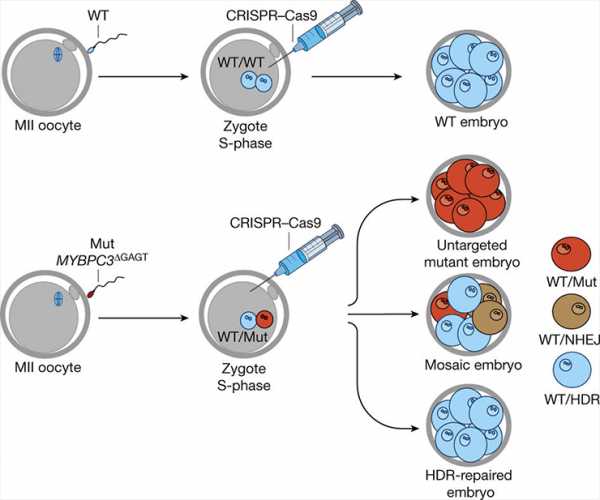
Рисунок 5. Схема воздействия CRISPR/Cas9 на ген MYBPC3.
В результате получили 42 здоровых эмбриона из 58-и. Это составило 72,4% потомства без патологии. Такие результаты оказались довольно успешными по сравнению с полученными ранее при других исследованиях с CRISPR/Cas9 на эмбрионах с генетическими заболеваниями. Улучшение показателей, их приближение к ста процентам, дает надежду на лечение наследственных болезней в ближайшем будущем.
«Мы продемонстрировали возможность исправлять мутации в человеческом эмбрионе безопасным способом и с заметной степенью эффективности», — говорит один из руководителей проекта, Хуан Карлос Бельмонте.
Что может предложить миру CRISPR/Cas9
Каждое крупное открытие в истории человечества встречало сопротивление. С этим столкнулись и Галилео Галилей, и Джордано Бруно, и Парацельс, и Игнац Земмельвейс, осмеянный за свое предложение мыть врачам руки перед осмотром больных. Мир с трудом принимает новые открытия. Сотни известных имен стали признанными лишь после смерти и были гонимы за свои убеждения при жизни.
Инквизиция и научное невежество остались далеко позади. Сегодня медицина развивается очень быстро — в сравнении с минувшими столетиями она движется семимильными шагами. Несомненно, CRISPR/Cas9 станет одним из важнейших биотехнологических открытий XXI века. Что же может предложить миру эта технология?
- Лечение наследственных заболеваний. Реальным на данный момент представляется избавить мир от моногенных патологий — болезней, вызванных мутацией в одном гене. В техническом плане это осуществить проще, чем редактировать дефект нескольких генов (рис. 6) [11], [12].
- Борьба с ретровирусными инфекциями, в том числе с ВИЧ [13].
- Лечение рака может стать возможным при определении роли генов, отвечающих за перерождение нормальных клеток в атипичные. Если ученые откроют мутацию, которая запускает процесс злокачественной пролиферации, то появится возможность исправить дефект с помощью генетического редактирования [14].
- Исследования, которые помогут пополнить библиотеку знаний о развитии человека. В частности, технология CRISPR будет полезна для выяснения процессов формирования здорового эмбриона (рис. 7). В перспективе это поможет предотвращать выкидыши и сделать процедуру ЭКО более эффективной. В настоящее время из 100 оплодотворенных яйцеклеток лишь половина способна достигнуть стадии бластоцисты, из них только 25 имеют шанс на имплантацию в материнской утробе и лишь 13 могут развиваться в течение минимум трех месяцев. Комментирует Кэти Ниакан, руководитель проекта в Великобритании: «Именно поэтому эти исследования так важны. Выкидыши и бесплодие имеют чрезвычайное распространение, а мы до сих пор не владеем полной картиной того, как устроены все механизмы» [15].
- Ксенотрансплантация — пересадка органов от животных к людям — станет возможной благодаря системе CRISPR/Cas9. Многообразие травм и заболеваний нередко требует трансплантации. Не всегда пациент может получить требуемый орган. Использование органов животных могло бы спасти многие жизни (рис. 8). Свиньи имеют приближенные по характеристикам к человеческим органы, однако их геном содержит особые эндогенные ретровирусы — PERV, которые могут привести к опасным для пациента последствиям при пересадке. Инактивация этих вирусов открывает дверь к безопасному источнику органов и тканей для трансплантации больным людям органов от животных [16].
- ГМ-животные и пища, которые с помощью генной модификации могут получить полезные свойства и потерять неблагоприятные (рис. 9) [17].
- Создание «дизайнерских детей» у многих ассоциируется с технологией CRISPR/Cas9. Хотя такие исследования не проводили и ни один из ученых не ставил перед собой такую цель, именно возможность создания ГМ-детей по своему вкусу вызывает наибольшие опасения у общественности (рис. 10). Однако биологи считают, что на данном этапе освоения технологии это неподвластно человеку. Цитата профессора Хуана Карлоса Бельмонте: «Никто из нас пока не думает об этом [имеется в виду редактирование геномов людей — прим. ред.], потому что на данный момент это невозможно реализовать на практике. Пока исследования CRISPR/Cas9 относятся к области фундаментальной науки. Я уже не говорю о том, что мы рассуждаем о системах, которые природа создавала миллионы лет».
Рисунок 6. Руками врача буквально лечится геном.
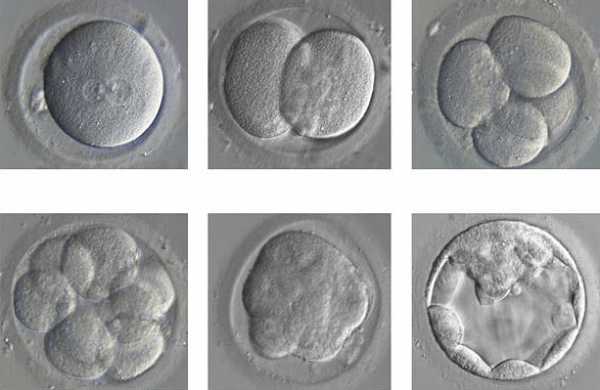
Рисунок 7. Развитие эмбриона из одного оплодотворенного яйца до бластоцисты.
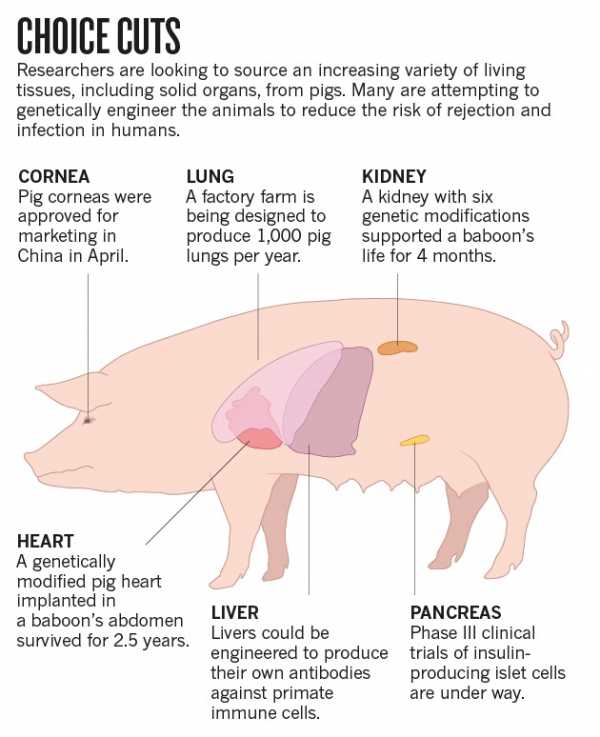
Рисунок 8. Схема возможного использования органов свиней.

Рисунок 9. ГМ-пища.

Рисунок 10. Схематичное изображение «дизайнерского» ребенка.
Тем не менее случайные мутации, которые ненароком могут появиться при редактировании генома, потенциально могут быть еще опаснее, чем имеющиеся (рис. 11).

Рисунок 11. Схематичное изображение гена с опасной мутацией.
Этично ли редактировать людей?
CRISPR/Cas9 предстоит преодолеть не только технические трудности, которые требуют приближенного к ста процентам результата для внедрения в практическую медицину, но и этические (рис. 12). Насколько нравственно редактировать геном человека, данный ему при рождении? Можем ли мы вмешиваться в работу природы и модифицировать ее по своему усмотрению?

Рисунок 12. Обложка книги профессора Калифорнийского университета Пола Кнопфлера — GMO sapiens.
Международный мораторий на опыты над людьми говорит сам за себя. А проведенные на данный момент исследования имели четкие рамки, закрепленные законодательно. Вынашивание и рождение «редактированного ребенка» в таких условиях невозможно.
В противовес широким возможностям CRISPR/Cas9 выступают и ее непредсказуемые долговременные последствия. Ввиду этого директор национальной разведки США Джеймс Клэппер объявил, что технологию CRISPR теперь можно рассматривать как угрозу национальной безопасности: «Редактирование генома — это оружие массового уничтожения. Его легко использовать и трудно контролировать» [18].
По мнению биоэтика из Университета Висконсина в Мэдисоне Альты Чаро, «дизайнерские дети» — сомнительная перспектива для CRISPR/Cas9. Исследовав положение дел с технологией генной модификации, она сделала заявление: «Озабоченность по поводу проведенных экспериментов раздута. Это увлекательный, важный и достаточно внушительный шаг к изучению правильного редактирования эмбрионов. Независимо от беспокойных предположений, это не начало эпохи „дизайнерских детей“. Наследование таких признаков, как интеллект или атлетизм, определено множеством генов. Разгадать каждый из них и спроектировать ребенка не представляется возможным» [19].
Что же принесет миру технология генного редактирования CRISPR/Cas9 — пользу или вред? Однозначного ответа на этот вопрос не даст никто. Хотя практической пользы от технологии пока получено не было, то будущее, которое рисует CRISPR/Cas9 в рамках биомедицины, рано или поздно наступит. И нам откроется возможность узреть и понять этот новый и смелый отредактированный мир (рис. 13).

Рисунок 13. Безграничные возможности CRISPR/Cas9.
- CRISPR-системы: иммунизация прокариот;
- Просто о сложном: CRISPR/Cas;
- I. M. Slaymaker, L. Gao, B. Zetsche, D. A. Scott, W. X. Yan, F. Zhang. (2016). Rationally engineered Cas9 nucleases with improved specificity. Science. 351, 84-88;
- Puping Liang, Yanwen Xu, Xiya Zhang, Chenhui Ding, Rui Huang, et. al.. (2015). CRISPR/Cas9-mediated gene editing in human tripronuclear zygotes. Protein Cell. 6, 363-372;
- Миньженкова М.Е. Метафазная сравнительная геномная гибридизация в диагностике хромосомного дисбаланса: дис…..канд. мед. наук. — Москва, 2014. — 131 с.;
- Байкошкарова С.Б., Сабырбек Ж.Б., Садыбекова Л.С., Махамбетова А.М., Уморбекова Г.А., Курманалиев С.К. (2016). Морфологические характеристики раннего эмбриогенеза триплоидных эмбрионов человека. Сайт Казахского национального университета;
- Gallagher J. (2016). Kathy Niakan: Scientist makes case to edit embryos. BBC News;
- Connor S. (2017). First human embryos edited in U.S. MIT Technology Review;
- Джанашия П.Х., Круглов В.А., Назаренко В.А., Николенко С.А. Кардиомиопатии и миокардиты. М.: Российский государственный медицинский университет, 2000. — 128 с;
- Hong Ma, Nuria Marti-Gutierrez, Sang-Wook Park, Jun Wu, Yeonmi Lee, et. al.. (2017). Correction of a pathogenic gene mutation in human embryos. Nature. 548, 413-419;
- Lu Xiao-Jie, Xue Hui-Ying, Ke Zun-Ping, Chen Jin-Lian, Ji Li-Juan. (2015). CRISPR-Cas9: a new and promising player in gene therapy. J Med Genet. 52, 289-296;
- Смирнихина С.А. и Лавров А.В. (2016). Генная терапия наследственных заболеваний с использованием технологии CRISPR/Cas9 in vivo. Медицинская генетика. 9, 3–11;
- CRISPR/Cas9 как помощник в борьбе с ВИЧ;
- Cyranoski D. (2016). CRISPR gene-editing tested in a person for the first time. Nature News;
- Devlin H. (2017). DNA editing in human embryos reveals role of fertility ‘master gene’. The Guardian: Genetics;
- Dong Niu, Hong-Jiang Wei, Lin Lin, Haydy George, Tao Wang, et. al.. (2017). Inactivation of porcine endogenous retrovirus in pigs using CRISPR-Cas9. Science. 357, 1303-1307;
- Еще раз про ГМО;
- . (2016). Gene intelligence. Nature. 531, 140-140;
- Cha A.E. (2017). First human embryo editing experiment in U.S. ‘corrects’ gene for heart condition. The Washington Post.
biomolecula.ru
Редактирование генов человека: начало – Зожник

С помощью CRISPR прямо сейчас происходит грандиозный прорыв в генной инженерии: ученые планируют скоро научиться избавлять нас навсегда от любых болезней, с перспективой любых контролируемых мутаций и вечной жизни.
На публикацию этого поста нас натолкнуло видео “CRISPR: редактирование генов изменит все и навсегда”, в котором рассказывается о переднем крае науки в части генной модификации человека: речь идет не просто об избавлении от болезней типа СПИД, рак и многие другие, но и о создании безупречного нового вида людей, людей со сверхспособностями и бессмертии. И это происходит прямо сейчас на наших глазах.
Все эти перспективы открываются благодаря недавнему революционному открытию белка CRISPR–Cas9, но обо всем по порядку.
Раньше считалось, что ДНК в каждой нашей клетке – абсолютно идентичны и содержат нашу точную и неизменную копию – какую клетку бы ни взять, но оказалось, что это не так: ДНК в разных клетках немного разные и они меняются в зависимости от разных обстоятельств.
Открытию белка CRISPR – Cas9 помогли наблюдения за выжившими после атаки вирусов бактериями.
Древнейшая война на земле
Бактерии и вирусы соперничают с начала жизни: вирусы-бактериофаги охотятся на бактерии. В океане они убивают 40% от общего числа бактерий каждый день. Вирус делает это, вставляя свой генетический код в бактерию и использует её в качестве фабрики.
Бактерии пытаются безуспешно сопротивляться, но в большинстве случаев их защитные механизмы оказываются слишком слабыми. Но иногда бактерии выживают. Тогда они могут активировать свою самую эффективную противовирусную систему. Они сохраняют часть ДНК вируса в своём генетическом коде, ДНК-архиве “CRISPR”. Здесь она хранится до необходимого момента.
Когда вирус снова атакует, бактерия создает РНК-копию из ДНК архива и
заряжает секретное оружие – белок Cas9. Этот протеин сканирует бактерию на предмет вмешательства вируса, сравнивая каждую часть найденного ДНК с архивом. Когда находится 100% соответствие, он активируется и отрезает ДНК вируса, делая его бесполезным, таким образом защищая бактерию.
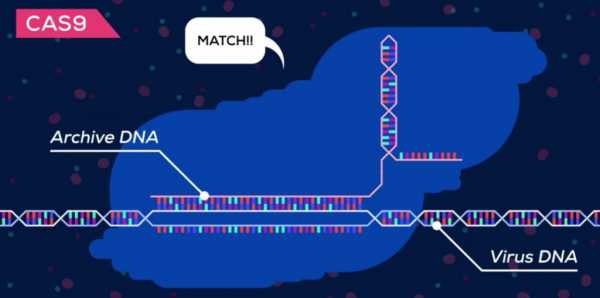
Белок Cas9 сканирует ДНК клетки на предмет внедрения вируса и заменяет испорченную часть здоровым фрагментом.
Что характерно, Cas9 очень точен, словно ДНК хирург. Переворот произошел, когда ученые поняли, что система CRISPR программируема – можно просто дать копию ДНК, которую нужно изменить, и поместить систему в живую клетку.
Помимо точности, дешевизны и простоты использования, CRISPR позволяет включать и выключать гены живых клеток и изучать конкретные последовательности ДНК.
Этот метод также работает с любыми клетками, микроорганизмами, растениями, животными или людьми.
Ученые выяснили, что Cas9 можно программировать на любые замены в любой части ДНК – и это открывает практически безграничные возможности для человечества.
Болезням конец?
В 2015-м ученые использовали CRISPR для удаления вируса ВИЧ из клеток пациентов,
и доказали, что это возможно. Годом позже они провели более амбициозный эксперимент с крысами с вирусом ВИЧ в практически всех их клетках.
Учёные просто ввели CRISPR в их хвосты, и смогли удалить более 50% вируса из клеток по всему телу. Возможно, через несколько десятилетий CRISPR поможет избавиться от ВИЧ и других ретровирусов – вирусов, которые прячутся внутри человеческой ДНК, вроде герпеса. Возможно CRISPR сможет победить нашего худшего врага, рак.
Рак является результатом появления клеток, отказывающихся умирать и продолжающих делиться, попутно прячась от иммунной системы. CRISPR дает нам средство редактировать наши иммунные клетки и делать их лучшими охотниками на раковые клетки.
Возможно через некоторое время лечение от рака будет всего лишь парой уколов с несколькими тысячами ваших собственных клеток, созданных в лаборатории, чтобы вылечить вас навсегда.

Возможно через некоторое время вопрос лечения рака – вопрос пары уколов модифицированных клеток.
Первое клиническое испытание такой терапии на пациентах-людях было одобрено в начале 2016-го в США. Менее чем через месяц китайские ученые объявили, что будут лечить пациентов с раком легких иммунными клетками, модифицированными по этой же технологии, в августе 2016. Дело быстро набирает обороты.
А еще есть генетические заболевания, тысячи их. Они разнятся от слегка раздражающих до крайне смертельных или приносящих годы страданий. С мощными инструментами вроде CRISPR однажды мы сможем покончить с этим.
Более 3000 генетических заболеваний вызываются единственной заменой в ДНК.
Мы уже создаем модифицированную версию Cas9, которая исправляет такие ошибки и избавляет клетку от заболевания. Через пару десятилетий мы может быть сможем навсегда уничтожить тысячи заболеваний. Однако у всех эти медицинских применений один недостаток – они ограничены одним пациентом и умрут вместе с ним, если мы не используем их на репродуктивных клетках или на ранней стадии развития плода.
CRISPR вероятно будет использоваться куда шире. Например для создания модифицированного человека, спроектированного ребенка. Это принесет плавные но необратимые изменения в человеческом генофонде.
Спроектированные дети
Средства изменения ДНК человеческого плода уже существуют,
но технология находится на раннем этапе развития. Однако, ее применяли уже дважды. В 2015-м и 2016-м эксперименты китайских ученых с человеческими эмбрионами достигли частичного успеха на второй попытке.
Они выявили гигантские трудности в редактировании генов эмбрионов, но множество ученых уже работают над решением этих проблем. Это то же самое, что и компьютеры 70-х: в будущем они станут лучше.
Вне зависимости от ваших взглядов на генную инженерию, она коснётся всех. Модифицированные люди могут изменить геном всего нашего вида, потому что их привитые качества будут переданы их детям, и через поколения медленно распространятся, медленно меняя генофонд человечества. Это начнется постепенно.
Первые спроектированные дети не будут сильно отличаться от нас. Скорее всего, их гены будут изменены для избавления от смертельных наследственных заболеваний.
По мере развития технологий все больше людей начнут думать, что неиспользование генетической модификации неэтично, потому что это обрекает детей
на страдание и смерть, которые можно предотвратить.

Как только первый такой ребенок родится, откроется дверь, которую уже не удастся закрыть. Сначала некоторые черты никто не будет трогать, но по мере роста одобрения технологии и наших знаний о генетическом коде, будет расти будет и соблазн.
Если вы сделаете свое потомство иммунным к болезни Альцгеймера, почему бы вдобавок не дать им улучшенный метаболизм? Почему бы до кучи не наградить их отличным зрением? Как насчет роста или мускул? Пышных волос? Как насчет дара исключительного интеллекта для вашего ребенка?
Огромные перемены придут как результат накопления личных решений миллионов людей.
Это скользкий склон, и модифицированные люди могут стать новой нормой. Пока генная инженерия становится все более привычной, а наши знания улучшаются, мы можем подойти к искоренению главной причины смертности – старения.

2/3 из примерно 150 000 человек, умерших сегодня, умерли по причинам, связанным со старением.
Сегодня считается, что старение вызывается накоплением повреждений в наших клетках
вроде разрывов ДНК или износа систем, ответственных за исправление этих повреждений.
Но есть также и гены, которые напрямую влияют на наше старение.
Генная инженерия и прочая терапия могли бы остановить или замедлить старение. Возможно даже обратить его вспять.

Типичная реакция на возможность вечной жизни (как и любой другой привычной сейчас, но революционной несколько сотен лет назад технологии).
Вечная жизнь и “люди икс”
Мы знаем, что в природе есть животные, которые не стареют. Может, мы могли бы занять у них пару генов. Некоторые ученые считают что однажды старение будет искоренено. Мы все равно будем умирать, но только не в больнице в 90 лет, а через пару тысяч лет, прожитых в окружении наших любимых.
Вызов огромен и, возможно, цель недостижима, но можно допустить, что люди, живущие сегодня, могут оказаться первыми, кто вкусит плоды анти-возрастной терапии. Возможно, нужно всего лишь убедить смышленого миллиардера в необходимости помочь решить эту большую проблему.
Если смотреть на это шире, мы могли бы решить множество задач с помощью специально измененных людей, например которые могли бы лучше справляться с высококалорийной едой, и избавиться от таких недугов цивилизации как ожирение.
Владея модифицированной иммунной системой с перечнем потенциальных угроз,
мы могли бы стать неуязвимыми для большинства заболеваний, преследующих нас сегодня. Ещё позже мы смогли бы создать людей для длительных космических перелетов и для адаптации к различным условиям на других планетах, что было бы крайне полезно для поддержания нашей жизни во враждебной вселенной.
Несколько щепоток соли
Есть несколько главных препятствий, технологических и этических. Многие почувствуют страх перед миром, где мы отсеиваем несовершенных людей, а потомство выбираем на основе того, что считается здоровым.
Но мы уже живем в таком мире. Тесты на десятки генетических заболеваний или осложнений стали нормой для беременных женщин во многих странах. Часто одно подозрение на генетический дефект может привести к прерыванию беременности.
Возьмем для примера синдром Дауна, один из самых распространенных генетических дефектов: в Европе около 90% беременностей с установленным наличием этого отклонения прерываются.

Генетический отбор в действии: уже сейчас синдром Дауна диагностируется на ранней стадии развития эмбриона и 90% беременности с этим диагнозом прерывается.
Решение о прерывании беременности является очень личным, но важно понимать, что мы уже сегодня отбираем людей, основываясь на состоянии здоровья. Нет смысла притворяться, что это изменится, поэтому нам необходимо действовать осторожно и этично, несмотря на растущую свободу выбора благодаря дальнейшему развитию технологий.
Однако, все это перспективы отдаленного будущего. Несмотря на мощность CRISPR, метод не лишен недостатков. Могут случиться ошибки при редактировании, неизвестные ошибки могут произойти в любой части ДНК и остаться незамеченными.
Изменение гена может достичь нужного результата и вылечить от заболевания, но вместе с этим спровоцировать нежелательные изменения. Мы попросту недостаточно знаем о сложных взаимосвязях наших генов, чтобы избежать непредсказуемых последствий.
Работа над точностью и методами наблюдения очень важна в предстоящих клинических испытаниях. И раз уж мы обсудили возможное светлое будущее, также стоит упомянуть и более мрачное видение. Представьте, что может страна вроде Северной Кореи сделать с таким уровнем технологий?

Важно, чтобы технология генной модификации не попала в руки тоталитарным режимам, которые гипотетически могут использовать ее во вред человечеству – например, создать армию генетически модифицированных солдат.
Может она навечно продлить свое правление с помощью принудительной инженерии? Что остановит тоталитарный режим от создания армии модифицированных суперсолдат?
Ведь это в теории возможно. Сценарии вроде этого лежат в далеком будущем, если они вообще возможны, но подтверждение работоспособности концепции такой инженерии уже существует. Технология и правда настолько могущественна.
Подобное может стать поводом для запрета инженерии и связанных с ней исследований, но это определенно было бы ошибкой. Запрет на генную инженерию человека только приведёт науку в области с такими правилами и законами, с которыми нам было бы не по себе. Только участвуя в процессе, мы сможем быть уверены, что исследование ведется с осторожностью, разумом, контролем и прозрачностью.

Мы можем исследовать и внедрять в человека любые генные модификации.
Заключение
Чувствуете беспокойство? Почти в каждом из нас есть какое-то несовершенство. Позволили бы нам существовать в подобном новом мире? Технология несколько устрашает, но нам есть что выиграть, да и генная инженерия может быть очередной ступенью в эволюции разумных видов жизни.
Возможно мы покончим с болезнями, увеличим продолжительность жизни на века и отправимся к звездам. Не стоит мелко мыслить, говоря о такой теме. Каким бы ни было ваше мнение о генной инженерии, будущее наступает несмотря ни на что.
То, что раньше было научной фантастикой, вскоре станет нашей новой реальностью.
Реальностью, полной возможностей и препятствий.
Вы можете также посмотреть непосредственно само видео:
Источник: Kurzgesagt
Перевод: Amara.org
Смотрите также на Зожнике:
Карма — новые деньги
9 шагов на пути к вечной жизни. Наука о том, как дожить до бессмертия
Джейн Фонда о революции долголетия
Рэй Курцвейл: «Будьте готовы к гибридному мышлению»
9 самых странных секретов долголетия от тех, кто прожил более 100 лет
zozhnik.ru
Проведена первая модификация генов у людей
Команда китайских ученых из Сычуанского университета первой в мире ввела в организм пациента клетки, гены которых были модифицированы с помощью CRISPR-Cas9. Похоже, началась новая эра в биомедицине.
Во время первого эксперимента пациенту ввели модифицированные клетки его собственной иммунной системы, чтобы те более эффективно боролись с раковыми клетками. Китайский эксперимент может означать старт настоящей международной гонки по применению техники модификации генов по всем миру.
Технология CRISPR-Cas9 — это ДНК-конструкт, который можно ввести в любой организм — в данном случае, в клетку иммунной системы, чтобы модифицировать геном данного организма. Технология работает в три этапа: сначала последовательность РНК прокладывает путь конструкту CRISPR к требуемой части ДНК, затем энзим Cas9 «вырезает» этот сегмент, после чего возможно вставить новую последовательность ДНК вместо удаленного сегмента генома. В случае китайского эксперимента ученые осуществили только две стадии. Они извлекли иммунные клетки у пациента, больного раком легких с метастазами, а потом удалили из клеток генный код, благодаря которому производится белок PD-1. Он останавливает или замедляет реакцию иммунной системы, и раковые клетки могут им воспользоваться, чтобы тело не реагировало на заболевание в полную силу.
После удаления белка клетки культивировали, чтобы увеличить их количество, а затем ввели обратно пациенту. Это первая инъекция из двух, после чего настанет очередь еще девяти пациентов, для которых запланировано от двух до четыре инъекций модифицированных клеток, в зависимости от состояния больных.
Как китайский эксперимент, так и грядущий американский (запланированный на начало 2017 года) — в ходе которого иммунные клетки 18 пациентов не только лишат белка PD-1, но и добавят туда белок, который напротив помогает выискивать раковые клетки — направлены на то, чтобы проверить безопасность лечения с помощью CRISPR, а не на излечение как таковое. Если не последует осложнений, то масштабы вмешательства значительно увеличат, и новая техника может полностью заменить текущее лечение, в ходе которого PD-1 нейтрализуют с помощью антител.
На наших глазах развивается кардинально новая форма медицины, и насколько она изменит человека, покажет только время.
www.popmech.ru
Модификации человека
Генетические технологии в конце 20 – начале 21 века прочно вошли в медицинскую практику. «Человечество с надеждой смотрит на генетику, которая, используя свои открытия, может изменить судьбу современников и потомков, дав им лучшее предопределение. …В историческом ракурсе генетика — это фермент, ускоряющий физическое и нравственное совершенствование человечества, и поэтому она останется «становым хребтом» цивилизации XXI в.»[1]. Генетическая диагностика и консультирование стали одним из видов медицинской помощи. Разрабатываются технологии генной терапии и инженерии. В области современных генетических технологий доминирует тенденция к разработке технологий, позволяющих конструировать, видоизменять биологическую природу человека, в частности, технологий генетического модифицирования организмов и животных, генная терапия, клонирование животных.
В ходе научных разработок и применения генных технологий выявился ряд серьезных этических проблем, связанных с вмешательством в механизмы сохранения разнообразных форм жизни на Земле, прежде всего – жизни человека.
На Третьем Московском международном конгрессе «Биотехнология: состояние и перспективы развития» (2005) Представитель Общего директората научных исследований Европейского Союза д-р М. Халлен отметил, что в последние 5-6 лет произошел прорыв в области изучения генома: расшифрован геном человека, многих млекопитающих и растений. Больших успехов в Европе достигли и такие отрасли биологии, как нанобиотехнология, создание биосенсоров и системная биология. Основное направление сегодняшних исследований европейских ученых в молекулярной генетике — использование геномных технологий для лечения онкологических заболеваний, СПИДа, малярии и туберкулеза.
Многие вопросы этих проблем нашли свои ответы в международных и отечественных этико-правовых документах. Свою позицию по этическим проблемам применения генных технологий выразили представители ряда религиозных конфессий. Но многие вопросы еще не нашли однозначных решений и являются предметом дискуссий.
В настоящее время в области разработки и использования генных технологий существует ряд проблем, вызывающих этические опасения. Это проблема использования генных технологий для улучшения природы человека; проблема доступа различных слоев населения к возможности их использования; проблема генетического скрининга населения и генетической паспортизации населения; проблема сохранения тайны генетической информации; проблема коммерциализации процесса использования генетической информации и генных технологий; проблемы научных исследований в области разработки и совершенствования генных технологий; проблемы трансгенных растений и животных.
Область этических проблем, возникших в связи с развитием генетики, обусловлена рядом причин. Со времен античных философов в западноевропейской культуре утвердилась идея о том, что природа человека несовершенна и предназначение человека в том, чтобы использовать все свои силы и возможности для устранения этого несовершенства. Одним из таких «несовершенств» была признана смертность человека. На протяжении многих столетий человечество искало средства удлинения сроков жизни человека, стремилось найти «элексир молодости», средство, позволяющее стать бессмертным. Здоровье, долголетие (или бессмертие), высокий интеллект и разнообразные таланты, телесная красота человека стали благими целями в научных исследованиях, в том числе и в области генетики.
Это создало моральные основания для признания вмешательств в биологическую, в том числе и генетическую природу человека допустимым. В конце 20 в. активно исследовалась проблема степени генетической обусловленности поведения человека, в том числе его интеллекта, характера, способностей и т.д. К началу 21в. выделяется проблема возможности «создания» человека с «откорректированным» генетическим кодом.
В настоящее время появились научные знания и технологии, которые могут быть использованы для устранения ряда этих «несовершенств». В связи с этим возникают проблемы морально допустимых границ, условий и критериев применения генных технологий, т.е. в какой степени, при каких условиях и с какой целью могут быть применены те или иные генные технологии.
Исследования в рамках международного проекта «Геном человека» стали знаменательным этапом в области генетических исследований и разработки генных технологий. Работы по реализации этого проекта шли во многих странах мира – США, Японии, Канаде, России и других странах Европейского Союза. В США они начались в 1990 году под руководством лауреата Нобелевской премии Джеймса Уотсона. В 2002 г. проект был завершен.
Цель проекта состояла в описании нуклеотидных последовательностей ДНК всех хромосом человека. В результате исследований в рамках проекта «Геном человека» была составлена полная карта генома человека. В настоящее время идут исследования по изучению локализации в ней всех генов. С каждым годом открывается все больше генов, ответственных за возникновение конкретных заболеваний или предрасполагающих к ним. В настоящее время обнаружены и секвентированы гены, ответственные за ожирение, эпилепсию, слепоту, высокое артериальное давление, астму, остеопороз, меланому, регуляцию роста, артрит, рак груди и яичников, сердечно-сосудистые заболевания и болезнь Паркинсона. Установлена генетическая основа многих психических заболеваний, таких как аутизм, аффективные расстройства, шизофрения и другие. Однако, методы коррекции генетической патологии еще полностью не выработаны. «Человечество получило только каталог содержимого клетки, но не инструкцию, как им воспользоваться — библиотека пока закрыта» [2].
Идея генетического усовершенствования человека предполагает, что биологические признаки могут быть зафиксированы, определены их количественные параметры, и они могут программироваться. С этими вопросами неразрывно связаны вопросы определения нормы и отклонений от нее, как в лучшую, так и в худшую сторону. В настоящее время существуют нормы не только для биологических процессов, протекающих в организме человека, но и для интеллектуального, психического, социального и культурного развития. Отклонения от таких норм неизбежно вызывают желание «что-то исправить» в человеке. Идеи модификации человека путем коррекции его генетического аппарата актуализировали идеи евгенической концепции.
Наибольшего развития идеи «улучшения качества природы человека» достигли в рамках евгеники. Различные евгенические идеи высказываются многими современными учеными.
 Евгеника – этот термин был предложен в 1883 году Френсисом Гальтоном для обозначения науки «улучшения человеческой расы путем более совершенного скрещивания». По его мнению, евгеника призвана разрабатывать методы социального контроля, которые могут исправить или улучшить расовые физические и интеллектуальные качества будущих поколений. Ф. Гальтон считал, что по наследству передаются все характеристики человека, включая моральные качества личности. По его мнению, в идеале можно вывести желательный «темперамент, характер и способности» в качестве видового признака, как это делают с собаками, и избавить человечество от менее желательных признаков, таких, как «склонность к пьянству», «склонность к преступлениям», «праздность», «склонность к нищенству», «неумелость». Он верил, что высшую человеческую расу можно вывести путем скрещивания и селекции [3].
Евгеника – этот термин был предложен в 1883 году Френсисом Гальтоном для обозначения науки «улучшения человеческой расы путем более совершенного скрещивания». По его мнению, евгеника призвана разрабатывать методы социального контроля, которые могут исправить или улучшить расовые физические и интеллектуальные качества будущих поколений. Ф. Гальтон считал, что по наследству передаются все характеристики человека, включая моральные качества личности. По его мнению, в идеале можно вывести желательный «темперамент, характер и способности» в качестве видового признака, как это делают с собаками, и избавить человечество от менее желательных признаков, таких, как «склонность к пьянству», «склонность к преступлениям», «праздность», «склонность к нищенству», «неумелость». Он верил, что высшую человеческую расу можно вывести путем скрещивания и селекции [3].
По мнению сторонников евгеники, общество за счет развития медицины, социальной поддержки инвалидов и других «искусственных» мер улучшения качества жизни ослабило действие естественного отбора, в результате чего возникла опасность вырождения наций. «Субнормальные» индивиды, участвуя в размножении, «засоряют» так называемый «генофонд нации» недоброкачественными генами. Евгенические методы направлены на то, чтобы остановить генетическое вырождение населения.
В евгенике существуют два направления — негативная евгеника и позитивная евгеника.
Негативная евгеника должна приостановить передачу по наследству «субнормальных» генов, т.е. предотвратить наследование генетических особенностей алкоголиков, преступников, психически больных людей, гомосексуалистов и т.д. В качестве методов негативной евгеники в первой половине 20 века широко использовалась принудительная стерилизация. Например, первый закон о принудительной стерилизации по генетическим показаниям был принят в США в штате Индиана в 1907 году, а затем еще почти в 30 штатах. Всего до Второй мировой войны было зарегистрировано в США около 50 тыс. случаев принудительной стерилизации.
Негативная евгеническая политика ярко проявилась в нацистской Германии, где возобладала идея создания идеальной арийской расы. В соответствии с этим использовались все методы предотвращения распространения нежелательных генов, среди которых преобладали насильственная стерилизация и физическое уничтожение носителей этих генов. «Есть люди, желающие убедить себя в том, что они лучше своих собратьев либо как личности, либо как члены класса или расы. Простейшая уловка — утверждать, что их превосходство генетическое. Другие справедливо отрицают существование таких вещей, как генетическое превосходство или неполноценность, но, к сожалению, заходят слишком далеко и попадают в объятия мифа о tabula rasa»», — писал 25 лет назад выдающийся американский генетик и эволюционист Ф. Г. Добжанский [4].
Позитивная евгеника ставит своей задачей обеспечить преимущества (например, финансовые) для воспроизводства людей, в наибольшей степени имеющих какие-либо ценные для общества качества.
Это может достигаться несколькими путями: создание в обществе условий для воспроизводства «наиболее ценных» его представителей; отбор и дальнейшей использование для репродукции половых клеток и эмбрионов людей, имеющих нужные качества; манипулирование с геномом на уровне гамет и эмбрионов. Каждый из этих методов имеет свои этико-правовые особенности и уровень применения. Так, создание благоприятных условий для жизни и естественной репродукции «наиболее ценных» в каком-либо отношении людей стало фактически традицией в истории человеческого общества. Люди, проявившие себя в какой-либо общественно-полезной деятельности (научной, политической, экономической, духовной, спортивной, военной и т.д.), в подавляющем большинстве случаев имеют лучшие условия своей жизни, чем остальные граждане государства. Это затрагивает вопросы социальной справедливости, прав и достоинств личности, но в области социально-политической жизни общества на протяжении многих веков существовала и продолжает существовать такая практика.
«Селекция» половых клеток и эмбрионов по различным признакам, прежде всего, наличию аномалий в геноме, является элементом генетических и репродуктивных технологии и осуществляется в ходе генетической диагностики. Разнообразные методы медико-генетической диагностики являются своеобразной формой реализации евгенических идей. В настоящее время методы генетической диагностики позволяют получить информацию о наличии этих аномалий и предотвратить рождение детей с аномальной наследственностью. Это означает, что потенциальные родители могут использовать методы предохранения от беременности, сознательно согласиться на риск зарождения ребенка с вероятностью прерывания беременности по генетическим показаниям, отказаться от рождения своего ребенка и усыновить чужого, использовать технологию искусственного оплодотворения донорскими клетками. Все эти технологии оказывают, в конечном счете, влияние на качественные характеристики генофонда общества. Но методы генетической диагностики имеют и различный морально-этический статус – от однозначно морально осуждаемых до безусловно морально приемлемых.
В настоящее время допустимые методы влияния на механизмы наследственности человека используются после генетического консультирования и диагностики.
Медико-генетическое консультирование – это вид медицинской помощи населению, направленной на профилактику наследственных болезней, который оказывается в медико-генети-ческих консультациях и специализированных научно-исследова-тельских медицинских институтах. Оно представляет собой обмен информацией между врачом и будущими родителями, а также людьми, поражёнными болезнью, или их родственниками по вопросу о возможности проявления или повторения в семье наследственного заболевания. Главная его цель заключается в предупреждении рождения больного ребёнка.
Основными задачами медико-генетического консультирования являются определение прогноза в отношении будущего потомства в семьях, где имеется больной с наследственной патологией или предполагается рождение ребенка с такой патологией; уточнение диагноза наследственного заболевания с помощью специальных генетических методов исследования; объяснение обратившимся за консультацией в доступной форме смысла медико-генетического заключения и помощь в принятии правильного решения относительно дальнейшего планирования семьи; пропаганда медико-генетических знаний.
Генетическая диагностика осуществляется на различных стадиях жизни организма человека в форме предымплантационной и пренатальной диагностики, а также ДНК-диагностики человека (с рождения до конца жизни). В каждом случае возникают свои этические проблемы.
Предымплантационная диагностика проводится в процессе использования технологии экстракорпорального оплодотворения и позволяет осуществить отбор «генетически здоровых» эмбрионов до их в процедуре переноса эмбриона в полость матки.
Метод предымплантационной генетической диагностики, разработанный в Институте репродуктивной генетики в Чикаго группой ученых под руководством доктора Ю. Верлинского, предполагает проведение генетического анализа ДНК одной из клеток зародыша, полученного методом искусственного оплодотворения in vitro, достигшего в развитии стадии 8 клеток и еще не имплантированного в полость матки. При отсутствии патологического гена зародыш переносится в полость матки и продолжает свое развитие. При ее наличии эмбрион уничтожается и это вызывает ряд этических возражений, обусловленных неопределенностью статуса эмбриона.
Пренатальная диагностика – это генетическая диагностика на этапе внутриутробного развития человека с целью выявления имеющейся генетической патологии или генетической предрасположенности к возникновению в будущем заболеваний, значительно изменяющих качество жизни человека. Она неизбежно влечет за собой обсуждение вопроса о целесообразности продолжения беременности.
В данном случае этической проблемой становится право лишения жизни потенциального человека, имеющего несоответствующий норме «уровень здоровья». Аборт здесь становится средством избавления родителей от забот о жизни и здоровье изначально больного ребенка. Но эта проблема имеет и более широкий смысл, связанный с осмыслением отношения общества к людям с ограниченными возможностями (инвалидам) и неизлечимо больным. Утилитаристские идеи резко противоречат гуманистическим: «неизлечимо больные и инвалиды – это балласт общества, на который напрасно расходуются материальные средства» — «каждый человек имеет право на жизнь, уважение его личности». Еще одна моральная сторона роли инвалидов и неизлечимо больных людей в обществе состоит в том, что их жизнь является основанием для проявления альтруизма, милосердия, человеколюбия – человечности в широком смысле слова.
Расширение применения методов пренатальной генетической диагностики с целью заботы о здоровье человека ведет к изменению содержания понятия здоровье, которое становится тождественным понятию «генетическая норма». Следствием этого становится приемлемость идей евгеники о целесообразности «селекции» наиболее ценных для общества индивидов.
ДНК – диагностика человека на различных этапах его жизни применяется с целью выявления генетической обусловленности имеющегося заболевания, а также при анализе органов и тканей, предназначенных для трансплантации.
Использование ДНК-диагностики позволяет выявить наличие заболеваний, вызванных генетической патологией, и предрасположенность к ряду соматических и психических заболеваний. Выявление предрасположенности к развитию того или иного заболевания позволяет принять соответствующие профилактические меры. Она затрагивает область жизненных ценностей и стратегий поведения только одного человека, который принимает решение о том, как использовать полученную им информацию о собственном здоровье.
При генетической диагностике ДНК взрослого человека на первый план выходит проблема сохранения тайны медицинской информации и проблемы использования полученной генетической информации. Возможности современных генетических технологий, позволяющих получать информацию об имеющихся у человека аномалиях генетического аппарата и связанной с этим вероятности развития того или иного заболевания, ставят вопрос о необходимости и желательности для пациента этой информации. Этот вопрос является частью более широкого этико-философского вопроса о желательности для человека знания своего будущего, особенно неприятного. Хочет ли человек знать, что он неизбежно заболеет и какой именно болезнью? Хочет ли человек знать время своей смерти? Эти вопросы имеют большое значение для понимания потребностей людей в тех или иных биомедицинских технологиях и организации их применения на практике. В реальной жизни человек в подавляющем большинстве случаев подвергается медико-генети-ческому обследованию в соответствии со своим добровольным, осознанным решением, т.е. желая получить эту информацию о себе.
Медико-генетическое консультирование и диагностика проводятся в соответствии с принципами добровольного информированного согласия, с обязательным соблюдением правила конфиденциальности.
Массовое обследование (скрининг) населения. С появлением пренатальной диагностики стал возможен скрининг популяций, характеризующихся высокими частотами тех или иных наследственных заболеваний. Скрининг позволяет выявить супружеские пары с высокой степенью риска и контролировать каждое их зачатие, исследуя развивающийся плод. Так, например, выявляют серповидноклеточную анемию, часто встречающуюся у выходцев из Западной Африки. Это имеет большое значение для охраны здоровья граждан государства.
Генная терапия. Генетические технологии нацелены, прежде всего, на то, чтобы оказывать терапевтическое воздействие на организм человека при генетических заболеваниях, особенно тяжело протекающих, инвалидизирующих его. Генная терапия представляет собой новый метод лечения генетически обусловленных заболеваний, основанный на замене гена, ответственного за заболевание, «здоровым» геном. Целью генной терапии является «исправление» деятельности генов, которые вызывают или способствуют развитию конкретных заболеваний или патологических состояний. Несмотря на то, что первые исследования в этой области начались в 1990 г., генотерапия остается сугубо экспериментальной процедурой, далекой от широкого внедрения в медицинскую практику[5].
Генная терапия осуществляется в двух формах: соматическая генная терапия и зародышевая генная терапия.
Соматическая генная терапия представляет собой такое вмешательство в генетический аппарат человека, в результате которого приобретенные свойства проявляются на клеточном уровне и не передаются по наследству. Этот вид терапии разрешен во всех странах мира, владеющих данной технологией.
Зародышевая генная терапия предполагает вмешательство в генетический аппарат эмбриона на различных стадиях его развития. Этот вид генной терапии находится в настоящее время на стадии научных исследований и разработок. По мнению многих исследователей, он представляет опасность неизвестных, непрогнозируемых при помощи средств современной науки последствий не только для развития самого человека, но и отдаленных последствий для его потомства.
Многие специалисты отмечают, что граница между генной терапией и позитивной евгеникой трудно определима. Д. Нейсбит считает, что по мере того, как пренатальная генная терапия станет усложняться и совершенствоваться, родители почувствуют искушение не допускать никакого отставания своих детей от нормы. Активное использование генной терапии может привести к изменению социокультурных и медико-биологических норм – норм анатомо-физиологических, психологических, эстетических, моральных и др.
Генная инженерия является направлением современной науки, в котором разрабатываются технологии кардинального изменения и конструирования генетического аппарата человека и других живых организмов.
В 2001 году были опубликованы сообщения о первых «генетически модифицированных» детях, появившихся в результате использования генных технологий для лечения бесплодия женщин, вызванного наследственными факторами.
В настоящее время уже имеется первый опыт получения детей с заранее заданными генетическими параметрами. В институте репродуктивной генетики в Чикаго по просьбе родителей и с использованием методов предымплантационной генетической диагностики были «произведены» дети. Особенности будущих детей были заданы в соответствии с очень благородными, гуманными целями – спасение жизни ранее рожденных, но страдающих смертельно опасными заболеваниями детей. Один ребенок должен был стать наиболее подходящим донором костного мозга для своей старшей сестры, страдающей смертельной формой анемии, другие дети своими клетками могли бы помочь при лечении лейкемии и талассемии [6].
Специалисты по биоэтике, ученые и представители религии обращают внимание на опасность распространения «конструирования» детей родителями в соответствии с желательными для них признаками, причем речь идет о выборе не только анатомо-физио-логических параметров, но и задатках определенных способностей, типе темперамента и т.д.
Возможности генетического «модифицирования» человека неизбежно приводят к вопросу об ответственности за подобные манипуляции. Современный биолог У. Френч Андерсон считает: «Мы так мало знаем о человеческом организме! Но мы знаем и так мало и о сути самой жизни, что нам не стоит применять генную инженерию для улучшения чего бы то ни было. Наш долг – с максимальным чувством ответственности войти в эру генной инженерии. И это означает, что нам следует использовать эту мощную технологию только для лечения и не применять ее для других целей» [7].
Большинство специалистов в области этических проблем генных технологий сходятся во мнении, что «уникальность жизни каждого отдельного человека и ценности каждого человеческого существа должны исключать генетические улучшения»[8].
Проблема доступа различных слоев населения к возможности использования генных технологий является частным случаем проблемы социальной справедливости в области современной биомедицины. Общепризнано существование неравенства различных слоев населения в доступе к новым биотехнологиям, которое определяется преимущественно экономическими и социально-политическими факторами. Известно, чем более наукоемким, технологически сложным и соответственно дорогим по материальным затратам является лечебно-диагностический метод, тем меньшему количеству людей он доступен.
В настоящее время медико-генетическое консультирование стало доступно практически всем желающим и нуждающимся в нем. Методы генной терапии продолжают оставаться на стадии научных исследований и разработок и применяются очень избирательно. Генная инженерия – область определения возможностей использования генных технологий для модификаций организма человека.
Проблема использования генетической информации становится все более актуальной по мере расширения использования генетической диагностики и консультирования. Кому должна предоставляться информация генетического обследования человека? Только ему самому или его родственники тоже имеет право на ее получение? Имеет ли право работодатель, страховщик или иные представители общества знать информацию об особенностях генома человека? Как человек может использовать эту информацию? Правомочно ли создание «банков генетической информации» и введение «генетической паспортизации»? Несмотря на этическую спорность многих из этих вопросов и их правовую неопределенность, многое уже имеет место в жизни современного общества.
В нашей стране вопросы использования генетической информации решаются в соответствии со статьями 30 (п.6) («Права пациента»), 31 («Право граждан на информацию о состоянии здоровья») и 61 («Врачебная тайна»).
Врачебную тайну составляет не только информация, полученная в процессе генетической диагностики и консультирования, но и факт обращения в медицинское учреждение, предоставляющее услуги по генетической диагностике и консультированию. Пациент имеет право получить информацию о результатах ДНК-диагностики, наличии заболевания, прогнозе и методах лечения в доступной для него форме, также как и в других случаях обращения за медицинской помощью. Необходимым предварительным условием любого вмешательства в геном человека, как и других медицинских вмешательств, является информированное добровольное согласие гражданина. Данное условие оказывается трудно выполнимым в случаях, когда речь идет о пренатальной и предымплантационной диагностике, причем согласие от родителей, родственников или доверенных лиц не может считаться в полной мере правомочным, поскольку окончательно не определен ни моральный, ни правовой статус человеческого эмбриона.
Американский микробиолог, профессор М.Л. Сильвер считает, что когда генетические репродуктивные технологии сделаются коммерчески доступными и начнут неравномерно распределяться среди населения, эта технология (примерно через триста лет) создаст подвид людей («натуралов»), неспособных к спариванию с генетически улучшенными представителями человеческого рода [9].
В США дискриминация, основанная на генетической информации, уже существует сегодня в страховом деле и на рынке труда. Активными сторонниками идентификации ДНК являются правоохранительные организации В тридцати двух штатах США ФБР уже создало новую национальную базу данных по генетической информации, получившую название Национальный ДНК-идентифика-ционный индекс, в котором содержатся ДНК-профили осужденных преступников. В настоящее время во многих американских корпорациях вошло в практику получение генетической информации о своих потенциальных и работающих сотрудниках.
Проблема использования генетической информации в развитых странах приводит к противоречию в области предоставления медицинских услуг населения. Д. Нейсбит отмечает, что в то время как ученые генетики учатся идентифицировать и лечить определенные наследственные заболевания, страховые компании используют ту же самую информацию для того, чтобы отказать в медицинском страховании этих заболеваний [10].
«Неприемлемый генетический профиль», «человек с высоким генетическим риском», «фактор ранней заболеваемости» — это речевые обороты, в которых отражается тенденция разделения людей по признаку качества его генетической информации, тенденция к дискриминации людей по генетическим признакам.
Проблема коммерциализации области применения генных технологий и использования генетической информации. Генетическая информация стала в современном обществе товаром. Товарные свойства проявляются, начиная с этапа научных исследований и последующего процесса ее перехода в область научного знания общества. В области генетических исследований наиболее явно это проявилось при проведении исследований в рамках программы «Геном человека», которая с одной стороны потребовала значительных материальных вложений, с другой стороны поставила вопрос о правомерности патентования полученной информации. «Одна из фармацевтических фирм, принимавшая участие в проекте «Геном человека», попыталась запатентовать наиболее нестабильные гены человека с тем, чтобы в дальнейшем иметь эксклюзивное право на их «ремонт». После отказа фирма обратилась с иском в высшую судебную инстанцию США, откуда последовал мудрый ответ: «Человек не может патентовать то, что создано Богом и Природой» [11].
Например, американский Университет Дьюка имеет патент за получение гена болезни Альцгеймера, фирма «Герон» получила исключительную лицензию на ген клеточного бессмертия, компания «Миллениум фармасьютикалс» имеет патент на ген ожирения. За патентованием, как правило, следует выдача фирме, разрабатывающей соответствующее терапевтическое средство, лицензии на свои патенты с правом на процент прибыли от продаж разработанного средства. Получение информации в процессе медико-генетического консультирования также определяет статус информации как товара, за которую платит клиент организации, которая осуществляет консультирование.
Проблема сохранения тайны генетической информации является актуальной этико-правовой проблемой в связи с тем, что в современном обществе все большее признание находит право человека на сохранение в тайне информации, касающейся его личности, принцип уважения прав и достоинства личности, а генетическая информация затрагивает все области жизнедеятельности человека – от физического здоровья до реализации его прав и свобод в обществе. Образцы ДНК являются более значимыми сведениями о человеке, чем отпечатки пальцев или традиционные медицинские данные. ДНК, имеющаяся в базе данных в настоящее время позволяет идентифицировать 4000 генетических маркеров, определяющих предрасположенность к некоторым психическим, эндокринологическим, онкологическим заболеваниям, склонность к алкоголизму и т.д.
При создании банков генетической информации о представителях тех или иных групп населения возникает опасность ее неправомерного использования, что может привести к различным видам дискриминации этих групп населения.
Этические проблемы создания трансгенных растений и животных возникли в результате широкого использования методов генной инженерии в области улучшения качества растений и животных, которые используются человеком в его жизнедеятельности. Трансгенные организмы являются продуктом деятельности человека по генетической модификации исходных природных организмов путем переноса генов организма одного вида другому.
Достаточно хорошо отработаны методы переноса чужеродных генов для домашних животных. Таких животных создают с целью получения в больших количествах белков, имеющих применение в медицине. Проводятся эксперименты по получению вида кошек, шерсть которых была бы лишена белка, вызывающего аллергию. В 2001 году исследователи Орегонского центра изучения приматов (США) сообщили о создании тренсгенной обезьяны [12].
Создание и использование человеком трансгенных организмов, особенно в качестве пищевых продуктов, вызывает у специалистов большие опасения в связи с недостаточной изученностью их влияния на здоровье человека. Использование трансгенных продуктов является по сути, внедрением в практику научных разработок, безопасность которых научно недостаточно обоснована.
Проблема статуса индивидуального генетического фонда. Индивидуальный генетический фонд – это компонент уникальной соматической индивидуальности и идентичности человека. Влияние генома на соматическую сферу не однозначно и не исчерпывается простыми причинно-следственными связями, оно лишь элемент в системе разнообразных влияний. Генетическая природа определяет границы и рамки развития, но не его качественное содержание. Это неоднократно подтверждено в исследованиях однояйцевых близнецов. Индивидуальный геном человека задает границы природного бытия человека, его деятельностный потенциал. «С точки зрения взаимосвязи личности и природы следует констатировать, что охрана индивидуального генофонда, обусловленная достоинством человека, относится, с одной стороны, к личности как субъекту нравственности, а с другой стороны к природным условиям начала и развития личностного бытия» [13]. При этом индивидуальный генетический фонд и его воздействие на развитие человека – это часть природных условий начала и развития личностного бытия. Следовательно, индивидуальный генофонд нуждается в особой охране. В данном случае принцип уважения личности проявляется как уважение к индивидуальному геному человека. «Чем более генофонд определяет и обусловливает развитие природных задатков личности, чем основательнее проявляются эти условия в формировании и становлении личности, тем более он нуждается в охране, которая касается именно природных задатков личностного бытия и опирается на достоинство личности» [14]. В соответствии с принципом уважения личности в области генетических технологий запрещено то, что представляет собой угрозу субъектным качествам человека.
Клопфер М. и Кольбе А. выделяют четыре принципа отношения к генофонду человека: принцип сохранности генетических условий зарождения жизни, принцип сохранности генетических условий свободного развития личностных качеств, принцип сохранности информационного самоопределения личности, принцип сохранности равенства в отношении условий работы с генофондом.
Следование принципу сохранности генетических условий зарождения жизни приводит к выводу о том, что манипуляции с геномом, которые определяют генетические условия зарождения жизни, исключают или значительно ограничивают самостоятельное жизненное целеполагание личности, которое предписано ему его достоинством, и должны быть полностью отвергнуты. Таким образом, образование гибридов, любые формы евгеники, клонирование оказываются абсолютно недопустимыми.
Принцип сохранности генетических условий свободного развития личностных качеств вытекает из уважения субъекта и индивидуального генома. В соответствии с этим принципом требуется защита генетических условий развития личностного бытия. Следование этому принципу приводит к выводу о необходимости ограничения условий проведения даже соматической генотерапии. В случае зародышевой генотерапии нарушается не только право человека на самоопределение, но и право на «естественное развитие собственного зародыша».
Принцип сохранности информационного самоопределения личности вытекает из учета права человека на зн
sidlife.ru
Модификация человеческих генов — это почти реальность / Habr
 Главный редактор MIT Technology Review Антонио Регаладо пообщался с сотрудниками Гарвардской медицинской школы, которые специализируются на разработке способов генных модификаций. Главный вывод, к которому он пришёл, таков: вмешательство в ДНК человека — это уже скорее вопрос этики, чем научная проблема. Какие вмешательства допустимы и к чему они могут привести? Готово ли общество к тому, что человека можно будет конструировать ещё до его рождения? И как скоро сюжет фильма «Гаттака» станет обыденной реальностью?
Главный редактор MIT Technology Review Антонио Регаладо пообщался с сотрудниками Гарвардской медицинской школы, которые специализируются на разработке способов генных модификаций. Главный вывод, к которому он пришёл, таков: вмешательство в ДНК человека — это уже скорее вопрос этики, чем научная проблема. Какие вмешательства допустимы и к чему они могут привести? Готово ли общество к тому, что человека можно будет конструировать ещё до его рождения? И как скоро сюжет фильма «Гаттака» станет обыденной реальностью?Молодой сотрудник Гарварда доктор Лухан Янг (Luhan Yang), одна из ключевых фигур в разработке метода генетической манипуляции CRISPR-Cas9, недавно основала биотехнологическую компанию, которая занимается изменением геномов крупного рогатого скота. Он говорит, что этот же метод может быть использован для модификации генов человека. Например, сейчас ничто не мешает учёным заменить дефектный ген, ответственный за появление у человека серповидно-клеточной анемии или болезни Альцгеймера.
Несмотря на имеющиеся недостатки, CRISPR уже успешно применяется не только для домашних животных, а и для приматов. Например, гены пары макак были изменены в прошлом году с целью регуляции их метаболизма и производства стволовых клеток. Обезьянки родились здоровыми, но для проверки успешности генной модификации должно пройти три года, прежде чем они достигнут половой зрелости. Сейчас, как говорят генетики Гарварда, в их распоряжении находятся примерно 20 эмбрионов обезьян, так что ожидаемое время таких же манипуляций с ДНК человека они оценивают в 10-20 лет.

Именно при помощи CRISPR-Cas9 совсем недавно группа учёных под руководством профессора института Солка (США) Хуана Бельмонте (Juan Carlos Izpisua Belmonte) провела успешный эксперимент по удалению фрагментов вируса иммунодефицита из ДНК человека. В вирусной ДНК были установлены специальные маркеры в виде молекул РНК, отмечающие фрагменты для удаления. Этот метод протестировали на лимфоцитах и прочих клетках иммунной системы, зараженных ВИЧ. Первая версия РНК-маркеров смогла удалить вирус и его следы в 72% клеток. Уничтожены были как «свежие» ДНК вируса, так и его «спящие» копии.
Недавнее социологическое исследование в США показало, что современное общество в целом готово к подобным манипуляциям. Взрослым задавали вопрос — согласны ли они на то, что с генами их ребёнка будет выполнена генетическая модификация с тем, чтобы он стал «умнее» и был бы менее подвержен серьёзным заболеваниям. Значительное число респондентов высказались положительно:
habr.com
Генетически модифицированные люди // Игорь Лалаянц ≪ Scisne?
Генетическое модифицирование человечества — совсем не новая опасность, генетические эксперименты над собой человечество ставило всегда. Гигантское генетическое разнообразие человеческих популяций — а человек ничем не хуже любого другого вида — всегда таило в себе множество рецессивных мутаций, никак не проявляющихся у большинства их гетерозиготных носителей. Человек может нормально жить с довольно большим количеством вредных аллелей в геноме — норма на одного человека — в среднем 3 — 4 летальные мутации, находящиеся в геноме в количестве всего одной копии, а потому не проявленные. Другое дело, если организм получает мутантный вариант гена от обоих родителей — такая мутация проявится обязательно. Но вероятность встречи двух носителей редкой мутации очень мала — вряд ли они познакомятся и поженятся, ведь выбор партнёров в современном обществе широк и становится всё шире.
Но так было далеко не всегда. Проще всего двум вредным копиям оказаться в одном геноме — это не искать партнёра далеко, а вступить в брак с родственником. Тогда вероятность для мутации оказаться у потомства в гомозиготе прямо пропорциональна степени родства жениха и невесты. Уходящие в глубь веков традиции экзогамии — выбора брачного партнёра из другого племени — отражают инстинктивное понимание человечеством опасности сочетания в одном генотипе двух мутантных копий одного и того же гена, это своего рода первые «правила техники безопасности» для генетических экспериментов.
Недаром люди издревле убоялись близкородственных браков. Ещё в пустыне Синайской Моисей среди своих заповедей провозгласил «не возжелай жены ближнего своего», поскольку в тесных сообществах того времени она могла оказаться если не родной, то двоюродной сестрой. А это было чревато тем, что во чреве та понесёт нежелательные генетические комбинации, которые приводят к самого разного рода неприятным последствиям для потомства.
Примером древнему миру служили египетские фараоны, которые женились на собственных сёстрах и дочерях. Династия за династией в долине Нила сменяли друг друга в силу генетического вырождения. Птолемеи, пришедшие в Египет вслед за Александром Македонским, тоже переняли этот обычай фараонов. Хватило всего лишь 15 поколений, чтобы мужская линия птолемеевской династии полностью деградировала, и венцом её стала прекрасная Клеопатра, сменившая Цезаря на Антония и последнего — на чёрного египетского аспида.
То же мы видим и в Европе. В своём великолепном романе «Рэгтайм» Э. Доктороу писал о путешествии финансового магната П. Моргана в Старый Свет: «В Европе он обедал с банкирами, премьерами и королями. В этой последней группе он отметил нарастающую деградацию. Они все переженились за долгие столетия и породили в своей новой генерации невежество и идиотизм». Заметим, что сам Морган страдал каким-то аутоиммунным заболеванием, в результате чего его нос превратился в большую «спелую» клубнику. Ещё Доктороу отмечал большой живот Моргана, написав затем, что избыточный вес впоследствии стал болезнью бедных (в силу потребления большого количества дешёвой и высококалорийной пищи)!
Нарушения аппетита, например, бывают самой разной природы. Известно, что принцесса Диана, столкнувшись со стрессами Букингемского дворца, который в самом начале июля открыл в Гайд-парке пруд в её честь, страдала попеременно то анорексией, то булимией, то есть полным отсутствием аппетита и состоянием, когда человек готов «быка сожрать». Отнюдь не все люди, однако, не могут справиться со своим аппетитом, только попав во дворец.
Аппетит вызывается нейропептидом Y («игрек»), который синтезируется в гипоталамусе, управляющем нашими основными инстинктами. Пептид называют ещё «орексигенным» от латинского «ор» — рот (отсюда такие слова, как «оральный» и «пероральный»). Его полным антагонистом является белковый гормон лептин, синтезируемый под «командой» инсулина адипоцитами, или клетками белой жировой ткани (подкожной клетчатки).
 Мышь без лептина перевешивает двух с нормальным геном |
Лептин был открыт 10 лет назад. На обложке журнала «Нейчур», увидевшего свет 1 декабря 1994 года, были показаны весы, на которых мутантная по гену лептина разожравшаяся мышь перевешивает двух обычных. Учёные назвали новый гормон, использовав греческое слово «лептос», — тонкий, изящный, красивый (оно входит в наши слова «лепота» и «великолепный», знаменитая лептонная оболочка, а также «лепта» — наименьшая медная греческая монетка).
Лептин легко проходит в мозг и поступает с кровотоком в гипоталамус, где и «гасит» аппетит, вызывая появление субъективного чувства насыщения. Так в норме регулируется потребление пищи. Однако при «выключении» гена лептина или его белкового рецептора на поверхности нейронов люди начинают страдать булимией, что приводит к ожирению, диабету, атеросклерозу и тому подобным мало приятным вещам.
Чревоугодие является седьмым смертным грехом. Люди всегда отрицательно относились к тем, кто неумерен в еде. Можно вспомнить вавилонского Молоха и Гаргантюа Франсуа Рабле, а также коварную Цирцею, которая пыталась с помощью обильной еды превратить спутников Одиссея в свиней.
Выше уже говорилось о пагубности близкородственных браков, резко повышающих вероятность «встречи» в геноме ребёнка двух мутантных генов родителей. Недаром основные нейропатии — такие как дальтонизм и паркинсонизм, а также хорея Гентингтона — описаны в Англии с её разрешёнными браками между кузинами и кузенами (кузенные браки). Не так давно журнал «Сайенс» описал паркинсонизм в двух больших семьях из Сицилии и центральной Италии (одна из них большое семейство Контурси), имеющих общие корни, а также в испанской семье с кузенными браками.
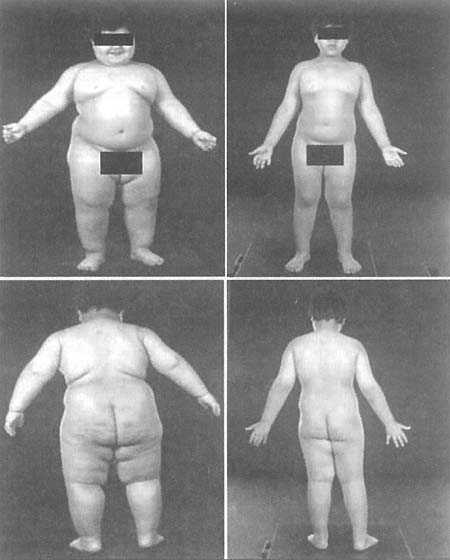 Американские дети турецкого происхождения, страдающие «безлептиновым» ожирением. Слева — до лечения. Справа — после введения в организм человеческого рекомбинаторного лептина. |
Болезнь возникла в результате мутации гена особого белка синуклеина, представляющей собой замену одной буквы ген-кода (в результате чего шедевр Л. Толстого превратился в «Война и мор»). В одном случае мутация привела к замене аминокислоты в белке, а в другом — к возникновению «стоп»-кодона, в результате чего в белке «недоставало» 150 аминокислот.
Но вернёмся к диабету II типа, возникающему на фоне «безлептинового» ожирения. У членов большой пакистанской семьи с кузенными браками мутация в гене лептина была представлена делецией — нехваткой цитозина (C) — буквы ген-кода в 399-м положении, в результате чего дальнейшее считывание гена пошло «наперекосяк».
Делеция — это выпадение одного или нескольких нуклеотидов. Для иллюстрации можно привести фразу «дом кино», которая в результате «делеции» букв превращается в «домино». Естественно, что смысл текста при этом нарушается. Нарушение генетического «текста» — это мутация, которая ведёт к нарушению кодируемого геном белка со всеми вытекающими последствиями в виде генетического заболевания.
В большой же турецкой семье мутация в гене лептина представляет собой замену цитозина в 315-м положении на тимин. Это изменение приводит к смене аминокислоты аргинин в 105-м положении от начала белковой цепи на триптофан, в результате чего лептин теряет свои биологические свойства. Излишне говорить, что подобные мутации в гене лептина, оказываясь из-за близкородственных браков в гомозиготном состоянии, не украшают жизнь своим носителям — такие люди полнеют буквально «от воздуха», а есть-то им хочется.
Люди встречаются, люди влюбляются, женятся
Так пел в далёкие теперь уже 70-е годы популярный певец из развалившейся как карточный домик Югославии. Никакие запреты не мешают близким родственникам вступать в кузенный брак, порождая генетически отягощённое или даже больное потомство. Некоторые такие «кузенные» патологии представлены в таблице. Страна показывает происхождение семьи, члены которой чаще всего проживают в США, Англии или других странах Европы, где и проводился генетический анализ.
Родословная алопеции в семье с близкородственными браками  |
Алопеция в данном случае означает «тотальное» облысение, при котором в результате полного отсутствия волосяных мешочков нет не только скальпа и бровей, но даже и ресниц.
Так выглядит лицо человека, страдающего тотальной алопецией. |
А нет их вследствие мутации в гене специфического транскрипционного фактора, который «запускает» считывание генов, отвечающих за формирование волосяных фолликулов.
Нечто похожее, но в менее выраженной степени происходит при короткопалости, или брадидактилии. Она выявлена в двух случаях в Германии. В одном примере мутантным оказался ген ВМР белка, участвующего в образовании кости, в другом же мутацией был затронут ген фермента тирозин-киназы (поясним в скобках, что фермент «кинирует», или переносит фосфорные группы на аминокислоту тирозин в других белках, чем и запускается сигнальный каскад, доходящий до ядра. В ядре пришедший сигнал активирует транскрипционные факторы генов-«мишеней», и клетка тем самым отвечает на внешний стимул).
Гемохроматоз представляет собой аномальное накопление железа в клетках и тканях, которое происходит при мутации в гене рецептора белка трансферина, переносящего железо. А гипогонадизм — это недоразвитие гонад, или половых желёз.
В приведённом конкретном случае у 21-летнего мужчины был вдвое уменьшен объём тестикулов и размер пениса, рост составляет всего лишь полтора метра, а плотность костей — как у 15-летнего подростка. У его сестры первая менструация случилась лишь в 16 лет. Генетическая патология вызвана мутацией в гене так называемого «релизера» — гормона, который стимулирует выделение-релизинг гормона гонадотропина, необходимого для развития гонад.
Близкородственный брак, приведший к клиническому проявлению гипогонадизма у потомков  |
Инфаркт довольно часто возникает в результате повышения свёртываемости крови, за что ответственен витамин K и его клеточный белок-рецептор. Мутация в этом рецепторе вызывает резистентность — сопротивляемость — к «разжижающему» кровь варфарину (производному кумарина), что и ведёт к повышению свёртываемости.
Далее речь идёт о микрогирии, или недоразвитию и «измельчению» извилин лобной и теменной коры. Происходит это при мутации в гене рецептора, который также участвует в передаче сигнала извне к ядру. Мутация другого гена приводит к недостаточному размеру всего мозга, то есть микроцефалии.
В этом случае изменение затрагивает ген ASPM — a-spindle mitosis, ответственный за нормальное деление клеток в митозе и мейозе. В результате этой мутации нервные стволовые клетки как бы «застывают» и дальше не делятся в силу отсутствия возможности «развести» хромосомы по полюсам. Естественно, что рост мозга затормаживается.
Катепсин C, ген которого мутирует при периодонтите, представляет собой фермент, расщепляющий белки в цитоплазме. Этот фермент крайне важен для функции макрофагов. Неудивительно, что мутация гена катепсина C проявляется в виде воспаления дёсен, утери зубов, артрита и повышенного кератоза стоп и ладоней.
Хорошо известно, что наша нервная система «перекрещена», поэтому при инсульте в правом полушарии отказывает левая половина тела и наоборот. Перекрёст осуществляется в эмбриональном состоянии с помощью белка ROBO (Roundabout). Это английское слово означает поворот за угол. Белок же RОВО привлекает на другую сторону растущие аксоны нейронов.
В 10 семьях разного происхождения при кузенных браках обнаружено 10 самых разных мутаций в гене указанного протеина, которые ведут, в частности, к ярко выраженному сколиозу и другим аномалиям развития нервной системы. Нечто подобное видно при выключении одного из генов мышиной модели сколиоза, что хорошо видно на иллюстрации «сопоставления».
Мутации в генах RP — хорошо известный офтальмологам «ретинитис пигментозум» (пигментозный ретинит) — и AIPL, кодирующем «интерактивный» протеин, взаимодействующий с арильным углеводородом (так расшифровывается аббревиатура), выявлены при кузенных браках в США, Голландии и в семье пакистанского происхождения.
Ещё один ген — NR отвечает за синтез ядерного («нуклеарного») рецептора, на который приходит сигнал через цитоплазму. При мутации в этом гене развивается ретинопатия, проявляющаяся в повышенной чувствительности колбочек сетчатки к коротковолновому синему свету, в результате чего люди теряют зрение к 20 годам.
Что делать?
Кто виноват — ясно. Это прежде всего люди, не желающие сдерживать свои сердечные порывы, чтобы не страдало их потомство. Однако всё не так просто. Раньше люди были вынуждены в силу обстоятельств вступать в близкородственные браки, пусть и в экстремальных ситуациях. Можно вспомнить библейский сюжет Лота с дочерьми, жена которого обратилась в соляной столп, оборотившись из женского любопытства, чтобы посмотреть на горящие в серном огне Содом и Гоморру.
Сейчас же выходцы из других стран оказываются в генетической изоляции, о чём писал в своём романе «Милый бо-пэр» венгерский писатель Тибор Дери: «За границей выходцы из одной нации лепятся обычно друг к другу, как слова хорошо написанной фразы; они полагают, что только вместе имеют какой-то смысл».
Можно вспомнить и тесный мирок пяти нью-йоркских мафиозных «семей», так хорошо описанный Марио Пьюзо в его «Крёстном отце». Всё это приводит к заключению кузенных браков, следствием чего являются описанные патологии.
При этом получается, что люди пусть и бессознательно, но активно модифицируют свои гены, превращаясь в ГМ-людей. Сегодня наука уже может в достаточном числе случаев поставить точный диагноз, что вселяет надежду на скорое нахождение соответствующих методов лечения путём «обратной» ген-модификации.
Но это в будущем. Сегодня же мы можем засвидетельствовать пока единственный пример успешного излечения генетической патологии в близкородственной семье. Речь идёт о членах семьи турецкого происхождения, проживающих в США, которые страдают от излишнего веса.
Открытие лептина, о чём говорилось в самом начале, позволило наладить его биотехнологическое производство. Специалисты Калифорнийского университета в Лос-Анджелесе в течение полутора лет делали инъекции человеческого рекомбинантного лептина членам этой семьи, страдающим от ожирения.
Клинические испытания прошли на ура (при введении долей или целых миллиграммов лептина на килограмм веса вес тела у таких людей сократился в 2 раза, что произошло главным образом за счёт «сжигания» подкожных запасов жира). Испытуемые стали проявлять значительно большую физическую активность, у них сам собой «разрешился» диабет II типа, наладились эндокринная функция и обмен, «исправилось» поведение и обратился вспять гипогонадизм.
Отчёт об успешных испытаниях лептина был опубликован журналом «Труды АН США» (PNAS). Вполне возможно, что им придётся вводить себе лептин так же, как и диабетики (колят) вводят себе инсулин. Хочется надеяться, что, излечившись, они расскажут своим детям о вреде постановки на себе опытов по ген-модификации.
И на Марсе будут яблони цвести
А вот это вряд ли, причём наше вечное пребывание в колыбели Земли обусловлено эволюцией, препятствующей межвидовому гибридизированию. А больше взять новые гены неоткуда, наши же собственные гены могут мутировать, однако чаще это неблагоприятные мутации, примеры которых приведены выше. Никаких ресурсов Земли не хватит для того, чтобы переправить в марсианские колонии, одна из которых показана в знаменитом фильме Арнольда Шварценнегера и Шарон Стоун «Вспомнить всё» (или «Полное восстановление памяти»), золотой миллиард людей. Да и вряд ли на нашей планете найдётся столько смельчаков и просто достаточно здоровых людей, чтобы перенести двухлетний перелёт (обратно корабль будет возвращаться целых пять лет!)
Но даже миллиард людей довольно быстро столкнётся с проблемой близкородственного скрещивания и кузенных браков. Поэтому в далёком антиутопическом будущем можно представить себе отдельные крайне малочисленные экспедиции к Красной планете, где вполне в духе футуристического фильма будут жить трёхгрудые девицы, но не более того. Ведь есть сменные «вахтовые» экспедиции в Антарктиде, но никому в здравом уме не придёт в голову идея создать на Южном полюсе производство и постоянные поселения при нём.
Гены наши, как выяснилось, крайне малочисленны, и крайне далеки они от нужд здорового народонаселения, потомство которого довольно быстро «портится» при «сближении» родителей ко-сангвиников, или сородичей по крови (от латинского «сангве» — кровь). Поэтому законодательства всех стран запрещают подобные браки.
Ведь об этом писал ещё Софокл в своей трагедии «Царь Эдип»:
Отцу — соложник сын и детям брат,
Что с матерью преступное общенье
и с ней детей рожу я
На отвращенье смертным племенам,
Я ль не порочней всех во Ойкумене?
«Знание-сила»
scisne.net
Американка стала первым в мире генетически модифицированным человеком. И все ради вечной молодости
Ребята, мы вкладываем душу в AdMe.ru. Cпасибо за то,
что открываете эту
красоту. Спасибо за вдохновение и мурашки.
Присоединяйтесь к нам в Facebook и ВКонтакте
Уже не раз художественные выдумки фантастов воплощались учеными в реальность. Телефон, подводная лодка, ракета и многое-многое другое. И вот снова идея фантастических романов обрела реальную основу — на этот раз в области генной инженерии. Вполне возможно, что мифический «источник молодости» найден, и это как раз заслуга генетиков. Ведь пока неизвестны точные механизмы старения, но доказано, что процессы увядания напрямую зависят от состояния теломер — концевых участков хромосом: чем они длиннее, тем дольше живет человек.
Директор BioViva USA Inc. Элизабет Пэрриш утверждает, что ее команда разработала новый метод, позволяющий быстро, эффективно и безопасно увеличить длину теломер. AdMe.ru за новые научные открытия, и поэтому мы хотим поделиться с вами новым прорывом в области генной терапии.
В 2016 году 45-летняя директор BioViva USA Inc. Элизабет Пэрриш (Elizabeth Parrish) утверждала, что успешно прошла курс генной терапии против старения. Терапия предполагала устранение двух основных эффектов от процесса старения: укорачивание теломер и потеря мышечной массы.
Теломеры — это участки хромосом, которые отвечают за количество делений клетки до ее уничтожения. Хотя длина теломер у каждого человека индивидуальна, рождается человек с длиной теломер 15–20 тыс. пар нуклеотидов, а умирает с длиной 5–7 тыс. Длина их постепенно уменьшается за счет процесса, называемого пределом Хейфлика, — это количество делений клеток, примерно равное 50. После этого в клетках начинается процесс старения. В ходе исследований выяснили, что ДНК может восстанавливаться за счет фермента теломераза, который взаимодействует с теломерами и «возвращает» их изначальную длину.
Процесс восстановления теломер на данный момент запускает модифицированная РНК, которая несет в себе ген обратной теломеразной транскриптазы (TERT). После того как РНК была введена в теломеру, она повышает активность теломеразы на 1−2 дня. За это время она активно удлиняет теломеры и после этого распадается. Полученные в итоге клетки ведут себя аналогично «молодым» и делятся во много раз интенсивнее, чем клетки контрольной группы.
Благодаря такому способу удалось удлинить теломеры более чем на 1 000 нуклеотидов, что примерно равно нескольким годам человеческой жизни. Этот процесс безопасен для здоровья и не приводит к ненужным модификациям и мутациям клеток, так как иммунная система не успевает отреагировать на введенную в организм РНК.
Лаборатория SpectraCell подтвердила, что успех терапии возможен. В 2015 году перед началом терапии у Элизабет взяли кровь на анализ: длина теломер лейкоцитов составила 6,71 тыс. пар нуклеотидов. В 2016 году после окончания терапии кровь Пэрриш снова взяли на анализ: длина теломер лейкоцитов увеличилась до 7,33 тыс. пар. И это означает, что лейкоциты крови испытуемой «помолодели» примерно на 10 лет. Процедуру Пэрриш проходила в Колумбии, поскольку в США такие эксперименты запрещены.
Результаты исследования были подтверждены двумя независимыми организациями — бельгийской некоммерческой организацией HEALES (HEalthy Life Extension Company) и британским Исследовательским фондом биогеронтологии (Biogerontology Research Foundation). Результаты пока не подвергались экспертным оценкам.
www.adme.ru
