Оксид серы (VI) — это… Что такое Оксид серы (VI)?
Окси́д се́ры(VI) (се́рный ангидри́д, трео́кись се́ры, се́рный га́з) SO3 — высший оксид серы, тип химической связи: ковалентная полярная химическая связь. В обычных условиях легколетучая бесцветная жидкость с удушающим запахом. При температурах ниже 16,9 °C застывает с образованием смеси различных кристаллических модификаций твёрдого SO3.
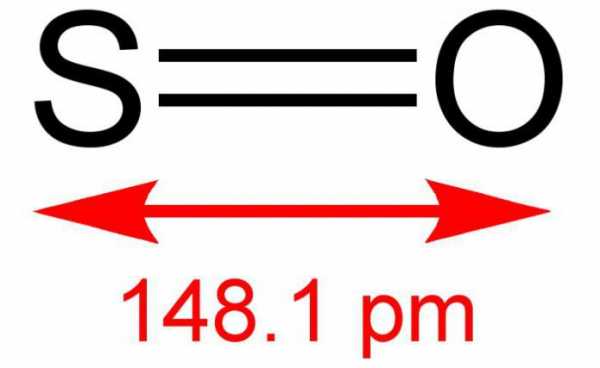
Находящиеся в газовой фазе молекулы SO3 имеют плоское тригональное строение с симметрией D3h (угол OSO = 120°, d(S-O) = 141 пм.) При переходе в жидкое и кристаллическое состояния образуются циклический тример и зигзагообразные цепи.
пространственная модель молекулыγ-SO3
Твёрдый SO3 существует в α-, β-, γ- и δ-формах, с температурами плавления соответственно 16,8, 32,5, 62,3 и 95 °С и различающихся по форме кристаллов и степени полимеризации SO3. α-форма SO3 состоит преимущественно из молекул тримера. Другие кристаллические формы серного ангидрида состоят из зигзагообразных цепей: изолированных у β-SO
Получение
Получают, окисляя оксид серы(IV) кислородом воздуха при нагревании, в присутствии катализатора (V2O5, Pt или Na2VO3):
- 2SO2 + O2 → 2SO3 + Q.
Можно получить термическим разложением сульфатов:
- Fe2(SO4)3 → Fe2O3 + 3SO3,
или взаимодействием SO2 с озоном:
- SO2 + O3 → SO3 + O2.
Для окисления SO2 используют также оксид азота(IV) NO2:
- SO2 + NO2 → SO3 + NO.
Эта реакция лежит в основе исторически первого, нитрозного способа получения серной кислоты.
Химические свойства
1. Кислотно-основные: SO3 — типичный кислотный оксид, ангидрид серной кислоты. Его химическая активность достаточно велика.
При взаимодействии с водой образует серную кислоту:
- SO3 + H2O → H2SO4.
Взаимодействует с основаниями:
- 2KOH + SO3 → K2SO4 + H2O,
основными оксидами:
- CaO + SO3 → CaSO4,
c амфотерными оксидами:
- 3SO3 + Al2O3 → Al2(SO4)3.
SO3 растворяется в 100%-й серной кислоте, образуя олеум:
- H2SO4 (100 %) + SO3 → H2S2O7.
2. Окислительно-восстановительные: SO3 характеризуется сильными окислительными свойствами, восстанавливается, обычно, до SO2:
- 5SO3+ 2P→ P2O5 + 5SO2
- 3SO3 + H2S → 4SO 2+ H2O
- 2SO3 + 2KI → SO2 + I2 + K2SO4.
3. При взаимодействии с хлороводородом образуется хлорсульфоновая кислота HSO3Cl:
- SO3 + HCl → HSO3Cl
Также присоединяет хлор, образуя тионилхлорид:
- SO3 + Cl2 + 2 SCl2 → 3SOCl2
Применение
Серный ангидрид используют в основном в производстве серной кислоты.
Особенности работы
Поскольку при взаимодействии SO3 и воды образуется едкая серная кислота, при работах с ним следует соблюдать особенную осторожность.Поэтому следует вливать тоненькой струйкой КИСЛОТУ В ВОДУ, непрерывно перемешивая раствор.
Литература
- Ахметов Н. С. «Общая и неорганическая химия» М.: Высшая школа, 2001
- Карапетьянц М. Х., Дракин С. И. «Общая и неорганическая химия» М.: Химия 1994
Wikimedia Foundation. 2010.
dic.academic.ru
Оксид серы(VI) — это… Что такое Оксид серы(VI)?
У этого термина существуют и другие значения, см. Оксид серы.Окси́д се́ры (VI) (се́рный ангидри́д, трео́кись се́ры, се́рный га́з) SO3 — высший оксид серы, тип химической связи: ковалентная полярная химическая связь. В обычных условиях легколетучая бесцветная жидкость с удушающим запахом. При температурах ниже 16,9 °C застывает с образованием смеси различных кристаллических модификаций твёрдого SO3.
Находящиеся в газовой фазе молекулы SO3 имеют плоское тригональное строение с симметрией D3h (угол OSO = 120°, d(S-O) = 141 пм.) При переходе в жидкое и кристаллическое состояния образуются циклический тример и зигзагообразные цепи.
Пространственная модель молекулы γ-SO3Твёрдый SO 3 существует в α-, β-, γ- и δ-формах, с температурами плавления соответственно 16,8, 32,5, 62,3 и 95 °C и различающихся по форме кристаллов и степени полимеризации SO3. α-форма SO3 состоит преимущественно из молекул триме́ра. Другие кристаллические формы серного ангидрида состоят из зигзагообразных цепей: изолированных у β-SO3, соединенных в плоские сетки у γ-SO3 или в пространственные структуры у δ-SO3. При охлаждении из пара сначала образуется бесцветная, похожая на лёд, неустойчивая α-форма, которая постепенно переходит в присутствии влаги в устойчивую β-форму — белые «шёлковистые» кристаллы, похожие на асбест. Обратный переход β-формы в α-форму возможен только через газообразное состояние SO3. Обе модификации на воздухе «дымят» (образуются капельки H2SO4) вследствие высокой гигроскопичности SO3. Взаимный переход в другие модификации протекает очень медленно. Разнообразие форм триоксида серы связано со способностью молекул SO
Получение
Получают, окисляя оксид серы (IV) кислородом воздуха при нагревании, в присутствии катализатора (V2O5, Pt или NaVO3):
Можно получить термическим разложением сульфатов:
или взаимодействием SO2 с озоном:
Для окисления SO2 используют также NO2:
Эта реакция лежит в основе исторически первого, нитрозного способа получения серной кислоты.
Химические свойства
1. Кислотно-основные:
SO3 — типичный кислотный оксид, ангидрид серной кислоты. Его химическая активность достаточно велика. При взаимодействии с водой образует серную кислоту:Однако в данной реакции серная кислота образуется в виде аэрозоли, и поэтому в промышленности оксид серы(VI) растворяют в серной кислоте с образованием олеума, который далее растворяют в воде до образования серной кислоты нужной концентрации.
Взаимодействует с основаниями:
и оксидами:
SO3 растворяется в 100%-й серной кислоте, образуя олеум:
2. Окислительно-восстановительные: SO3 характеризуется сильными окислительными свойствами, восстанавливается, обычно, до сернистого ангидрида:
Также взаимодействует с двухлористой серой и хлором, образуя тионилхлорид:
Применение
Серный ангидрид используют в основном в производстве серной кислоты.
Литература
- Ахметов Н. С. «Общая и неорганическая химия» М.: Высшая школа, 2001
- Карапетьянц М. Х., Дракин С. И. «Общая и неорганическая химия» М.: Химия 1994
dic.academic.ru
SO3 какой это оксид
Сернистый ангидрид (SO3 какой это оксид?) производится в гигантских промышленных масштабах каталитическим окислением с целью получения серной кислоты. Он образуется также при термическом распаде сульфатов и пиросульфатов:
Мономерные молекулы , присутствующие в газовой фазе, имеют форму правильного треугольника.
Серный ангидрид – одно из самых реакционноспособных соединений. Он проявляет окислительные свойства, например превращает уголь в углекислый газ:
Особенности взаимодействия с галогенводородами связаны с ростом восстановительных свойств в ряду HCl – HBr – HI. Окислительные свойства усиливаются с ростом температуры. При слабом нагревании реагирует с газообразным HCl, образуя хлорсульфоновую кислоту :
При повышении температуры HCl восстанавливает до с одновременным образованием . При действии на HBr триоксида серы при выделяются и свободный бром:
Иодистым водородом восстанавливается до даже при охлаждении ниже :
Серный ангидрид бурно взаимодействует с водой с выделением большого количества теплоты. Термически неустойчив. Его термическая диссоциация на и начинается при , а при в газовой фазе полностью отсутствуют молекулы .
SO3 название вещества
Сернистый ангидрид (SO3 название вещества) производится в гигантских промышленных масштабах каталитическим окислением с целью получения серной кислоты. Он образуется также при термическом распаде сульфатов и пиросульфатов:
Мономерные молекулы , присутствующие в газовой фазе, имеют форму правильного треугольника.
Серный ангидрид – одно из самых реакционноспособных соединений. Он проявляет окислительные свойства, например превращает уголь в углекислый газ:
Особенности взаимодействия с галогенводородами связаны с ростом восстановительных свойств в ряду HCl – HBr – HI. Окислительные свойства усиливаются с ростом температуры. При слабом нагревании реагирует с газообразным HCl, образуя хлорсульфоновую кислоту :
При повышении температуры HCl восстанавливает до с одновременным образованием . При действии на HBr триоксида серы при выделяются и свободный бром:
Иодистым водородом восстанавливается до даже при охлаждении ниже :
Серный ангидрид бурно взаимодействует с водой с выделением большого количества теплоты. Термически неустойчив. Его термическая диссоциация на и начинается при , а при в газовой фазе полностью отсутствуют молекулы .
ru.solverbook.com
SO2 — это… Что такое SO2?
Окси́д се́ры(IV) (диокси́д се́ры, серни́стый газ, серни́стый ангидри́д) — SO2. В нормальных условиях представляет собой бесцветный газ с характерным резким запахом (запах загорающейся спички). Под давлением сжижается при комнатной температуре. Растворяется в воде с образованием нестойкой сернистой кислоты; растворимость 11,5 г/100 г воды при 20 °C, снижается с ростом температуры. Растворяется также в этаноле, серной кислоте. SO2 — один из основных компонентов вулканических газов.
Получение
Промышленный способ получения — сжигание серы или обжиг сульфидов, в основном — пирита:
4FeS2 + 11O2 → 2Fe2O3 + 8SO2↑ + Q.
В лабораторных условиях SO2 получают воздействием сильных кислот на сульфиты и гидросульфиты:
Na2SO3 + H2SO4 → Na2SO4 + H2SO3.
Образующаяся сернистая кислота сразу разлагается на SO2 и H2O:
Na2SO3 + H2SO4 → Na2SO4 + H2O + SO2↑.
Также можно получить действием концентрированной серной кислоты на малоактивные металлы при нагревании:
2H2SO4 (конц.) + Cu → CuSO4 + SO2↑ + 2H2O.
Химические свойства

Спектр поглощения SO2 в ультрафиолетовом диапазоне
Относится к кислотным оксидам. Растворяется в воде с образованием сернистой кислоты (при обычных условиях реакция обратима):
SO2 + H2O ↔ H2SO3.
Со щелочами образует сульфиты:
SO2 + 2NaOH → Na2SO3 + H2O.
Химическая активность SO2 весьма велика. Наиболее ярко выражены восстановительные свойства SO2, степень окисления серы в таких реакциях повышается:
SO2 + Br2 + 2H2O → H2SO4 + 2HBr,
2SO2 + O2 → 2SO3 (требуется катализатор V2O5 и температура 450°),
5SO2 + 2KMnO4 + 2H2O → 2H2SO4 + 2MnSO4 + K2SO4.
Последняя реакция является качественной реакцией на сульфит-ион SO32- и на SO2 (обесцвечивание фиолетового раствора).
В присутствии сильных восстановителей SO2 способен проявлять окислительные свойства. Например, для извлечения серы их отходящих газов металлургической промышленности используют восстановление SO2оксидом углерода(II):
SO2 + 2CO → 2CO2 + S↓.
Или для получения фосфорноватистой кислоты:
PH3 + SO2 → H(PH2O2) + S↓
Применение
В пищевой промышленности диоксид серы используется как консервант и обозначается на упаковке под кодом Е220.
Физиологическое действие
SO2 токсичен. Симптомы при отравлении сернистым газом — насморк, кашель, охриплость, першение в горле. При вдыхании сернистого газа более высокой концентрации — удушье, расстройство речи, затруднение глотания, рвота, возможен острый отёк лёгких.
- ПДК максимально-разового воздействия — 0,5 мг/м3
Дополнительные сведения о токсичности
Интересно, что чувствительность по отношению к SO2 весьма различна как у людей, так и у растений. Наиболее устойчивы по отношению к сернистому газу берёза и дуб, наименее — сосна и ель. Наиболее чувствительными к SO2 являются розы. При попадании на них сернистого газа они моментально белеют.
Wikimedia Foundation. 2010.
dic.academic.ru
Оксид серы в природе и жизни человека :: SYL.ru
В этой статье вы найдете информацию о том, что такое оксид серы. Будут рассмотрены его основные свойства химического и физического характера, существующие формы, способы их получения и отличия между собой. А также будут упомянуты области применения и биологическая роль данного оксида в его разнообразных формах.
Что представляет собой вещество
Оксид серы – это соединение простых веществ, серы и кислорода. Существует три формы оксидов серы, отличающиеся между собой степенью проявленной валентности S, а именно: SO (монооксид, моноокись серы), SO2 (серный диоксид или сернистый газ) и SO3 (триоксид или ангидрид серы). Все перечисленные вариации оксидов серы имеют схожие как химические, так и физические характеристики.

Общие данные о моноокисиде серы
Двухвалентный серный монооксид, или иначе серная моноокись – это неорганическое вещество, состоящее из двух простых элементов — серы и кислорода. Формула – SO. В условиях нормальной обстановки является газом без цвета, но с резким и специфическим запахом. Вступает в реакции с водным раствором. Довольно редкое соединение в земной атмосфере. К воздействию температур неустойчив, существует в димерной форме – S2O2. Иногда способен, взаимодействуя с кислородом, в результате реакции образовывать диоксид серы. Солей не образует.
Получают оксид серы (2) обычно при помощи сжигания серы или разложении ее ангидрида:
- 2S2+O2 =2SO;
- 2SO2 = 2SO+O2.
В воде вещество растворяется. В результате оксид серы образует тиосерную кислоту:
Общие данные о сернистом газе
Оксид серы – очередная форма оксидов серы с химической формулой SO2. Имеет неприятный специфический запах и не имеет цвета. Подвергаясь давлению, может зажигаться при комнатной температуре. При растворении в воде образует нестойкую сернистую кислоту. Может растворяться в растворах этанола и серной кислоты. Является компонентом вулканического газа.

В промышленности получают сжиганием серы или обжигом ее сульфидов:
В лабораториях, как правило, SO2 получают при помощи сульфитов и гидросульфитов, подвергая их воздействию сильной кислоты, а также воздействию на металлы с маленькой степенью активности концентрированной H2SO4.
Как и другие серные оксиды, SO2 является кислотным оксидом. Взаимодействуя со щелочами, образуя различные сульфиты, вступает в реакции с водой, создавая серную кислоту.
SO2 чрезвычайно активен, и это ярко выражается в его восстановительных свойствах, где окислительная степень оксида серы возрастает. Может проявлять свойства окислителя, если на него воздействует сильный восстановитель. Последнюю характерную особенность используют для производства фосфорноватистой кислоты, или для отделения S от газов металлургической области деятельности.
Оксид серы (4) широко используется человеком для получения сернистой кислоты или ее солей – это его основная область применения. А также он участвует в процессах виноделия и выступает там в роли консерванта (E220), иногда им протравливают овощехранилища и склады, так как он уничтожает микроорганизмы. Материалы, которые нельзя подвергать отбеливанию хлором, обрабатывают оксидом серы.

SO2 — довольно токсичное соединение. Характерные симптомы, указывающие на отравление им, — это откашливание, появление проблем с дыханием, как правило, в виде насморка, охриплости, появление необычного привкуса и першение в горле. Вдыхание такого газа может вызвать удушье, нарушение речевой способности индивида, рвоту, затруднение процесса глотания, а также легочный отек в острой форме. Максимально допустимой концентрацией этого вещества в рабочем помещении является 10мг/м3. Однако у различных людей организм может проявлять и разную чувствительность к сернистому газу.
Общие данные о серном ангидриде
Серный газ, или, как его называют, серный ангидрид, – это высший оксид серы с химической формулой SO3. Жидкость с удушливым запахом, легколетучая при стандартных условиях. Способна застывать, образовывая смеси кристаллического типа из его твердых модификаций, при температуре от 16.9 °C и ниже.

Детальный разбор высшего оксида
При окислении SO2 воздухом под воздействием высоких температур, необходимым условием является наличие катализатора, например V2O5, Fe2O3, NaVO3 или Pt.
Термическое разложение сульфатов либо взаимодействие озона и SO2:
- Fe2(SO4)3 = Fe2O3+3SO3;
- SO2+O3 = SO3+O2.
Окисление SO2 при помощи NO2:
К физическим качественным характеристикам относятся: наличие в состоянии газа плоского строения, тригонального типа и D3h симметрии, во время перехода от газа к кристаллу или жидкости образует тример циклического характера и зигзагообразную цепь, имеет ковалентную полярную связь.
В твердой форме SO3 встречается в альфа, бета, гамма и сигма формах, при этом он имеет, соответственно, разную температуру плавления, степень проявления полимеризации и разнообразную кристаллическую форму. Существование такого количества видов SO3 обусловлено образованием связей донорно-акцепторного типа.
К свойствам ангидрида серы можно отнести множество его качеств, основными из них являются:
Способность взаимодействовать с основаниями и оксидами:
- 2KHO+SO3 = K2SO4+H2O;
- CaO+SO3 = CaSO4.
Высший серный оксид SO3 имеет достаточно большую активность и создает серную кислоту, взаимодействуя с водой:
Вступает в реакции взаимодействия с хлороводородом и образует хлоросульфатную кислоту:
Для оксида серы характерным является проявление сильных окислительных свойств.
Применение серный ангидрид находит в создании серной кислоты. Небольшое его количество выделяется в окружающую среду во время использования серных шашек. SO3, образуя серную кислоту после взаимодействия с влажной поверхностью, уничтожает разнообразные опасные организмы, например грибки.
Подводя итоги
Оксид серы может находиться в разных агрегатных состояниях, начиная с жидкости и заканчивая твердой формой. В природе встречается редко, а способов его получения в промышленности довольно много, как и сфер, где его можно использовать. Сам оксид имеет три формы, в которых он проявляет различную степень валентности. Может быть очень токсичным и вызывать серьезные проблемы со здоровьем.
www.syl.ru
Оксиды серы. Серная кислота | АЛХИМИК
Сера с кислородом образует два оксида: SO2 – оксид серы (IV) и SO3 – оксид серы (VI).
Оксид серы (IV) — SO2 (сернистый газ, сернистый ангидрид)
Сернистый газ – это бесцветный газ с резким запахом, ядовит. Тяжелее воздуха более чем в два раза. Хорошо растворяется в воде. При комнатной температуре в одном объёме воды растворяется около 40 объёмов сернистого газа, при этом образуется сернистая кислота H2SO3.
Химические свойства
Кислотно-основные свойства
Сернистый газ – типичный кислотный оксид. Он взаимодействует:
а) с основаниями, образуя два типа солей: кислые (гидросульфиты) и средние (сульфиты):
SO2 + NaOH = NaHSO3
SO2 + 2NaOH = Na2SO3 + H2O
б) с основными оксидами:
SO2 + CaO = CaSO3
SO2 + K2O = K2SO3
в) с водой:
SO2 + H2O = H2SO3
Сернистая кислота существуют только в растворе, относится к двухосновным кислотам. Сернистая кислота обладает всеми общими свойствами кислот.
Окислительно – восстановительные свойства
В окислительно-восстановительных процессах сернистый газ может быть как окислителем, так и восстановителем, потому что атом серы в этом соединении имеет промежуточную степень окисления +4.
Как окислитель SO2 реагирует с более сильными восстановителями, например с сероводородом:
SO2 + 2H2S = 3S↓ + 2H2O
Как восстановитель SO2 реагирует с более сильными окислителями, например с кислородом в присутствии катализатора, с хлором и т.д.:
2SO2 + O2 = 2SO3
SO2 + Cl2 + 2H2O = H2SO3 + 2HCl
Получение
1) Сернистый газ образуется при горении серы:
S + O2 = SO2
2) В промышленности его получают при обжиге пирита:
4FeS2 + 11O2 = 2Fe2O3 + 8SO2
3) В лаборатории сернистый газ можно получить:
а) при действии кислот на сульфиты:
Na2SO3 + H2SO4 = Na2SO4 + H2SO3→SO2↑ + H2O
б) при взаимодействии концентрированной серной кислоты с тяжелыми металлами:
Cu + 2H2SO4 = CuSO4 + SO2↑ + 2H2O
Применение
Сернистый газ находит широкое применение в текстильной промышленности для отбеливания различных изделий. Кроме того, его используют в сельском хозяйстве для уничтожения вредных микроорганизмов в теплицах и погребах. В больших количествах SO2 идет на получение серной кислоты.
Оксид серы (VI) – SO3 (серный ангидрид)
Серный ангидрид SO3 – это бесцветная жидкость, которая при температуре ниже 17оС превращается в белую кристаллическую массу. Очень хорошо поглощает влагу (гигроскопичен).
Химические свойства
Кислотно-основные свойства
Как типичный кислотный оксид серный ангидрид взаимодействует:
а) с основаниями, образуя два типа солей – кислые (гидросульфиты) и средние (сульфаты):
SO3 + NaOH = NaHSO4
SO3 + 2NaOH = Na2SO4 + H2O
б) с основными оксидами:
SO3 + CaO = CaSO4
в) с водой:
SO3 + H2O = H2SO4
Особым свойством SO3 является его способность хорошо растворяться в серной кислоте. Раствор SO3 в серной кислоте имеет название олеум.
Образование олеума: H2SO4 + nSO3 = H2SO4 ∙ nSO3
Окислительно-восстановительные свойства
Оксид серы (VI) характеризуется сильными окислительными свойствами (обычно восстанавливается до SO2):
3SO3 + H2S = 4SO2 + H2O
Получение и применение
Серный ангидрид образуется при окислении сернистого газа:
2SO2 + O2 = 2SO3
В чистом виде серный ангидрид практического значения не имеет. Он получается как промежуточный продукт при производстве серной кислоты.
Серная кислота H2SO4
Упоминания о серной кислоте впервые встречаются у арабских и европейских алхимиков. Ее получали, прокаливая на воздухе железный купорос (FeSO4∙7H2O): 2FeSO4 = Fe2O3 + SO3↑ + SO2↑ либо смесь серы с селитрой: 6KNO3 + 5S = 3K2SO4 + 2SO3↑ + 3N2↑, а выделяющиеся пары серного ангидрида конденсировали. Поглощая влагу, они превращались в олеум. В зависимости от способа приготовления H2SO4 называли купоросным маслом или серным маслом. В 1595 г. алхимик Андреас Либавий установил тождественность обоих веществ.
Долгое время купоросное масло не находило широкого применения. Интерес к нему сильно возрос после того, как в XVIII в. был открыт процесс получения из индиго индигокармина – устойчивого синего красителя. Первую фабрику по производству серной кислоты основали недалеко от Лондона в 1736 г. Процесс осуществляли в свинцовых камерах, на дно которых наливали воду. В верхней части камеры сжигали расплавленную смесь селитры с серой, затем туда запускали воздух. Процедуру повторяли до тех пор, пока на дне ёмкости не образовывалась кислота требуемой концентрации.
В XIX в. способ усовершенствовали: вместо селитры стали использовать азотную кислоту (она при разложении в камере даёт NO2). Чтобы возвращать в систему нитрозные газы были сконструированы специальные башни, которые и дали название всему процессу – башенный процесс. Заводы, работающие по башенному методу, существуют и в наше время.

 Серная кислота
Серная кислотаСерная кислота – это тяжелая маслянистая жидкость без цвета и запаха, гигроскопична; хорошо растворяется в воде. При растворении концентрированной серной кислоты в воде выделяется большое количество тепла, поэтому ее надо осторожно приливать в воду (а не наоборот!) и перемешивать раствор.
Раствор серной кислоты в воде с содержанием H2SO4 менее 70% обычно называют разбавленной серной кислотой, а раствор более 70% — концентрированной серной кислотой.
Химические свойства
Кислотно-основные свойства
Разбавленная серная кислота проявляет все характерные свойства сильных кислот. Она реагирует:
а) с основными оксидами:
MgO + H2SO4 = MgSO4 + H2O
б) с основаниями:
H2SO4 + NaOH = Na2SO4 + 2H2O
в) с солями:
H2SO4 + BaCl2 = BaSO4↓ + 2HCl
Процесс взаимодействия ионов Ва2+ с сульфат-ионами SO42+ приводит к образованию белого нерастворимого осадка BaSO4. Это качественная реакция на сульфат-ион.
Окислительно – восстановительные свойства
В разбавленной H2SO4 окислителями являются ионы водорода Н+, а в концентрированной – сульфат-ионы SO42+. Ионы SO42+ являются более сильными окислителями, чем ионы Н+ (см.схему).

В разбавленной серной кислоте растворяются металлы, которые в электрохимическом ряду напряжений находятся до водорода. При этом образуются сульфаты металлов и выделяется водород:
Zn + H2SO4 = ZnSO4 + H2↑
Металлы, которые в электрохимическом ряду напряжений находятся после водорода, не реагируют с разбавленной серной кислотой:
Cu + H2SO4 ≠
Концентрированная серная кислота является сильным окислителем, особенно при нагревании. Она окисляет многие металлы, неметаллы и некоторые органические вещества.
При взаимодействии концентрированной серной кислоты с металлами, которые в электрохимическом ряду напряжений находятся после водорода (Cu, Ag, Hg), образуются сульфаты металлов, а также продукт восстановления серной кислоты – SO2.
Реакция серной кислоты с цинкомБолее активными металлами (Zn, Al, Mg) концентрированная серная кислота может восстанавливаться до свободной серы или сероводорода. Например, при взаимодействии серной кислоты с цинком, магнием, алюминием в зависимости от концентрации кислоты одновременно могут образовываться различные продукты восстановления серной кислоты – SO2, S, H2S:
Zn + 2H2SO4 = ZnSO4 + SO2↑ + 2H2O
3Zn + 4H2SO4 = 3ZnSO4 + S↓ + 4H2O
4Zn + 5H2SO4 = 4ZnSO4 + H2S↑ + 4H2O
На холоде концентрированная серная кислота пассивирует некоторые металлы, например алюминий и железо, поэтому ее перевозят в железных цистернах:
Fe + H2SO4 ≠
Концентрированная серная кислота окисляет некоторые неметаллы (серу, углерод и др.), восстанавливаясь до оксида серы (IV) SO2:
S + 2H2SO4 = 3SO2↑ + 2H2O
C + 2H2SO4 = 2SO2↑ + CO2↑ + 2H2O
Получение и применение
Реакция серной кислоты с сахаромВ промышленности серную кислоту получают контактным способом. Процесс получения происходит в три стадии:
- Получение SO2 путем обжига пирита:
4FeS2 + 11O2 = 2Fe2O3 + 8SO2↑
- Окисление SO2 в SO3 в присутствии катализатора – оксида ванадия (V):
2SO2 + O2 = 2SO3
- Растворение SO3 в серной кислоте:
H2SO4 + nSO3 = H2SO4 ∙ nSO3
Полученный олеум перевозят в железных цистернах. Из олеума получают серную кислоту нужной концентрации, приливая его в воду. Это можно выразить схемой:
H2SO4 ∙ nSO3 + H2O = H2SO4
Серная кислота находит разнообразное применение в самых различных областях народного хозяйства. Ее используют для осушки газов, в производстве других кислот, для получения удобрений, различных красителей и лекарственных средств.
Соли серной кислоты

 Железный купорос
Железный купоросБольшинство сульфатов хорошо растворимы в воде (малорастворим CaSO4, еще менее PbSO4 и практически нерастворим BaSO4). Некоторые сульфаты, содержащие кристаллизационную воду, называются купоросами:
CuSO4 ∙ 5H2O медный купорос
FeSO4 ∙ 7H2O железный купорос
Соли серной кислоты имеют все общие свойства солей. Особенным является их отношение к нагреванию.
Сульфаты активных металлов (Na, K, Ba) не разлагаются даже при 1000оС, а других (Cu, Al, Fe) – распадаются при небольшом нагревании на оксид металла и SO3:
Na2SO4 ≠
CuSO4 = CuO + SO3
Скачать:
Скачать бесплатно реферат на тему: «Производство серной кислоты контактным способом» Производство-серной-кислоты-контактным-способом.docx (4 Загрузки)
Скачать рефераты по другим темам можно здесь
*на изображении записи фотография медного купороса
Читайте также
Похожее
al-himik.ru
