Галлий: факты и фактики
А. Мотыляев
«Химия и жизнь» №9, 2021
Галлий, он же придуманный Д. И. Менделеевым экаалюминий, элемент номер 31, был открыт Лекоком де Буабодраном в 1875 году по спектральным линиям. Этот металл мало похож на все остальные: подобно ртути он жидок при температуре чуть выше комнатной, точнее, выше 29,77°С. Есть еще только два таких жидких металла — цезий и франций, но это щелочные металлы, работать с ними так просто невозможно. А с галлием даже проще, чем с ртутью: он почти не испаряется. В 70-е годы ему прочили блестящее будущее (см. «Химию и жизнь», 1970, 6), но оно, увы, не наступило. То есть, будущее-то осталось, но в настоящем галлий используют всего сотнями тонн главным образом для различной электроники, а также как добавку в магнитный сплав на основе неодим-железа-бора; это важнейший компонент ветрогенераторов. Посмотрим повнимательнее на настоящее будущее 31-го элемента?
Можно ли встретиться с металлическим галлием в повседневной жизни? С недавних пор — легко.
Как галлий попал в смартфон? Арсенид галлия — такой же полупроводник, как и кремний, подходящий для электроники. Его характеристики, как полупроводника, лучше, однако технология изготовления сложнее, поэтому до поры до времени его не использовали для массового производства: из арсенида галлия делали уникальные детали вроде солнечных элементов для космических станций.
Как Китай стал монополистом в производстве галлия? Последние тридцать лет мировой рынок галлия сильно лихорадит. Началось все с появления на нем огромных запасов металла, накопленных в СССР. Когда они кончились, цены резко взмыли, достигнув максимума к 2001-му году. Однако потом началось быстрое падение, что полностью дезориентировало инвесторов.
В принципе, грязный, так называемый первичный, галлий можно получать на любом глиноземном заводе. Ведь он верный спутник своего брата по таблице Менделеева — алюминия. Но для этого нужно оборудовать соответствующий цех, а если цеха нет, галлий идет в отходы, как это происходит на большинстве глиноземных заводов. Впрочем, потребность в галлии заставила кое-где ставить такие цеха и до недавнего времени соответствующие производства были в Японии, КНР, Южной Корее, ФРГ, а в СССР — на территории РСФСР, УССР, КазССР, ну и родившихся из них независимых государств. При этом к 2006 году в КНР получали треть первичного галлия. Изготовлением же чистого галлия занимались и занимаются многие страны.
Ведь он верный спутник своего брата по таблице Менделеева — алюминия. Но для этого нужно оборудовать соответствующий цех, а если цеха нет, галлий идет в отходы, как это происходит на большинстве глиноземных заводов. Впрочем, потребность в галлии заставила кое-где ставить такие цеха и до недавнего времени соответствующие производства были в Японии, КНР, Южной Корее, ФРГ, а в СССР — на территории РСФСР, УССР, КазССР, ну и родившихся из них независимых государств. При этом к 2006 году в КНР получали треть первичного галлия. Изготовлением же чистого галлия занимались и занимаются многие страны.
Но вот в 2009-м в КНР приняли решение сосредоточить у себя мировое производство электронных компонентов. На это выделили 10 млрд долларов, которые были потрачены не напрасно: к 2012 году на территории Китая располагалось 80% мощностей по производству различной электроники, от микросхем до солнечных элементов. Соответственно, были созданы и производства для обеспечения их сырьем. В частности — галлием, благо алюминиевая, а, соответственно, и глиноземная промышленность в КНР развивалась успешно.
И тут оказалось, что рынок уже насыщен смартфонами, планшетами и прочими устройствами, где нужен арсенид галлия. Возникла диспропорция: его потребление перестало расти, а производство стараниями Китая росло, как на дрожжах. Надежды, что соединения галлия найдут новые рынки, например, в виде солнечных батарей для массового использования или в качестве светодиодов, не оправдались; рынок неодим-железо-борных магнитов тоже не смог поглотить весь китайский галлий. Цена упала, и это сделало нерентабельными многие некитайские производства первичного галлия. Поэтому уже в 2013 году с мирового рынка ушли РФ, ФРГ и Казахстан, в 2016-м — Япония и Южная Корея. Украина продержалась дольше всех — производство галлия там закрыли в 2019-м. Теперь в КНР сосредоточено 80% мирового производства первичного галлия. Первичный галлий еще добывают из вторсырья — этим заняты Канада, Словакия, Япония, ФРГ и США.
И вот, став фактически монополистом на рынке, в 2019 году КНР на 30% увеличила пошлину на галлий, из-за чего подскочили цены на все компоненты с арсенидом галлия, изготовленные за пределами КНР. Правда, американцы оказались не лыком шиты: за год до введения пошлин они в три раза увеличили импорт галлия, то есть накапливали его. Зато теперь импорт упал: металла США закупают в два с лишним раза меньше, чем в 2016 году, а арсенида галлия — в семь раз. Перешли они на собственные источники или используют запасы — не очень ясно. Вот так выглядит галлиевый эпизод идущей на наших глазах американо-китайской экономической войны. В РФ сохранилось единственное производство галлия — на Пикалёвском глиноземном заводе в Ленинградской области, который принадлежит компании «Русал». Этот градообразующий завод мог бы исчезнуть в 2009 году, но тогда его ликвидации помешало вмешательство В.В. Путина, вызванное прошедшими в городе народными волнениями.
Что такое жидкие провода? Это именно то, что способно обеспечить галлию светлое будущее в XXI веке. Как уже было сказано, галлий уникален тем, что при температуре человеческого тела он жидкий, однако при этом не испаряется, как ртуть, и не реагирует бурно с водой, как цезий или франций (последний, впрочем, можно не учитывать: на Земле его считанные граммы, см. «Химию и жизнь», 2018, 5). Температуру плавления можно понизить, сплавив галлий с индием — до 15,5°С, это будет сплав эгаин, а добавив олово получить рекордные 10,7°С, сплав галинстан, он-то и служит в градусниках. Более того, расплавленный галлий и его сплавы выдерживают глубокое переохлаждение; так для галинстана указано затвердевание при 19 градусах мороза. А еще электропроводность жидкого галлия ничуть не меньше, чем галлия твердого. Все эти обстоятельства делают его незаменимым материалом для так называемой носимой электроники, то есть создания электрических схем, составляющих одно целое с человеческим телом. Называя вещи своими именами — основу для создания киборгов.
Как уже было сказано, галлий уникален тем, что при температуре человеческого тела он жидкий, однако при этом не испаряется, как ртуть, и не реагирует бурно с водой, как цезий или франций (последний, впрочем, можно не учитывать: на Земле его считанные граммы, см. «Химию и жизнь», 2018, 5). Температуру плавления можно понизить, сплавив галлий с индием — до 15,5°С, это будет сплав эгаин, а добавив олово получить рекордные 10,7°С, сплав галинстан, он-то и служит в градусниках. Более того, расплавленный галлий и его сплавы выдерживают глубокое переохлаждение; так для галинстана указано затвердевание при 19 градусах мороза. А еще электропроводность жидкого галлия ничуть не меньше, чем галлия твердого. Все эти обстоятельства делают его незаменимым материалом для так называемой носимой электроники, то есть создания электрических схем, составляющих одно целое с человеческим телом. Называя вещи своими именами — основу для создания киборгов.
Для носимой электроники необходима эластичность электросхемы.
Помимо электропроводности, материал для такой электротехники должен пропускать влагу, свет и тепло, иначе человеку будет некомфортно. Если проблему с влагой и светом можно решить за счет пористой прозрачной полимерной основы, то для рассеивания тепла нужно опять-таки использовать жидкий металл, поместив в полимер его частицы: только металлы обладают прекрасной способностью проводить тепло.
Какие устройства с жидкими проводами уже придуманы? Как ни странно, таких довольно много. Это схемы с различными датчиками, антенны, электрогенераторы, батарейки и даже прототипы искусственных органов.
Вот, например, датчики прикосновений, которые используют в системах виртуальной реальности для передачи тактильных ощущений. Если сделать такой датчик в виде эластичного полимера с проводами из галлия, то при нажатии датчик деформируется, сечение жидких проводов изменится, изменится и сопротивление проходящему по ним току, и, соответственно, выделение тепла, то есть, температура. Интересно, что если на датчик наклеить полимер, цвет которого зависит от температуры, силу нажатия можно будет увидеть. Датчик другого типа состоит из двух электродов и диэлектрической губки между ними, то есть это электроконденсатор. При нажатии губка сжимается и емкость конденсатора меняется. Для нормальной работы датчика у губки должна быть большая диэлектрическая проницаемость. Чтобы этого добиться, в полимер опять-таки встраивают частицы жидкого галлия, которые свободно деформируются вместе с губкой. С такими датчиками уже созданы перчатки, способные передавать и принимать информацию о тактильных ощущениях.
Комплексную систему из нескольких датчиков, соединенных проводами и помещенных в слой прозрачного пластика, называют электронной татуировкой. Она может включать эластичные датчики звуков, прикосновений, деформации кожи, термодатчики. С помощью такой татуировки удается собрать все данные, например, для того чтобы искусственная кисть руки повторяла движения руки человека. Соединив жидкими проводами твердые датчики, удается сделать татуировку, которая станет вести мониторинг здоровья.
Для питания всех этих датчиков придумано несколько способов. Это может быть и трибоэлектричество, добываемое трением волокон генератора при движении человека, и термоэлектричество, и даже утилизация электромагнитного загрязнения с помощью антенн. Естественно, все генераторы гибкие и эластичные, то есть их металлические части построены из жидкого галлия; правда в антенны пришлось добавить еще и чешуйки серебра: сам галлий с вылавливанием электромагнитных волн из окружающей среды не справляется.
Одним из шедевров кибергостроения можно считать электрическую вставку в кровеносный сосуд, которую пока опробовали на кролике. Помимо электросхемы, на эту вставку были нанесены клетки трех типов, необходимые для ремонта сосуда, а именно клетки энодотелия сосуда, гладкие мышечные клетки и фибробласты аорты. Благодаря току, протекающему по встроенной в полимер катушке из жидкого галлия, эти клетки быстро сформировали сосуд. Более того, действуя импульсами тока в их ядра удалость внедрить ген, кодирующий флуоресцентный белок: об успехе операции судили по свечению сосуда. То есть, в будущем можно таким образом внедрять какие-то целевые гены. В общем, сосуд-вставка прекрасно врос в сосуд кролика, оброс нужными клетками, к тому же генномодифицированными, а сам потом рассосался. Есть идеи, как с помощью галлия создать и искусственный глаз, который можно вживить человеку. Как видно, до реальных киборгов еще далеко, но тенденция вполне понятна и жидкий галлий тут ничем не заменишь.
Есть идеи, как с помощью галлия создать и искусственный глаз, который можно вживить человеку. Как видно, до реальных киборгов еще далеко, но тенденция вполне понятна и жидкий галлий тут ничем не заменишь.
Как из галлия сделать насос и мускул? Интереснейшая особенность галлия состоит в том, что на его поверхности присутствует оксидная пленка. Эка невидаль, скажет читатель, и у того же алюминия она есть, защищает металл от окисления. И будет не прав потому, что алюминий — твердый, а галлий при привычных нам температурах — жидкий. И поверхностное натяжение у галлия с пленкой и галлия без пленки разное. Более того, у окисленного галлия оно столь велико, что капля способна длительное время сохранять причудливые формы, заподозрить которые у жидкости затруднительно. А главное, что оксидную пленку можно убрать, приложив электрическое поле или полив кислотой. Тогда капля растечется. Когда же поле уберут, растекшаяся капля снова станет округлой.
Этим явлением можно воспользоваться для изготовления еще одного важного атрибута киборга — микрофлюидной системы, фактически, микросхемы, только в ней по микроканалам циркулируют не электроны, а жидкости.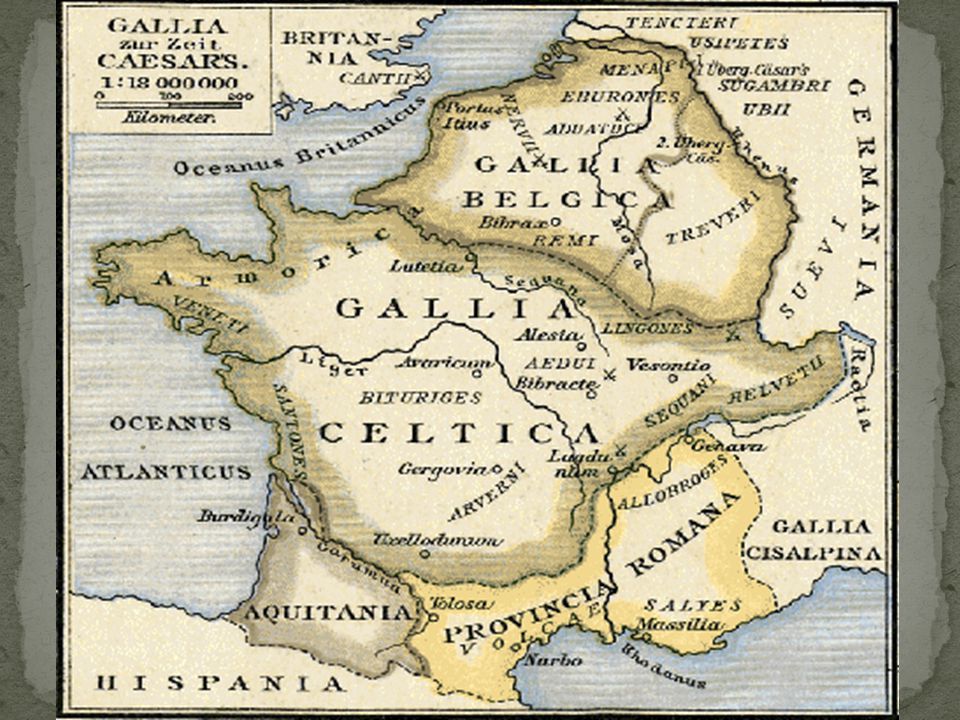 Самое очевидное применение таких систем — вживляемые аптечки, которые по сигналу датчиков выделяют в кровь необходимые вещества. В простейшем случае — однокомпонентные, например, инсулин, но есть идеи использовать и несколько компонентов; тогда смешение жидкостей будет идти по какому-то алгоритму.
Самое очевидное применение таких систем — вживляемые аптечки, которые по сигналу датчиков выделяют в кровь необходимые вещества. В простейшем случае — однокомпонентные, например, инсулин, но есть идеи использовать и несколько компонентов; тогда смешение жидкостей будет идти по какому-то алгоритму.
Очевидно, что таким системам нужны микроскопические вентили и перекачивающие устройства. В таком качестве прекрасно показала себя капля галлия. За счет изменения поверхностного натяжения она вибрирует и создает так называемую силу Марангони, которая двигает жидкость по микроканалу. Фантазеры считают, что из жидкого галлия на том же принципе можно сделать металлические мускулы для роботов. Если эта фантазия воплотится в каком-то виде в жизнь, жидкие роботы, которых в фильме «Терминатор-2» сделали из ртути, окажутся не такой уж чепухой.
Как галлий поможет борьбе с болезнями? За счет двух качеств: низкой температуры плавления и способности нарушать метаболизм железа в клетках бактерий. В принципе, медики давно уж мечтают применять наночастицы для доставки лекарств. Металлические наночастицы вызывают большой интерес, поскольку металлом легко управлять, например, воздействуя электрическими и магнитными полями, и он прекрасно аккумулируют тепло. Однако делать наночастицы из довольно тугоплавких металлов не так уж просто. Другое дело — жидкий галлий. Он дает материаловедам возможность играть размерами наночастиц, заключать внутри частиц и располагать на их поверхностях различные целебные и функциональные вещества, которые отлично прикрепляются к оксидной пленке на поверхности галлиевых капель. Эту пленку можно убрать изменением кислотности, и в результате высвободится связанное с ней лекарство. Так происходит при попадании частицы в раковую клетку, где кислотность всегда высока.
В принципе, медики давно уж мечтают применять наночастицы для доставки лекарств. Металлические наночастицы вызывают большой интерес, поскольку металлом легко управлять, например, воздействуя электрическими и магнитными полями, и он прекрасно аккумулируют тепло. Однако делать наночастицы из довольно тугоплавких металлов не так уж просто. Другое дело — жидкий галлий. Он дает материаловедам возможность играть размерами наночастиц, заключать внутри частиц и располагать на их поверхностях различные целебные и функциональные вещества, которые отлично прикрепляются к оксидной пленке на поверхности галлиевых капель. Эту пленку можно убрать изменением кислотности, и в результате высвободится связанное с ней лекарство. Так происходит при попадании частицы в раковую клетку, где кислотность всегда высока.
При поглощении наночастицы клеткой она оказывается в экзосоме — внутриклеточном пузырьке, окруженном мембраной. Это затрудняет выход лекарства. С помощью инфракрасного излучения, однако, удается превратить округлые частицы галлия в длинные бруски; они прорвут стенки экзосомы, и лекарство подействует. Для этого надо всего лишь декорировать галлий чешуйкам графена, который и поглощает излучение. Есть идеи использовать такой механизм для непосредственного механического уничтожения клеток.
Для этого надо всего лишь декорировать галлий чешуйкам графена, который и поглощает излучение. Есть идеи использовать такой механизм для непосредственного механического уничтожения клеток.
Способность галлия нарушать метаболизм железа использовали, например, при попытке побороться одновременно с палочкой Коха, возбудителем туберкулеза, и ВИЧ. По данным ВОЗ, среди 9 млн человек, ежегодно заболевающих туберкулезом, у 13% имеется СПИД. А причина в том, что оба вредителя селятся в одних и тех же клетках — макрофагах, где становятся неуязвимыми для иммунной системы. Более того, туберкулез может протекать в неявной форме, когда пораженные палочкой Коха клетки формируют специфические образования, грануломы, где живут годами, недоступные для лекарств. А потом они вызывают вспышку болезни. Вот против них, как оказалось, и можно направить наночастицы галлия.
В организме человека металлический галлий превращается в оксид-гидроксид, который, растворяясь, порождает ионы трехвалентного галлия. Они-то и нарушают цикл железа у бактерий. Как показывают опыты на культуре клеток, макрофаги с удовольствием заглатывают наночастицы галлия, а далее он начинает свое доброе дело — уничтожает спрятавшихся в макрофаге бактерий и, как это ни странно, вирусов. Такие наночастицы, относительно безвредные для человека, позволяют бороться с обеими страшными болезнями. По крайней мере, держать заразу под контролем.
Они-то и нарушают цикл железа у бактерий. Как показывают опыты на культуре клеток, макрофаги с удовольствием заглатывают наночастицы галлия, а далее он начинает свое доброе дело — уничтожает спрятавшихся в макрофаге бактерий и, как это ни странно, вирусов. Такие наночастицы, относительно безвредные для человека, позволяют бороться с обеими страшными болезнями. По крайней мере, держать заразу под контролем.
Для борьбы с инфекцией пригодятся и соли галлия: растворяясь, они дадут в кровь ионы галлия, которые, попав из крови к бактериям, могут их уничтожить, вмешавшись в оборот железа. Пока такая способность найдена по отношению к двум крайне неприятным больничными инфекциями — Acinetobacter baumannii и Pseudomonas aeruginosa. Характерная их особенность — образование бактериальных матов в медицинском оборудовании, откуда они могут попасть в человека. Бороться с такими матами сложно, ведь его клетки защищены матриксом, сформированным ими внутри мата, да и ведут они крайне неактивный образ жизни, а в довершение ко всему еще и приобрели устойчивость к антибиотикам. Галлий же неплохо уничтожает их.
Галлий же неплохо уничтожает их.
Впрочем, никаких реальных лекарств на основе галлия пока нет, это все предварительные, хотя и многообещающие, работы. Если они приведут к практически важным результатам, судьба галлия окажется не столь печальна, как сейчас, и он перестанет тысячами тонн отлеживаться в отвалах пустой породы при переработке бокситов.
Галлий металлический 99,999% цена, описание, видео и фото как выглядит
Описание
Характеристики
Оплата и Доставка
Гарантия
Прочее
Сертификат
Отзывы (0)
Галлий металлический 99,999% цена 14900руб/кг
(галлий металл, галлий в виде металла Ga)
Минимальная партия на продажу 5гр (0,005кг)
Фасовка слитки размером 3-5см, вес слитка 50-100гр
Чистота 5N (99,999%) особо чистый, высокой чистоты
Производство Россия
ТУ 48-4-350-84
Химический состав: Галлий-основа, примесей-не более 0,001%
Всегда в наличии на складе в Москве
Быстрая доставка по Москве и регионам
Видео как выглядит галлий:
| Минимальный вес | 5 г. |
| Синонимы | особо чистый галлий |
| Формула | Ga |
| Чистота | 5N (99,999%) |
| Минимальная партия на продажу | 0,005кг (5гр) |
| Сертификат | Скачать |
| Насыпная плотность | 5,91гр/см3 |
| ГОСТ или ТУ | ТУ 48-4-350-84 |
Оплатить за нашу продукцию можно следующими способами:
1) Безналичный способ оплаты по счету согласно реквизитам. Выставим счет, заключим договор.
2) Через интернет магазин (физлица, юрлица): Банковская карта; Webmoney; Яндекс.Кошелек; Терминалы; Салоны связи; Интернет-банки; Внутренний счет платежной системы.
3) Наличными средствами на складе по факту покупки.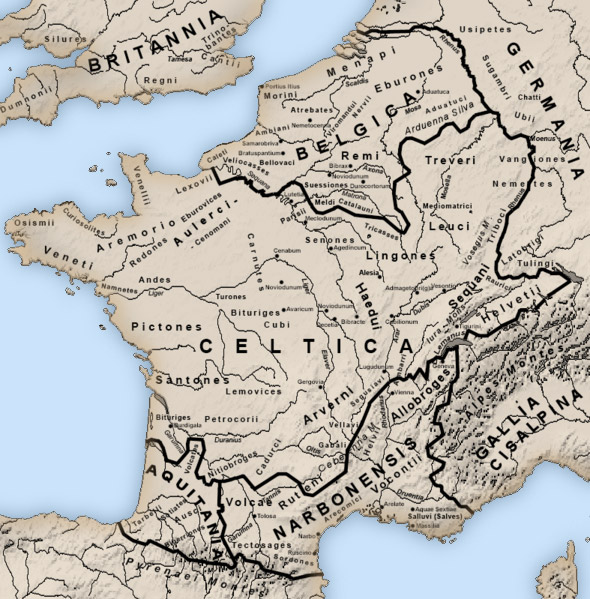 Выдадим чек.
Выдадим чек.
4) С бюджетными организациями работаем на различных условиях, в том числе с отсрочкой платежа, в том числе по 30% предоплате.
Быстро организуем доставку по Москве, регионам России, странам СНГ и дальнего зарубежья.
В среднем в зависимости от транспортных компаний, стоимость доставки следующая:
Москва 590руб-990руб
Регионы России-1300руб
Страны СНГ-3500руб
Дальнее зарубежье-6500руб
Виды доставок и транспортные компании:
1) Доставка через транспортные компании: Деловые Линии, ПЭК, СДЭК, и т.д. Срок доставки от 2х дней
2) Курьерская экспресс доставка: Курьер экспресс, Пони экспресс, Достависта и т.д. Срок доставки от 1 дня
Друзья. Самое главное, что нужно знать о нас, так это то, что в случае если по какой-либо причине, объективной ли, субъективной ли, вас не устроило или не устроит качество купленного у нас товар, мы быстро, без всяких долгих разбирательств, бумаг и бюрократий вернем вам деньги обратно. Может вы проснулись не в духе, может вы чаю не выпили, может погода повлияла, но если вы вдруг решили вернуть товар обратно, то ничего не нужно выдумывать, просто сообщите нам об этом любым удобным вам способом. Максимум на возврат средств уйдет 1-2 дня, обычно это происходит день в день после возврата товара. Таким образом, мы гарантируем быстрый возврат уплаченных вами средств.
Максимум на возврат средств уйдет 1-2 дня, обычно это происходит день в день после возврата товара. Таким образом, мы гарантируем быстрый возврат уплаченных вами средств.
Далее
1) Мы гарантируем что наши цены одни из самых дешевых на рынке. Сообщите пожалуйста если нашли дешевле и мы тут же снизим цену.
2) Мы гарантируем, что товары выложенные у нас на сайте, всегда в наличии на нашем складе, т.е. мы не тратим время на поиски или перекупку у другого поставщика.
3) Мы гарантируем быструю доставку товара. Так как товары представленные на нашем сайте всегда в наличии, то остается лишь транспортной компании забрать у нас груз
4) Мы гарантируем что заявленные на сайте характеристики соответствуют фактическим.
Акции, скидки, распродажа
Отправить заявку или заказать обратный звонок
Купить продукцию: [email protected] или (495) 923-81-68
Сертификаты
Специалисты компании
Справочник
Схема проезда
Гарантии на покупку
Всегда в наличии
Продукция в интернет-магазине, всегда в наличии на нашем складе. Смело оплачивайте.
Смело оплачивайте.
Точное соответствие
Заявленные на сайте характеристики продукции соответствуют фактическим.
Вернем деньги
Если не устроит качество или просто передумаете-быстро вернем деньги, без долгих процедур
Принимаю Условия подписки
Галлий Цена, местонахождение, добыча, использование
Общие сведения
галлий — редко встречающийся химический элемент с символом элемента Ga и атомным номером 31. В периодической таблице он находится в 4-м периоде и является третьим элемент 3-й основной группы (группа 13) или группы бора. Это серебристо-белый металл, который легко сжижается. Галлий кристаллизуется не в одной из кристаллических структур, которые в противном случае часто встречаются в металлах, а в своей наиболее стабильной модификации в орторомбической структуре с димерами галлия.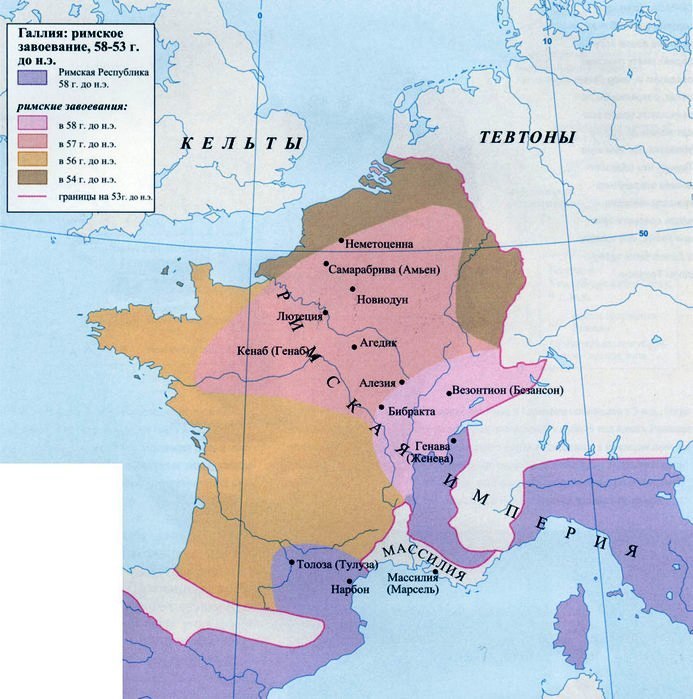 Кроме того, известны шесть других модификаций, образующихся в особых условиях кристаллизации или под высоким давлением. По своим химическим свойствам металл очень похож на алюминий.
Кроме того, известны шесть других модификаций, образующихся в особых условиях кристаллизации или под высоким давлением. По своим химическим свойствам металл очень похож на алюминий.
В природе галлий встречается лишь в небольшом количестве и в основном в виде примеси в алюминиевых, цинковых или германиевых рудах; Минералы галлия очень редки. Соответственно, его также получают как побочный продукт при производстве алюминия или цинка. Большая часть галлия перерабатывается в полупроводниковый арсенид галлия, который в основном используется для светоизлучающих диодов.
встречаемость
Галлий — редкий элемент на Земле, содержание в континентальной коре 19 ppm, его распространенность сравнима с литием и свинцом. Он не встречается в элементарном виде, а только в связанном виде, в основном в алюминиевых, цинковых или германиевых рудах. Наиболее богатые галлием руды включают бокситы, руды цинковой обманки и германит.
Содержание галлия в основном низкое, боксит, найденный в Суринаме с самым высоким известным содержанием, содержит только 0,008% галлия.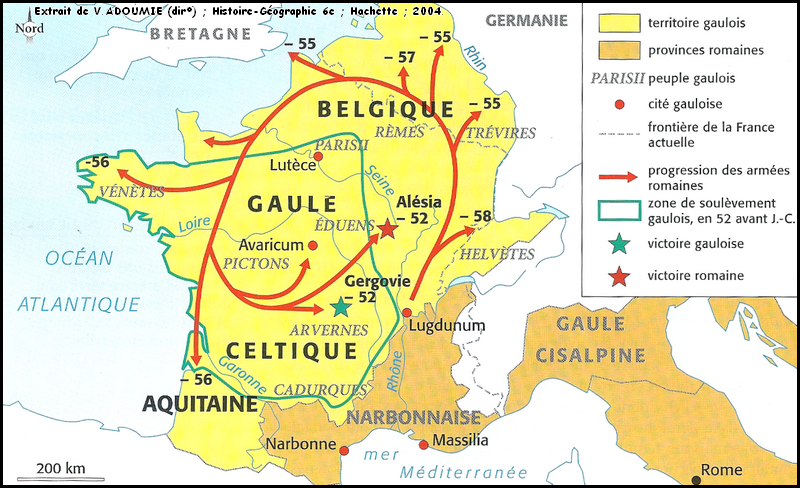 Мировые запасы галлия в бокситах оцениваются в 1,6 · 10 6 тонн. Более высокие содержания галлия до 1% встречаются в германите. Только рудник Apex в американском штате Юта имеет такое высокое содержание руды, что была предпринята попытка добывать его для извлечения галлия. Однако через короткое время это не удалось по соображениям рентабельности.
Мировые запасы галлия в бокситах оцениваются в 1,6 · 10 6 тонн. Более высокие содержания галлия до 1% встречаются в германите. Только рудник Apex в американском штате Юта имеет такое высокое содержание руды, что была предпринята попытка добывать его для извлечения галлия. Однако через короткое время это не удалось по соображениям рентабельности.
Известно лишь несколько минералов галлия, среди них галлит (CuGaS), обнаруженный в основном в Цумебе в Намибии 2 ), Зёнгейт (Ga (OH) 3 ) и цумгаллит (GaO (OH)).
Извлечение и представление
Галлий получают как побочный продукт при производстве алюминия из бокситов в процессе Байера. В качестве исходного продукта используют смесь алюмината натрия и галлата натрия, растворенных в гидроксиде натрия. Галлий можно отделить от алюминия с помощью различных процессов. Одной из возможностей является фракционная кристаллизация с помощью двуокиси углерода, при этом гидроксид алюминия вначале преимущественно осаждается, а более растворимый галлат натрия накапливается в растворе гидроксида натрия. Гидроксид галлия осаждается только после дальнейших этапов процесса, смешанный с гидроксидом алюминия. Затем смесь растворяют в растворе гидроксида натрия и электролизом получают галлий. Поскольку этот процесс является энергоемким и трудоемким, он используется только в странах с низкими затратами, таких как Китайская Народная Республика.
Гидроксид галлия осаждается только после дальнейших этапов процесса, смешанный с гидроксидом алюминия. Затем смесь растворяют в растворе гидроксида натрия и электролизом получают галлий. Поскольку этот процесс является энергоемким и трудоемким, он используется только в странах с низкими затратами, таких как Китайская Народная Республика.
Галлий также можно получить непосредственно из раствора гидроксида натрия электролизом. Для этого используются ртутные катоды, при электролизе которых образуется амальгама галлия. Также можно добавить в раствор амальгаму натрия.
С помощью специальных гидроксихинолинов в качестве хелатирующих лигандов можно извлечь галлий из едкого натра керосином и таким образом отделить его от алюминия. Другие элементы, которые также экстрагируются, можно отделить разбавленными кислотами. Затем оставшееся соединение галлия растворяют в концентрированной соляной или серной кислоте и электролитически восстанавливают до металла.
Очень чистый галлий требуется для многих технических применений; для полупроводников, например, он может содержать только стомиллионную часть посторонних веществ. Возможными методами очистки являются вакуумная перегонка, фракционная кристаллизация или зонная плавка.
Возможными методами очистки являются вакуумная перегонка, фракционная кристаллизация или зонная плавка.
Количество производимого галлия невелико, в 2008 году мировое первичное производство составило 95 тонн. Другим важным источником является переработка отходов, содержащих галлий, из которых в 2008 году было извлечено еще 135 тонн галлия. Основными странами-производителями являются Китайская Народная Республика, Германия, Казахстан и Украина, для переработки галлия также США, Япония и Великобритания.
В лабораторных условиях галлий можно получить электролизом раствора гидроксида галлия в растворе гидроксида натрия на платиновых или вольфрамовых электродах.
- Производство сверхчистого галлия 99,99999%
Свойства
Физические свойства
Галлий — серебристо-белый, мягкий (твердость по шкале Мооса: 1,5) металл. Он имеет необычно низкую температуру плавления для металлов, которая составляет 29,76 ° C. После ртути и цезия это металл с самой низкой температурой плавления, которая также значительно ниже, чем у соседних элементов алюминия и индия. Вероятно, это связано с необычной кристаллической структурой, которая, в отличие от структур других металлов, не обладает высокой степенью симметрии и поэтому не очень стабильна. Поскольку температура кипения сравнительно высока и составляет 2204 °С, галлий имеет необычно большую площадь, в которой он находится в жидком состоянии. Из-за сложной кристаллизации жидкий галлий легко охлаждается ниже точки плавления (переохлаждение) и внезапно кристаллизуется при образовании зародышей кристаллизации.
После ртути и цезия это металл с самой низкой температурой плавления, которая также значительно ниже, чем у соседних элементов алюминия и индия. Вероятно, это связано с необычной кристаллической структурой, которая, в отличие от структур других металлов, не обладает высокой степенью симметрии и поэтому не очень стабильна. Поскольку температура кипения сравнительно высока и составляет 2204 °С, галлий имеет необычно большую площадь, в которой он находится в жидком состоянии. Из-за сложной кристаллизации жидкий галлий легко охлаждается ниже точки плавления (переохлаждение) и внезапно кристаллизуется при образовании зародышей кристаллизации.
Подобно кремнию, некоторым другим элементам и воде, галлий имеет аномалию плотности; его плотность в жидком состоянии примерно на 3,2% выше, чем в твердом состоянии. Это характерно для веществ, имеющих молекулярные связи в твердом состоянии.
Галлий диамагнитен в твердом состоянии, но становится парамагнитным в жидком состоянии (= 2,4 10 −6 при 40 °C)
Для его структур характерно образование связей галлий-галлий. Известны различные модификации, образующиеся при различных условиях кристаллизации (четыре известные модификации, от α- до δ-галлия, при нормальном давлении) и под давлением (всего еще три модификации при высоком давлении, Ga-II, Ga-III, Ga- IV). Наиболее устойчивой модификацией при комнатной температуре является α-галлий, который кристаллизуется в орторомбической слоистой структуре. Два атома, связанные друг с другом ковалентной связью, образуют димер. Каждый атом галлия также соседствует с шестью другими атомами других димеров. Металлические связи существуют между отдельными димерами. Димеры галлия настолько стабильны, что первоначально сохраняются даже при плавлении, а также могут быть обнаружены в газовой фазе.
Известны различные модификации, образующиеся при различных условиях кристаллизации (четыре известные модификации, от α- до δ-галлия, при нормальном давлении) и под давлением (всего еще три модификации при высоком давлении, Ga-II, Ga-III, Ga- IV). Наиболее устойчивой модификацией при комнатной температуре является α-галлий, который кристаллизуется в орторомбической слоистой структуре. Два атома, связанные друг с другом ковалентной связью, образуют димер. Каждый атом галлия также соседствует с шестью другими атомами других димеров. Металлические связи существуют между отдельными димерами. Димеры галлия настолько стабильны, что первоначально сохраняются даже при плавлении, а также могут быть обнаружены в газовой фазе.
Дальнейшие модификации образуются при кристаллизации переохлажденного жидкого галлия. При -16,3 °С образуется β-галлий, имеющий моноклинную кристаллическую структуру. В структуре присутствуют параллельные зигзагообразные цепочки атомов галлия. Если кристаллизация происходит при температуре -19,4 °С, образуется тригональный δ-галлий, в котором, по сравнению с α-бором, имеются искаженные икосаэдры, состоящие из двенадцати атомов галлия. Они связаны друг с другом через отдельные атомы галлия. При -35,6 °С окончательно образуется γ-галлий. В этой орторомбической модификации трубки формируются из соединенных между собой Ga 7 Кольца в середине линейной цепочки других атомов галлия.
Они связаны друг с другом через отдельные атомы галлия. При -35,6 °С окончательно образуется γ-галлий. В этой орторомбической модификации трубки формируются из соединенных между собой Ga 7 Кольца в середине линейной цепочки других атомов галлия.
Если галлий поместить под высокое давление при комнатной температуре, то при повышении давления одна за другой образуются различные барические модификации. Кубическая модификация галлия-II стабильна выше 30 кбар, в которой каждый атом окружен еще восемью. Если давление увеличить до 140 кбар, металл теперь кристаллизуется в виде тетрагонального галлия-III со структурой, соответствующей структуре индия. При дальнейшем увеличении давления примерно до 1200 кбар окончательно формируется гранецентрированная кубическая структура галлия IV.
Химические свойства
Химические свойства галлия аналогичны свойствам алюминия. Таким образом, галлий пассивируется за счет образования на воздухе плотного оксидного слоя и не вступает в реакцию. Только в чистом кислороде при высоком давлении металл сгорает ярким пламенем с образованием оксида. Точно так же он не реагирует и с водой, так как здесь образуется нерастворимый гидроксид галлия. Если, с другой стороны, галлий сплавляется с алюминием и является жидким при комнатной температуре из-за понижения температуры плавления, он очень бурно реагирует с водой. Галлий также быстро реагирует с галогенами с образованием соответствующих солей GaX 9.0025 3 .
Только в чистом кислороде при высоком давлении металл сгорает ярким пламенем с образованием оксида. Точно так же он не реагирует и с водой, так как здесь образуется нерастворимый гидроксид галлия. Если, с другой стороны, галлий сплавляется с алюминием и является жидким при комнатной температуре из-за понижения температуры плавления, он очень бурно реагирует с водой. Галлий также быстро реагирует с галогенами с образованием соответствующих солей GaX 9.0025 3 .
Галлий амфотерен и растворим как в кислотах, так и в основаниях с выделением водорода. В кислотах, как и в алюминии, образуются соли с Ga 3+ Ионы, в основаниях галлаты вида [Ga(OH) 4 ] — . Медленно растворяется в разбавленных кислотах и быстро в царской водке и концентрированном едком натре. Галлий пассивируется азотной кислотой.
- Реакция галлия с едким натром
Большинство металлов разъедает жидкий галлий, поэтому его можно хранить только в емкостях из кварца, стекла, графита, оксида алюминия, вольфрама до 800 °С и тантала до 450 °С.
изотоп
Всего известно 30 изотопов галлия между 56 Ga и 86 Ga и еще семь основных изомеров. Из них два 69 Ga и 71 Ga стабильны и также встречаются в природе. В природном изотопном составе преобладает 69 Ga с 60,12 %, 39,88 % приходится на 71 Ga. время жизни варьируется от секунд до максимум 14,1 часов 72 Ga.
Два изотопа галлия, 67 Ga и короткоживущий с периодом полураспада 67,71 минуты 68 Ga, используются в ядерной медицине в качестве индикаторов для позитронно-эмиссионной томографии. 67 Ga производится в циклотроне, тогда как при производстве 68 циклотрон не требуется. Вместо этого долгоживущий изотоп германия 68 Ge при облучении 69 Ga генерируется протонами. Это распадается 68 Ga, в результате чего 68 Ga можно извлечь в генераторе галлия-68. Для исследований галлий обычно связывают в комплекс с сильно хелатирующим лигандом, таким как 1,4,7,10-тетраазациклододекан-1,4,7,10-тетрауксусная кислота (DOTA).
Использование
Из-за редкости этого элемента галлий используется лишь в ограниченной степени. Различные соединения галлия производятся из большей части произведенного галлия. Наиболее экономически важными на сегодняшний день являются те, которые содержат элементы 5-й основной группы, прежде всего арсенид галлия, который требуется, среди прочего, для солнечных элементов и светодиодов. В 2003 году 9Для этой цели было использовано 5% произведенного галлия. Он также служит материалом для легирования кремния (p-легирование).
Большой диапазон температур, в котором элемент находится в жидком состоянии, и в то же время низкое давление паров используются для изготовления термометров. Галлиевые термометры можно использовать до температуры 1200°С. Жидкий галлий можно использовать в качестве барьерной жидкости для измерения объема газов при более высоких температурах и в качестве материала жидкого электрода при извлечении сверхчистых металлов, таких как индий.
Галлий обладает высокой смачиваемостью и хорошей отражательной способностью и поэтому используется в качестве покрытия для зеркал. Он также используется в плавленых сплавах, для теплообменников в ядерных реакторах и в качестве замены ртути в лампах.
Сплавы галлия с другими металлами имеют различное применение. Магнитные материалы создаются сплавлением с гадолинием, железом, иттрием, литием и магнием. Сплав с ванадием в составе V 3 Ga является сверхпроводником со сравнительно высокой температурой перехода 16,8 К. В ядерном оружии его сплавляют с плутонием для предотвращения фазовых переходов. Многие сплавы галлия, такие как галинстан, жидкие при комнатной температуре и могут заменить токсичную ртуть или очень реакционноспособные сплавы натрия и калия.
доказательство
Галлий можно обнаружить качественно с помощью различных типичных цветовых реакций. К ним относятся реакция с родамином B в бензоле, который при добавлении галлия флуоресцирует от оранжево-желтого до красно-фиолетового, морин, который показывает зеленую флуоресценцию, как в реакции с алюминием, и гексацианидоферрат калия (III), с галлием в виде белого осадка. форм гексацианоферрата (III) галлия. Кроме того, возможно спектроскопическое обнаружение по характерным фиолетовым спектральным линиям при 417,1 и 403,1 нм.
форм гексацианоферрата (III) галлия. Кроме того, возможно спектроскопическое обнаружение по характерным фиолетовым спектральным линиям при 417,1 и 403,1 нм.
Количественные доказательства могут быть получены с помощью комплексонометрического титрования, например, с этилендиаминтетрауксусной кислотой или с помощью атомно-абсорбционной спектрометрии.
Токсикология и биологическое значение
Для металлического галлия нет токсикологических данных; однако он вызывает разъедание кожи и слизистых оболочек. Соединения нитрат галлия (III) Ga (NO 3 ) 3 и оксид галлия (III) Ga 2 O 3 обладают пероральной ЛД 50 Значения в граммах: 4360 г/кг для нитрата и 10 г/кг для оксида. Поэтому галлий считается низкотоксичным и, насколько известно, не играет никакой роли в организме человека в качестве микроэлемента.
Соединения
В соединениях галлий встречается почти исключительно в степени окисления +3. Кроме того, известны редкие и обычно очень нестабильные соединения галлия (I), а также соединения, содержащие как одно-, так и трехвалентный галлий (формально соединения галлия (II)).
Кроме того, известны редкие и обычно очень нестабильные соединения галлия (I), а также соединения, содержащие как одно-, так и трехвалентный галлий (формально соединения галлия (II)).
Соединения с элементами группы азота
Технически наиболее важными соединениями галлия являются соединения с элементами группы азота. Нитрид галлия, фосфид галлия, арсенид галлия и антимонид галлия являются типичными полупроводниками (полупроводники III-V) и используются для транзисторов, диодов и других компонентов в электронике. В частности, на соединениях групп галлия и азота производятся светодиоды различных цветов. Цвет, зависящий от ширины запрещенной зоны, можно регулировать разным соотношением анионов или заменой галлия алюминием или индием. Арсенид галлия также используется для солнечных батарей. Они используются, в частности, в спутниках, поскольку арсенид галлия более устойчив к ионизирующему излучению, чем кремний.
галогениды
Галиды галлия формы GaX 3 по многим свойствам аналогичны соответствующим соединениям алюминия. За исключением фторида галлия (III), они встречаются в виде димеров в структуре бромида алюминия. Хлорид галлия (III) — единственный галогенид, имеющий небольшое экономическое значение. Он используется в качестве кислоты Льюиса в реакциях Фриделя-Крафтса.
За исключением фторида галлия (III), они встречаются в виде димеров в структуре бромида алюминия. Хлорид галлия (III) — единственный галогенид, имеющий небольшое экономическое значение. Он используется в качестве кислоты Льюиса в реакциях Фриделя-Крафтса.
Прочие соединения
Подобно оксиду алюминия, оксид галлия (III) представляет собой бесцветное тугоплавкое твердое вещество. Встречается в пяти различных модификациях, наиболее стабильной из которых является кубическая бета-модификация.
Органические соединения галлия существуют как галлан GaR 3 , галлилен GAR и как высшие галланы , которые содержат галлий-галлиевые связи. Как и многие другие металлоорганические соединения, они неустойчивы к воздуху и гидролизу. Одним из немногих органических соединений галлия, имеющих экономическое значение, является триметилгаллий, который используется в качестве легирующего реагента и для получения тонких слоев арсенида галлия и нитрида галлия в металлоорганической эпитаксии в газовой фазе.
| Общий | |||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Название, условное обозначение, атомный номер | Галлий, Джорджия, 31 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Серия | Металлы | ||||||||||||||||||||||||||||||||||||||||||||||||
| Группа, точка, блок | 13, 4, стр | ||||||||||||||||||||||||||||||||||||||||||||||||
| Внешний вид | серебристо-белый | ||||||||||||||||||||||||||||||||||||||||||||||||
| Номер CAS | 7440-55-3 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Массовая доля земной оболочки | 14 частей на миллион | ||||||||||||||||||||||||||||||||||||||||||||||||
| Атомный | |||||||||||||||||||||||||||||||||||||||||||||||||
| атомная масса | 69,723 у | ||||||||||||||||||||||||||||||||||||||||||||||||
| Атомный радиус (расчетный) | 130 (136) вечера | ||||||||||||||||||||||||||||||||||||||||||||||||
| Ковалентный радиус | 122 вечера | ||||||||||||||||||||||||||||||||||||||||||||||||
| Радиус Ван-дер-Ваальса | 187 вечера | ||||||||||||||||||||||||||||||||||||||||||||||||
| электронная конфигурация | [Ar] 3d 10 4s 2 4p 1 | ||||||||||||||||||||||||||||||||||||||||||||||||
1. ионизация ионизация | 578,8 кДж/моль | ||||||||||||||||||||||||||||||||||||||||||||||||
| 2. ионизация | 1979,3 кДж/моль | ||||||||||||||||||||||||||||||||||||||||||||||||
| 3. ионизация | 2963 кДж/моль | ||||||||||||||||||||||||||||||||||||||||||||||||
| Физически | |||||||||||||||||||||||||||||||||||||||||||||||||
| Физическое состояние | фиксированный | ||||||||||||||||||||||||||||||||||||||||||||||||
| модификации | семь | ||||||||||||||||||||||||||||||||||||||||||||||||
| плотность | 5,904 г/см 3 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Твердость по шкале Мооса | 1,5 | ||||||||||||||||||||||||||||||||||||||||||||||||
| магнетизм | диамагнитный (= -2,3 10 −5 ) | ||||||||||||||||||||||||||||||||||||||||||||||||
| температура плавления | 302,91 К (29,76°С) | ||||||||||||||||||||||||||||||||||||||||||||||||
| точка кипения | 2477 К (2204°С) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Молярный объем | 11,80 · 10 −6 м 3 / моль | ||||||||||||||||||||||||||||||||||||||||||||||||
| Теплота парообразования | 256 кДж/моль | ||||||||||||||||||||||||||||||||||||||||||||||||
| теплота плавления | 5,59 кДж/моль | ||||||||||||||||||||||||||||||||||||||||||||||||
| скорость звука | 2740 м/с при 293,15 К | ||||||||||||||||||||||||||||||||||||||||||||||||
| Удельная теплоемкость | 371 Дж/(кг·К) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Электропроводность | около 7,14 · 10 6 А / (В · м) | ||||||||||||||||||||||||||||||||||||||||||||||||
| теплопроводность | 29 Вт/(м·К) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Химическая | |||||||||||||||||||||||||||||||||||||||||||||||||
| степени окисления | 3 | ||||||||||||||||||||||||||||||||||||||||||||||||
| нормальный потенциал | −0,53 В (Ga 3+ + 3 e — → Ga) | ||||||||||||||||||||||||||||||||||||||||||||||||
| электроотрицательность | 1,81 (шкала Полинга) | ||||||||||||||||||||||||||||||||||||||||||||||||
| изотоп | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| инструкции по технике безопасности | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
Цены на галлий, графики, цена 02
Для чего используется галлий?
НАУКА — Физические науки
Задумывались ли вы когда-нибудь…
- Что такое галлий?
- Для чего используется галлий?
- Что делает галлий уникальным?
Теги:
Просмотреть все теги
- Наука,
- Физические науки,
- Элемент,
- Периодическая таблица,
- Галлий,
- Металл,
- Поль-Эмиль Лекок де Буабодран,
- Франция,
- Галлия,
- Точка плавления,
- Точка кипения,
- Кремний,
- Мышьяк,
- Арсенид галлия,
- Электроника,
- Наука,
- Физические науки,
- Элемент,
- Периодическая таблица,
- Галлий,
- Металл,
- Поль-Эмиль Лекок де Буабодран,
- Франция,
- Галлия,
- Точка плавления,
- Точка кипения,
- Кремний,
- Мышьяк,
- Арсенид галлия,
- Электроника
Сегодняшнее чудо дня было вдохновлено Брентом. Брент Уондерс , « Откуда берется галлий? ”Спасибо, что ДУМАЕТЕ вместе с нами, Брент!
Брент Уондерс , « Откуда берется галлий? ”Спасибо, что ДУМАЕТЕ вместе с нами, Брент!
Насколько хорошо вы знакомы с периодической таблицей? Большинство людей знают об общих элементах, таких как водород и кислород. Возможно, вы слышали о некоторых других, таких как золото и серебро. Но есть один многообещающий элемент, о котором многие люди мало знают. О чем мы говорим? Галлий!
Впервые обнаруженный в 1875 году, галлий был назван в честь латинского слова «Франция», то есть «Галлия». Французский ученый Поль-Эмиль Лекок де Буабодран открыл галлий, работая с цинковой рудой. С тех пор галлий добывают в Китае, Германии и Казахстане.
В природе галлий найти сложно. Он составляет около 0,0019 процента земной коры. И он никогда не находится сам по себе! Вместо этого его необходимо отделить от других материалов с помощью процесса, называемого плавлением.
Возможно, вы уже знаете, что элементы делятся на три категории. Это могут быть металлы, металлоиды или неметаллы. Галлий — это металл, но он обладает некоторыми довольно уникальными свойствами. Например, у него очень низкая температура плавления. Он плавится и становится жидкостью при температуре 85ºF (29ºC). На самом деле, если бы вы взяли в руки твердый кусок галлия, он бы растаял у вас в руке.
Это могут быть металлы, металлоиды или неметаллы. Галлий — это металл, но он обладает некоторыми довольно уникальными свойствами. Например, у него очень низкая температура плавления. Он плавится и становится жидкостью при температуре 85ºF (29ºC). На самом деле, если бы вы взяли в руки твердый кусок галлия, он бы растаял у вас в руке.
Даже в твердом состоянии галлий очень мягкий, почти как алюминий. Его можно было прорезать ножом. И хотя он легко плавится, его гораздо труднее кипятить. Вам нужно будет нагреть этот металл до 3,999ºF (2204ºC), чтобы он закипел.
Как бы вы узнали галлий, если бы увидели его? Когда его впервые выплавляют из железной руды, галлий имеет ярко-серебристый цвет. Но как твердый металл он становится сине-серым. Он также хрупкий и немного похож на стекло. Если галлий плавили и охлаждали несколько раз, он может показаться гладким.
Для чего используется этот уникальный элемент? Большая часть галлия используется в электронике. Это часто встречается в полупроводниках, транзисторах и очень маленьких электронных устройствах. Галлий способен превращать электричество в свет, поэтому он также используется для изготовления светодиодов. Его также можно использовать для изготовления термометров и зеркал. Галлий не используется в пищу людьми или животными, но не токсичен.
Галлий способен превращать электричество в свет, поэтому он также используется для изготовления светодиодов. Его также можно использовать для изготовления термометров и зеркал. Галлий не используется в пищу людьми или животными, но не токсичен.
Многие считают, что галлий может иметь больше применений в будущем. Когда он смешивается с мышьяком, он создает арсенид галлия. Это соединение похоже на кремний. Некоторые считают, что однажды его можно будет использовать в смартфонах и компьютерах.
Какие еще способы использования галлия вы можете придумать? Останется ли этот мягкий металл в мире электроники? Или у него будет другое применение? Только время и множество проб и ошибок покажет!
Common Core, Научные стандарты следующего поколения и Национальный совет по социальным исследованиям.»> Стандарты: NGSS.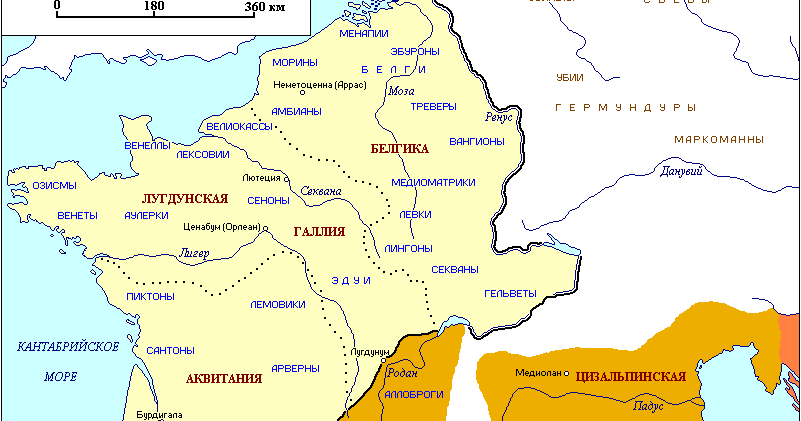 PS1.A, NGSS.PS1.B, CCRA.R.4, CCRA.L.3, CCRA.L.6, CCRA.R.1, CCRA.R.2, CCRA.R.10, CCRA .W.2, CCRA.L.1, CCRA.L.2, CCRA.SL.1
PS1.A, NGSS.PS1.B, CCRA.R.4, CCRA.L.3, CCRA.L.6, CCRA.R.1, CCRA.R.2, CCRA.R.10, CCRA .W.2, CCRA.L.1, CCRA.L.2, CCRA.SL.1
Интересно, что дальше?
Мы думаем, что YEAR действительно полюбит завтрашнее Чудо Дня!
Попробуй
Найдите взрослого, который поможет вам продолжить знакомство с заданиями, указанными ниже!
- Узнайте, какие еще элементы используются! Проверьте эту интерактивную периодическую таблицу. Узнайте как минимум еще о трех элементах, а затем напишите абзац о том, что вы узнали. Для чего используются элементы, о которых вы читали? Какие у них интересные свойства? Чем они похожи или отличаются?
- Взгляните на эти фотографии галлия. Галлий похож на что-то, о чем вы только можете подумать? Сможете ли вы идентифицировать этот металл, если увидите его? Обсудите с другом или членом семьи.
- Прочность галлия иногда сравнивают с прочностью алюминия. У вас дома есть алюминиевая фольга? Если да, попросите взрослого помочь вам оторвать небольшой кусочек.
 Держите его в руке. На что это похоже? Вы можете сложить его? Скомкать в шарик? Насколько легко порвать? Если хотите, вы можете даже попробовать некоторые из этих забавных поделок из алюминия с помощью взрослого.
Держите его в руке. На что это похоже? Вы можете сложить его? Скомкать в шарик? Насколько легко порвать? Если хотите, вы можете даже попробовать некоторые из этих забавных поделок из алюминия с помощью взрослого.
Wonder Sources
- https://periodic.lanl.gov/31.shtml (по состоянию на 15 января 2020 г.)
- https://www.britannica.com/science/gallium (по состоянию на 15 января 2020 г.)
- https://www.rsc.org/periodic-table/element/31/gallium (по состоянию на 15 января 2020 г.)
- https://www.livescience.com/29476-gallium.html (по состоянию на 15 января 2020 г.)
Вы поняли?
Проверьте свои знанияWonder Contributors
Благодарим:
Лукас, Лукас и SWAG MONSTER
за ответы на вопросы по сегодняшней теме Wonder!
Удивляйтесь вместе с нами!
Что вас интересует?
Чудо-слова
- руда
- хрупкий
- элементов
- металлоиды
- плавка
- кремний
- свойств
- расход
- полупроводники
Примите участие в конкурсе Wonder Word
Оцените это чудо
Поделись этим чудом
×ПОЛУЧАЙТЕ СВОЕ ЧУДО ЕЖЕДНЕВНО
Подпишитесь на Wonderopolis и получайте Чудо дня® по электронной почте или SMS
Присоединяйтесь к Buzz
Не пропустите наши специальные предложения, подарки и рекламные акции.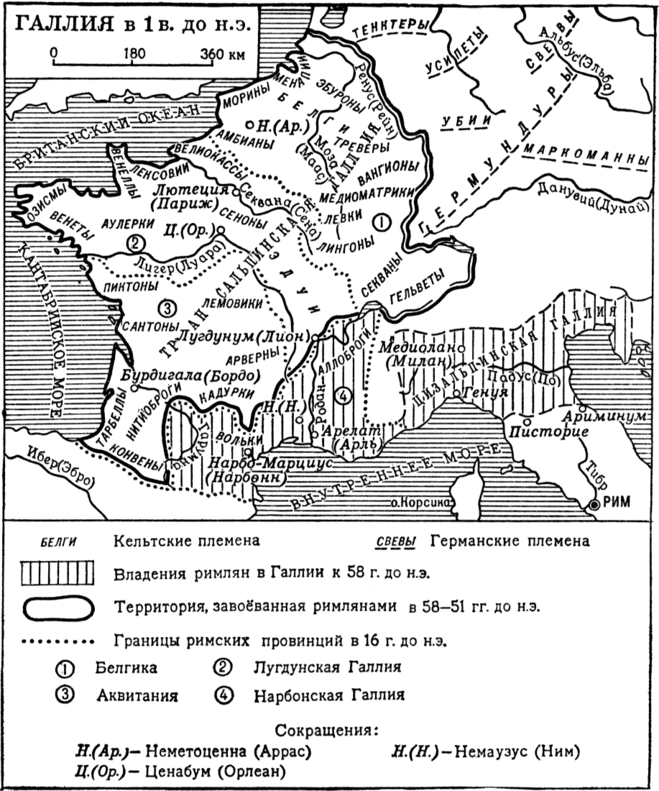

 }
} }
}