Аэрозоль для запуска двигателя «Быстрый старт»
«Даже не схватывает, ни одной вспышки!..» Стартер бодро крутит, но двигатель не заводится — знакомая ситуация? Увы, хороший аккумулятор — ещё не гарантия успешного зимнего запуска. Чем ниже температура за бортом, тем больше факторов должно совпасть, чтобы уехать не на автобусе. Помимо очевидных — исправных свечей и подходящего топлива, это и хорошая компрессия в цилиндрах, и корректность работы датчиков двигателя, и правильные пропорции топливно-воздушной смеси.
А что если создать немного смеси заранее, вручную? Легко воспламеняемой и летучей, чтобы точно попала в цилиндры и зажгла там — во всех смыслах. Примерно так и работает автохимия «Быстрый старт», позволяя обмануть блок управления двигателя и все его датчики.
Быстрый старт. Волшебный аэрозоль
Аэрозоль для запуска «Быстрый старт» — это горючая смесь эфиросодержащих жидкостей и газов, воспламеняемость которых заметно выше, чем у бензина. Состав внутри баллона может быть разным: диэтиловый эфир, петролейный эфир, пропан-бутан, гептан. Но принцип работы у всех этих средств одинаковый: создать в цилиндрах первые вспышки и привести поршни в движение, попутно разогрев камеру сгорания и свечи.
Но принцип работы у всех этих средств одинаковый: создать в цилиндрах первые вспышки и привести поршни в движение, попутно разогрев камеру сгорания и свечи.
Работу «Быстрого старта» можно сравнить с жидкостью для розжига костра: сперва загорается она, выделяя тепло, а следом — дрова и угли. В нашем случае — бензин.
Жидкость «Быстрый старт» дает шанс на успешный запуск в мороз даже изношенному двигателю с плохой компрессией и переливающими топливо форсунками. Но пользоваться ей нужно с умом.
Как пользоваться быстрым стартом
Главное правило работы с «Быстрым стартом» — применять с осторожностью. Не забывайте, что в баллоне под давлением находится весьма огнеопасный состав, который вы собираетесь выпустить наружу. Достать из багажника огнетушитель и поставить рядом на всякий случай — неплохая идея.
Самый частый вопрос у водителей: «Куда брызгать „Быстрый старт“»? Чтобы средство без помех попало в цилиндры, распылять его нужно после воздушного фильтра, приоткрыв и отогнув его короб. Ещё эффективнее снять впускной патрубок и брызгать эфиром прямо в блок дроссельных заслонок.
Ещё эффективнее снять впускной патрубок и брызгать эфиром прямо в блок дроссельных заслонок.
Не стоить увлекаться: достаточно распылить средство в течение 3–5 секунд. Если двигатель не завелся после первой порции «допинга», можно повторить процедуру ещё раз. Но после двух неудач подряд в дальнейших попытках смысла нет — очевидно, что-то не так с системой зажигания (свечами, бронепроводами или катушками, а может и с бортовой электрикой). Если свечи были сильно залиты бензином — дайте им просохнуть какое-то время, а лучше выкрутите и просушите, или смените на новые. Чудес не бывает — без искры даже «Быстрый старт» не загорится.
Кстати, помощь друга может быть весьма опасной — не пытайтесь заводить двигатель, пока кто-то распыляет «Быстрый старт» во впускной патрубок. Языки пламени могут с громким хлопком вырваться наружу, пройдя сквозь коллектор, и ваш помощник получит ожог руки. Техника безопасности проста: сперва брызгаем, и лишь затем пробуем заводиться.
Быстрый старт для дизеля
На дизелях «быстрый старт» применяют с рядом оговорок. С одной стороны, большинство продающихся средств универсальны. RUNWAY STARTING FLUID, HI-GEAR START-UP, ABRO STARTING FLUID — все они предназначены как для бензиновых, так и для дизельных моторов. С другой стороны, наличие в конструкции дизеля свечей накаливания вносит свои коррективы. Попав на раскаленные свечи, эфир может сдетонировать при обратном движении поршня (в противофазе), что грозит «фаершоу» под капотом и даже повреждением клапанов.
С одной стороны, большинство продающихся средств универсальны. RUNWAY STARTING FLUID, HI-GEAR START-UP, ABRO STARTING FLUID — все они предназначены как для бензиновых, так и для дизельных моторов. С другой стороны, наличие в конструкции дизеля свечей накаливания вносит свои коррективы. Попав на раскаленные свечи, эфир может сдетонировать при обратном движении поршня (в противофазе), что грозит «фаершоу» под капотом и даже повреждением клапанов.
Для безопасного использования «Быстрого старта» в дизеле лучше временно отключить свечи накаливания, вытащив соответствующее реле (Glow plug relay в блоке предохранителей). Или хотя бы активировать стартер максимально быстро, не задерживаясь при включении зажигания, чтобы свечи не успели раскалиться.
Вреден ли быстрый старт
Конечно, подобный взрывной запуск — не самая полезная процедура; двигатель стартует довольно жестко, испытывая повышенные нагрузки. Но если использовать «Быстрый старт» редко и по инструкции, то негативных последствий для техники не будет.
В составе хороших аэрозолей есть смазывающие добавки, чтобы исключить сухое трение в момент запуска и не допустить микрозадиров на стенках цилиндров. Тем не менее, «Быстрый старт» должен оставаться средством на экстренный случай, а не ежедневным ритуалом. Если двигатель заводится в мороз только с «допингом» — не мучайте машину, займитесь поиском причин. Не стоит пользоваться «Быстрым стартом» постоянно, как героиня видео:
Народные методы
В интернете можно найти инструкции по самостоятельному изготовлению «Быстрого старта» из горючих жидкостей и масла. Это классические вредные советы — не пытайтесь сделать средство для запуска двигателя по народным рецептам! Относительную безопасность фирменных аэрозолей обеспечивает летучесть эфиров — они быстро испаряются из впускного тракта, не скапливаясь внутри. А вот самодельный «розжиг» из керосина или ацетона — реальный шанс устроить под капотом пожар и спалить всю машину. Лучше всё-таки на автобусе.
Перспективные направления химической переработки углеводородного cырья — Переработка
Химическая переработка природного газа чаще всего ассоциируется с производством удобрений. И действительно, именно синтетические удобрения в течение многих лет были основным продуктом газопереработки, точнее сказать, газохимической переработки. А такие продукты как этилен, пропилен и целый ряд их производных традиционно вырабатываются из нафты. Цены на нафту, например, в Европе привязаны к ценам на нефть со всеми вытекающими последствиями. Дешевле получать эти продукты из этана, то есть на основе природного газа. Сегодня доля этана, используемого для получения наиболее крупнотоннажного базового полупродукта этилена, составляет в США свыше 40%, в Канаде – свыше 70%. Полностью на этановом сырье в США работает ряд крупных этиленовых установок, в частности, компаний Du Pont, Mobil Corp., Westlike Polymers и др., в Канаде – крупные этиленовые установки компаний NOVA Chemicals и Dow Chemical.
И действительно, именно синтетические удобрения в течение многих лет были основным продуктом газопереработки, точнее сказать, газохимической переработки. А такие продукты как этилен, пропилен и целый ряд их производных традиционно вырабатываются из нафты. Цены на нафту, например, в Европе привязаны к ценам на нефть со всеми вытекающими последствиями. Дешевле получать эти продукты из этана, то есть на основе природного газа. Сегодня доля этана, используемого для получения наиболее крупнотоннажного базового полупродукта этилена, составляет в США свыше 40%, в Канаде – свыше 70%. Полностью на этановом сырье в США работает ряд крупных этиленовых установок, в частности, компаний Du Pont, Mobil Corp., Westlike Polymers и др., в Канаде – крупные этиленовые установки компаний NOVA Chemicals и Dow Chemical.
Интерес к развитию газохимического сектора в газовых компаниях понятен. Анализ ценовых характеристик природного газа, извлекаемых из него углеводородов, первичных газохимических полупродуктов и мономеров, а также получаемых из них синтетических полимеров и химических продуктов, свидетельствует о стремительном нарастании цен на продукцию по мере углубления химической переработки газа. Так, если соотношение цены исходного природного газа и цены индивидуальных углеводородов и синтезируемого из метана метанола, извлекаемых из этансодержащего природного газа и газового конденсата, составляет 1:2, соотношение цены газа и полиэтилена (полипропилена), получаемых из индивидуальных углеводородов, — 1:10, то соотношение цены газа и таких продуктов газохимии, как полиацеталей, поливинилацетата, полиметилметакрилата, поликарбоната и других специальных пластмасс и химикатов, находится в интервале 1: (20÷40) [9].
Так, если соотношение цены исходного природного газа и цены индивидуальных углеводородов и синтезируемого из метана метанола, извлекаемых из этансодержащего природного газа и газового конденсата, составляет 1:2, соотношение цены газа и полиэтилена (полипропилена), получаемых из индивидуальных углеводородов, — 1:10, то соотношение цены газа и таких продуктов газохимии, как полиацеталей, поливинилацетата, полиметилметакрилата, поликарбоната и других специальных пластмасс и химикатов, находится в интервале 1: (20÷40) [9].
Основной и наиболее удобный во всех отношениях энергоресурс современной экономики – нефть, но ее запасы ограничены и быстро истощаются. На сегодняшний день из недр уже извлечена половина ее первоначальных запасов [1], что неизбежно привело к падению объемов добычи и росту цены на нефть [1-3]. Согласно обзору Бритиш Петролеум [4] 65% всех доказанных ресурсов нефти сосредоточено на Ближнем Востоке. На долю России приходится всего 5%.
Ресурсы каменного угля огромны и распределены более равномерно. Наибольшими запасами обладают три страны США, КНР и Россия ( примерно по 25% мировых ресурсов). Объем мировой добычи угля увеличивается, и уголь частично отвоевывает некогда утраченные позиции. Велика доля угля в производстве электроэнергии : в КНР около 75%, в США — более 50%. Однако низкая производительность труда при добыче и транспортировке угля, а также серьезные экологические проблемы, связанные с его использованием в энергетике, сдерживают масштабы его применения. Департамент энергетики США выступил с инициативой разработки более чистых способов получения энергии из угля [5].
Наибольшими запасами обладают три страны США, КНР и Россия ( примерно по 25% мировых ресурсов). Объем мировой добычи угля увеличивается, и уголь частично отвоевывает некогда утраченные позиции. Велика доля угля в производстве электроэнергии : в КНР около 75%, в США — более 50%. Однако низкая производительность труда при добыче и транспортировке угля, а также серьезные экологические проблемы, связанные с его использованием в энергетике, сдерживают масштабы его применения. Департамент энергетики США выступил с инициативой разработки более чистых способов получения энергии из угля [5].
Предполагается, что типовая угольная электростанция 21 века будет использовать в качестве топлива не непосредственно уголь, а синтез газ или водород, полученные путем предварительной газификации угля. Необходимый для газификации кислород будут получать относительно дешевым мембранным разделением воздуха. Из очищенного от серо- и азотсодержащих соединений и твердых примесей синтез-газа на основе мембранных технологий будут выделять водород, используемый в качестве экологически чистого топлива для газовых турбин и топливных элементов.
В моменты минимума нагрузки часть полученного синтез-газа будет использоваться для выработки синтетических жидких углеводородов (СЖУ), необходимых для замещения истощающихся природных нефтяных ресурсов и производства синтетических моторных топлив, отвечающих новым жестким экологическим стандартам. Таким образом, основная ставка делается на передовые газохимические технологии производства и использования вторичных энергоресурсов.
Природный газ (ПГ) появился на арене мировой энергетики относительно поздно, лишь во второй половине двадцатого века, и в отличие от угля и нефти никогда не выступал в роли основного энергоресурса. Его доказанные [4] мировые ресурсы велики ( около 155 трлн м3) и постоянно пересматриваются в сторону увеличения.
Ежегодная мировая добыча ПГ составляет около 2.5 трлн м3. Располагая 12.8% мировой территории и 2.8% населения, Россия обладает 34% доказанных и более 40% потенциальных запасов природного газа. Именно это национальное богатство делает Россию ведущей энергетической державой XXI века.
Существуют еще огромные запасы метана в виде твердых газовых гидратов. По оценкам [6-8] ресурсы гидратного метана составляют около 20 тыс. трлн м3, т.е. минимум на два порядка превышают его традиционные запасы. В 1 м3 гидрата метана содержится до 165 м3 газа при нормальных условиях [8]. Активная разработка методов промышленной эксплуатации газогидратных месторождений в настоящее время ведется в США и Японии.
Природный газ по запасам, экономичности добычи и возможности использования, экологическим свойствам является наиболее перспективным ресурсом способным обеспечить потребности человечества в энергии и углеводородном сырье, по крайней мере, в течение текущего столетия. Природный газ и газохимия могут сыграть в мировой экономике и энергетике XXI века такую же роль, какую сыграли в XX веке нефть и нефтехимия.
Природный газ и газохимия могут сыграть в мировой экономике и энергетике XXI века такую же роль, какую сыграли в XX веке нефть и нефтехимия.
На схеме 1 показана совокупность процессов переработки углеродсодержащего сырья в моторные топлива и олефины. Первая стадия почти во всех случаях является окислительной. Для природного газа это различные виды конверсии ( риформинга), для твердых углеродсодержащих материалов – газификация. На второй стадии альтернативными направлениями являются синтез Фишера-Тропша (ФТ), синтез метанола и/или диметилового эфира (ДМЭ). Последние в, свою очередь, могут быть преобразованы в высокооктановый бензин, олефины, а также могут непосредственно использованы как моторное топливо или добавки к нему. Относительно новым направлением является использование метанола и ДМЭ в качестве источника водорода для нужд водородной энергетики [ 11].
Схема 1
Выбор процесса переработки синтез-газа обусловливает требования к его составу, в основном к отношению Н2/СО, что в свою очередь влияет на выбор метода переработки исходного природного газа или иного сырья. Наиболее жестки эти требования для синтеза метанола (Н2/СО >2 ). В результате получают преимущество паровой и парокислородный риформинг природного газа, а для синтез-газа, получаемого в других процессах, требуется его обогащение водородом. Синтез ДМЭ, как и синтез Фишера – Тропша, менее прихотлив, так что становится приемлемым синтез – газ, полученный в углекислотном реформинге метана или при его окислении кислородом, при газификации угля и т.д.
Наиболее жестки эти требования для синтеза метанола (Н2/СО >2 ). В результате получают преимущество паровой и парокислородный риформинг природного газа, а для синтез-газа, получаемого в других процессах, требуется его обогащение водородом. Синтез ДМЭ, как и синтез Фишера – Тропша, менее прихотлив, так что становится приемлемым синтез – газ, полученный в углекислотном реформинге метана или при его окислении кислородом, при газификации угля и т.д.
В этом обзоре рассмотрим из схемы 1 пути превращения, показанные в Схеме 2:
Схема 2.
Метанол служит сырьем для производства формальдегида, уксусной кислоты, карбамидных смол, МТБЭ (антидетонатор) и других компонентов моторного топлива, пентаэритрита, поливинилового спирта, ацеталей и многих других химических продуктов. Впервые получение метанола из синтез-газа осуществлен в 1923 году в Германии фирмой BASF. Процесс проводился под давлением 200-350 атм на оксидных цинк-хромовых катализаторах в интервале температур 350-450
Процесс проводился под давлением 200-350 атм на оксидных цинк-хромовых катализаторах в интервале температур 350-450
В Советском Союзе в 70-80 гг. ХХ века были спроектированы и построены несколько отечественных агрегатов М-100 (сто тысяч тонн метанола в год), М-300 ( 300 тыс. т/год) по новой технологии, а также созданы и произведены в промышленном масштабе для них катализаторы СНМ-1, СНМ-3, СНМ-У.
На рынке метанола лицензиарами являются фирмы ICI, Davy Power Gas (UK), Methanex, Statoil, Foster Wheeler, Haldor Topsoe[23], Lurgi, Methanol Casale,
НИИхимтехнология ( Украина ). В настоящее время мировое производство метанола уже достигло 66 млн т/год [ 10] .и по прогнозам [12] к 2025 году оно может удвоиться. Метанол является удобным энергоносителем, который можно использовать в качестве моторного, котельного и газотурбинного топлива. Потенциальный мировой рынок метанола включает получение из него таких химических полупродуктов, как этилен и пропилен. В 2016 году Россия произвела 3,7млн.тонн метанола. Крупнейшими его производителями в России являются в настоящее время ООО «Метафракс»[28], «Сибметахим», «Томет».
В настоящее время мировое производство метанола уже достигло 66 млн т/год [ 10] .и по прогнозам [12] к 2025 году оно может удвоиться. Метанол является удобным энергоносителем, который можно использовать в качестве моторного, котельного и газотурбинного топлива. Потенциальный мировой рынок метанола включает получение из него таких химических полупродуктов, как этилен и пропилен. В 2016 году Россия произвела 3,7млн.тонн метанола. Крупнейшими его производителями в России являются в настоящее время ООО «Метафракс»[28], «Сибметахим», «Томет».
В настоящее время метанол является сырьем главным образом для химической промышленности. Но по оценкам зарубежных специалистов, существует несколько областей применения метанола, которые при условии разработки новых экономичных технологий, могут в значительной мере повлиять на рост спроса на этот продукт.
В частности, высокие цены на нефть диктуют необходимость применения технологии «от метанола к олефинам» («МТО»). Применение именно этой технологии целесообразно при очень низких ценах на природный газ, места добычи которого, как правило, значительно удалены от мест потребления. Эта проблема может быть решена путем строительства полного производственного комплекса, включающего переработку природного газа в метанол, метанола в олефины, олефинов в пластмассы. Альтернативой этому решению может быть транспортировка метанола на существующие крекинг- производства. [20,22].
Применение именно этой технологии целесообразно при очень низких ценах на природный газ, места добычи которого, как правило, значительно удалены от мест потребления. Эта проблема может быть решена путем строительства полного производственного комплекса, включающего переработку природного газа в метанол, метанола в олефины, олефинов в пластмассы. Альтернативой этому решению может быть транспортировка метанола на существующие крекинг- производства. [20,22].
В настоящее время разрабатывается множество технологий, предполагающих использование метанола в качестве топлива для прямого сжигания и для топливных элементов, а также для получения бензина. Продвижение технологии конвертирования метанола в бензин или другие продукты, получаемые в настоящее время только из нефти, может существенно поднять спрос на него.
Представляет интерес использование метанола в качестве дешевого топлива на силовых станциях, оборудованных газовыми турбинами с комбинированным циклом по топливу. По данным специалистов, потребуется незначительная модификация этих установок при переводе их на метанол.
По данным специалистов, потребуется незначительная модификация этих установок при переводе их на метанол.
Компания Foster Wheeler лицензировала процесс получения метанола топливного сорта. Компания планирует разработать этот процесс до коммерческого применения с целью получения метанола, который можно использовать в качестве альтернативного топлива на силовых электростанциях, работающих на сжиженном природном газе.
Компания Methanex и другие производители метанола химического сорта также рассматривают возможности выхода на этот рынок. В программы по созданию метанольных топливных элементов включились как крупнейшие компании по производству метанола – Methanex и Statoil, так и ряд автомобилестроительных фирм, в частности Форд и ДаймлерКрайслер, которые разрабатывают соответствующие двигатели.
По прогнозам, двигатели с метанольными топливными элементами могут появиться на рынке к 2015 г. По расчетам специалистов, затраты на заправочные станции для автомобилей с метанольными топливными элементами будут на приемлемом уровне, причем для этой цели могут быть переоборудованы существующие бензоколонки.
Диметиловый эфир – новый энергоноситель
Весной 1995 г. Группа всемирно известных фирм Amoco Co., Haldor Topsoe A/S, AVL Powertrain Engineering Inc., специализирующихся на нефте- и газопераработке, катализу, двигателям и транспорту, анонсировала на Международном конгрессе и выставке в Детройте новое экологически чистое дизельное топливо – диметиловый эфир (ДМЕ) [13-16 ].
Cопоставление свойств ДМЭ, традиционного дизельного топлива(ДТ) и альтернативных топлив – метанола, этанола, метана [17 ] – позволяет сделать вывод что ДМЭ как топливо для дизельного или компрессионного двигателя превосходит альтернативные, включая традиционное. Пониженная по сравнению с ДТ теплотворная способность частично окупается большей экономичностью двигателя и отсутствием затрат мощности на очистку выхлопа.
Сочетание высокого цетанового числа и низкой температуры кипения обеспечивает хороший “ холодный старт “ двигателя. В выхлопе сажа отсутствует, а содержание СО и NOX
отвечает требованиям стандартов без очистки.
В выхлопе сажа отсутствует, а содержание СО и NOX
отвечает требованиям стандартов без очистки.
Как видно из схемы 1, ДМЭ можно получать из метанола и непосредственно из синтез-газа. Некоторые показатели прямого синтеза на разработанном медьсодержащем катализаторе [ 18] по сравнению с синтезом метанола приведены в Таблице 1.
|
Процесс |
Р, МПа |
Производительность т/т кат ч |
Конверсия « за проход», % |
|
Синтез метанола ( катализатор ICI-51-2) |
8 |
0. |
10-15 |
|
Синтез ДМЭ (катали-затор ИНХС РАН ) |
10 |
0.6-1.6 |
60-89 |
Таблица 1.
Как видно, в прямом синтезе ДМЭ получают «за проход» конверсию и производительность намного выше, чем для синтеза метанола. Различия в технических показателях отражаются, естественно, на экономике. По оценке, сделанной в работе [19 ], себестоимость ДМЭ при одностадийном синтезе из синтез-газа на 10% — 15% ниже себестоимости эквивалентного количества метанола, т.е. продукт дешевле сырья для двухстадийного процесса. При этом , как отмечено в работе [11 ], процесс прямого синтеза ДМЭ “всеяден”: в нем может быть использован синтез-газ, полученный в процессах и углекислотной конверсии газа, и газификации угля, растительных остатков, и при окислении метана воздухом. Катализатор обеспечивает высокую селективность, побочными продуктами являются только метанол, СО2 и Н2О.
Катализатор обеспечивает высокую селективность, побочными продуктами являются только метанол, СО2 и Н2О.
GTL – технологии
Резкий и уже, видимо, необратимый рост цен на нефть обострил интерес к проблеме конверсии природного газа в многотоннажные легко транспортируемые продукты. Это, вероятно, наиболее реальный путь освоения громадных запасов природного газа в удаленных регионах и на континентальном шельфе. Рассматриваются несколько технологий утилизации труднодоступных запасов газа, включая процессы конверсии газа в жидкость ( Gas-to-Liquids, GTL), к которым в первую очередь относят синтетические жидкие углеводороды (СЖУ) и метанол. В этой же группе рассматриваются и сопутствующие технологии конверсии метанола в бензин ( methanol-to-gasoline, MTG), метанола в олефины ( Methanol-to-Olefins, MTO ), получение диметилового эфира (ДМЭ).
Не так давно были разработаны коммерчески оправданные способы получения олефинов из метанола, который в данном случае играет роль промежуточного продукта. Соответствующие технологии получили название МТО (Methanol to olefins) и GTO ( gas to olefins) [20].
Соответствующие технологии получили название МТО (Methanol to olefins) и GTO ( gas to olefins) [20].
Крупнейшие нефтегазовые компании мира уже обозначили свой интерес к этой проблеме, анонсировав планы проектирования и строительства новых предприятий. Это Mobil, Shell, ExxonMobil, Sasol, Rentech, Syntroleum, BP PLC, Conoco Inc., Intevep [10,31].
Наибольший опыт ( более 50 лет [24 ] ) в разработке и эксплуатации технологии GTL c использованием метода Фишера-Тропша (ФТ) имеет фирма Sasol, которая на своих заводах в ЮАР вырабатывает 4.5 млн тонн жидких продуктов в год. Синтез ФТ позволяет получить из синтез газа углеводороды в одну стадию, однако из-за широкого молекулярно-массового распределения требуется дальнейшая переработка синтезируемых углеводородов, в принципе аналогичная переработке нефти. Недостатком процесса является низкая производительность применяемых катализаторов и трудно управляемая селективность [11].
В 70 –е годы прошлого века фирма Mobil Oil создала новый синтетический катализатор на основе высококремнеземистых цеолитах, названных ZSM-5. Использование этих цеолитов в качестве носителей для катализаторов открыло возможность превращения метанола в смесь алифатических и ароматических углеводородов при температуре 350 — 400 0С и давлении 15 атм. Уникальная структура синтетических цеолитов ( определенный размер пор и каналов) ограничивает число атомов углеродов до 11 (фракция С5-С11 ), и эта смесь выкипает в пределах температур, характерных для бензиновой фракции с октановым числом 92-95 и обладает более высоким качеством по сравнению с бензином, получаемым по методу ФТ. Процесс на ZSM-5 производит смесь углеводородов, на 50% состоящую из ценных высокоразветвленных парафинов.
Фирма ExxonMobil объявила о создании установки GTO [20]. В этой технологии природный газ превращается сначала в метанол, легко транспортируемый к заказчику для переработки в олефины и далее в полимеры или в другие продукты, например, этиленгликоль (для антифризов) или перерабатываемый в олефины и далее в химикаты непосредственно на отдаленных промыслах. Новый процесс в отличие от традиционного процесса крекинга нефти, который дает соотношение этилен: пропилен = 2:1, дает больше пропилена- соотношение 1:1.
Новый процесс в отличие от традиционного процесса крекинга нефти, который дает соотношение этилен: пропилен = 2:1, дает больше пропилена- соотношение 1:1.
ИК СО РАН (Новосибирск) разработал на цеолитном носителе катализатор конверсии метанола в низкомолекулярные олефины ( этилен, пропилен) c выходом 80-90% для установки Томского НХК мощностью 450 тыс. тонн по метанолу. Побочные продукты при этом только СО2 Н2О. После разделения на установке ЭП-300, олефины будут использованы в действующих производствах полиэтилена и полипропилена [21].
Большой интерес представляет процесс получения ДМЭ в одну стадию ( см. Схему 2 ), который разработал ИНХС РАН, где создан катализатор и дано научное обоснование получения из синтез — газа ДМЭ через метанол в одну стадию. Как видно из таблицы 1, синтез ДМЭ оказался существенно более эффективным по сравнению с синтезом метанола. Дальнейшее превращение ДМЭ в моторное топливо проводится на модифицированном катализаторе типа ZSM-5. Поскольку для получения ДМЭ пригоден синтез газ практически любого состава, то для синтеза топлив можно непосредственно использовать продукты газификации разнообразных твердых углеродсодержащих материалов, применение которых оказывалось слишком дорогим для получения синтез-газа «метанольного» состава.[18].
Поскольку для получения ДМЭ пригоден синтез газ практически любого состава, то для синтеза топлив можно непосредственно использовать продукты газификации разнообразных твердых углеродсодержащих материалов, применение которых оказывалось слишком дорогим для получения синтез-газа «метанольного» состава.[18].
В конце 90 годов усилиями трех Российских институтов ИНХС РАН, ИОХ РАН и БГТУ Военмех им. Д. Ф. Устинова была построена опытно промышленная установка г.Приморск, которая работала по схеме получения бензина из газа через стадию образования ДМЭ. Качество бензина соответствовало норме Евро 5 (еще не введенному показателю на тот период времени ).
В последнее время появилось еще одно из направлений по использованию метанола или ДМЭ.
В связи с ростом дефицита нефтяных ресурсов многие отечественные и зарубежные научно-исследовательские институты начали активно разрабатывать новые методы получения ароматических углеводородов, например получение ароматических углеводородов из метанола. [32,33]. Ароматические углеводороды, особенно легкие ароматические углеводороды, такие как БТК (бензол, толуол и ксилолы), являются важными основными органическими материалами. С непрерывным развитием мировой промышленности и экономики в последние годы спрос на ароматические углеводороды непрерывно увеличивается. В настоящее время ароматические углеводороды получают в основном при помощи процессов риформинга нафты и гидрирования пиробензина, в каждом из которых в качестве сырья используют нефть. Однако стоимость производства ароматических углеводородов из нефти резко возрастает из-за непрерывного потребления нефтяных запасов и увеличения цен на них. Таким образом. В долгосрочной перспективе производство ароматических углеводородов при помощи риформинга нафты и гидрирования пиробензина может оказаться не способным удовлетворить растущую потребность в ароматических углеводородах. В то же время избыточные объемы производства метанола в глобальном масштабе стали серьезной проблемой. Таким образом, непосредственное превращение метанола в ароматические углеводороды можно рассматривать в качестве весьма перспективного направления получения ароматических углеводородов.
[32,33]. Ароматические углеводороды, особенно легкие ароматические углеводороды, такие как БТК (бензол, толуол и ксилолы), являются важными основными органическими материалами. С непрерывным развитием мировой промышленности и экономики в последние годы спрос на ароматические углеводороды непрерывно увеличивается. В настоящее время ароматические углеводороды получают в основном при помощи процессов риформинга нафты и гидрирования пиробензина, в каждом из которых в качестве сырья используют нефть. Однако стоимость производства ароматических углеводородов из нефти резко возрастает из-за непрерывного потребления нефтяных запасов и увеличения цен на них. Таким образом. В долгосрочной перспективе производство ароматических углеводородов при помощи риформинга нафты и гидрирования пиробензина может оказаться не способным удовлетворить растущую потребность в ароматических углеводородах. В то же время избыточные объемы производства метанола в глобальном масштабе стали серьезной проблемой. Таким образом, непосредственное превращение метанола в ароматические углеводороды можно рассматривать в качестве весьма перспективного направления получения ароматических углеводородов.
Таким образом, схема 2 открывает универсальный путь переработки разнообразного сырья в различные углеводородные продукты. Следует учесть, что ДМЭ и получаемые из него моторные топлива обладают повышенным экологическим качеством. Все вместе позволяет ожидать, что получаемые этим путем синтетические продукты окажутся конкурентноспособными на фоне продуктов нефтяного происхождения.
Литература:
1. Campbell C.J., Loherrene J.H., Scientific American, 1998, №3, p.78.
2. Oil & Gas J., 2002, Aug. 26, p. 33-34.
3. Parker H.W., Oil & Gas J., 2002, Feb. 25, p. 40.
4. British Petroleum Statistical Review of World Energy, 2002.
http://www.bp.com/centres/energy2002/)
5. Ritter S.K., Oil & Gas J., 2002, Oct 7, p.30-32.
6. Валяев Б., Газовая промышленность, 1997, №7, с. 6-9.
7. Якушев В.С., Истомин В.А., Там же, 2000, №7, с.34-36.
Якушев В.С., Истомин В.А., Там же, 2000, №7, с.34-36.
8. Макогон Ю,Ф., Там же, 2001, №5, с.10-16.
9. Брагинский О., Нефтегазовая вертикаль,№11, 1999.
10. Арутюнов В.С., Лапидус А.Л., Рос. хим. ж., 2003,т.XLII, №2.
11. Розовский А.Я., Лин Г.И., Изв. АН РАН, серия хим.,2004, №11, с.2352-2363.
12. Fleisch T.H., Pun R., Sills R.A. e.a., 6th Natural gas Conversion Symp Studies in Surface Science and Catalysis, Elsevier Science B V Amsterdam-London — New York-Oxford-Paris-Shannon-Tokyo, 2001, v. 136, р. 423-428.
13. Т. Fleisch, C. McCarthy, A. Basu, C. Udovich, p. Charboneau, W. Slodowske, S.E. Mikkelsen, J. McCandless, SAE Paper 950061. 1995.
14. P.Kapus and H/ Ofner, SAE Paper 950062, 1995.
15. J.B.Hansen, B. Voss, F. Joensen, I.D. Sigurdardottir, SAE Paper 950063, 1995.
16. S.C. Sorenson,S.E. Mikkelsen, SAE Paper 950064, 1995.
17. T.H. Fleisch, P.C. Meurer, Proc. AVL Conf.”Engine and Environment 1995”, Graz (Austria), 1995.
18 . Пат. РФ № 2218988, 2003; Бюл. изобрет. 2003, № 35.
19. Т. Fleisch, A. Basu, M. J. Gradassi, J. G. Masin, Natural Gas Conversion IV. Studies in Surface Science and Catalysis, 1997, 107, 117.
20. The Lamp, Vol. 86, No. 3, 2004.
21. http:// www.sbras.ict.nsc.ru/cgi-bin/vesta/sbras/adv/
22. RCCnews.ru, 4/07/2001.
23. http:// www.Haldortopsoe.com, www.topsoe.com
24. М. Джетвей, Д. Рохан, Нефтегазовая вертикаль, №2, 2000 г.
25.http:// www.ngv.ru/magazin/
26. www.marketsurveys.ru обзоры российских и мировых товарных рынков
27. www.csnt.ru ежемесячный бюлл. « Метанол в России»
28. www.metafrax.ru
29. www.RCC.ru/Rus/ обзоры цен на химические продукты
30. www.nk.kama.ru
www.nk.kama.ru
31. www.exxonmobilchemical.com
32 Пат. РФ 0002544241 , 20.03.2015
Способ получения ароматических углеводородов из природного газа и установка для его осуществления
33 ЕР (21) 201491154 , 2014.11.28. Катализатор для получения параксилола путем совместной конверсии метанола и/или диметилового эфира и сжиженного газа С4, способ приготовления этого продукта и способ его использования
https://findpatent.ru/patent/260/2607633.html
Статья «Перспективные направления химической переработки углеводородного cырья» опубликована в журнале «Neftegaz.RU» (№4, Апрель 2020)
Фармакология, под. ред. Ю. Ф. Крылова и В. М. Бобырева.
Листать назад Оглавление Листать вперёд
Для ингаляционного наркоза используются летучие жидкости: эфир диэтиловый, галотан (фторотан), трихлороэтилен (трихлорэтилен), метоксифлуран и другие, а также газы: динитроген оксид (азота закись), циклопропан. Ингаляционный наркоз легко управляем, так как ингаляционные наркозные средства быстро всасываются и также быстро выводятся через дыхательные пути.
Ингаляционный наркоз легко управляем, так как ингаляционные наркозные средства быстро всасываются и также быстро выводятся через дыхательные пути.
Эфир для наркоза или диэтиловый эфир -летучая жидкость, разлагающаяся на свету и в тепле под влиянием кислорода воздуха, имеющая температуру кипения 34-36°С. Он первым нашел широкое применение в качестве средства для наркоза.
Эфир является клеточным ядом и при местном применении оказывает небольшое противомикробное и местноанестезирующее действие, вызывая гиперемию слизистых оболочек. После фазы раздражения наблюдается понижение чувствительности тканей. При температуре тела он быстро испаряется, охлаждая и подсушивая ткани, что позволяет использовать эфир как подсушивающее, дезинфицирующее и местноанестезирующее средство.
При вдыхании паров эфира возникает наркоз. Препарат обладает выраженной наркотической активностью, большой шпротой наркотического действия и сравнительно малой токсичностью. Однако вдыхание эфира тягостно для пациента, наркоз развивается медленно (через 12-20 мин) стадия наркоза длительная, что затрудняет введение в наркоз и требует проведения премедикации (болеутоляющими, успокаивающими, миорелаксантами и М-холиноблокирующими средствами). Пробуждение после эфирного наркоза наступает через 20-40 мин, и в течение нескольких часов наблюдается посленаркозный сон. Длительно сохраняется анальгезия. Для уменьшения расхода эфира, а следовательно, и осложнений, используется эфирно-кислородный наркоз, а также сочетание эфира с азота закисью, фторотаном и другими средствами для наркоза.
Пробуждение после эфирного наркоза наступает через 20-40 мин, и в течение нескольких часов наблюдается посленаркозный сон. Длительно сохраняется анальгезия. Для уменьшения расхода эфира, а следовательно, и осложнений, используется эфирно-кислородный наркоз, а также сочетание эфира с азота закисью, фторотаном и другими средствами для наркоза.
Осложнения от применения эфирного наркоза связаны в основном с местным раздражающим и охлаждающим действием препарата. Раздражающее действие эфира на слизистую оболочку дыхательных путей может приводить к ларингоспазму, рефлекторным изменениям дыхания и сердечной деятельности, гиперсекреции, тошноте и рвоте. После эфирного наркоза возможно развитие бронхопневмонии.
Следует помнить, что эфир легко воспламеняется, а в смеси с кислородом и азота закисью — взрывается, поэтому при таком наркозе не следует применять рентгено- и электроаппаратуру (бормашину, электроножи и т.д.).
Фторотан — летучая невоспламеняющаяся жидкость. Введение в наркоз происходит быстро (через 3-5 мин), стадия возбуждения короткая.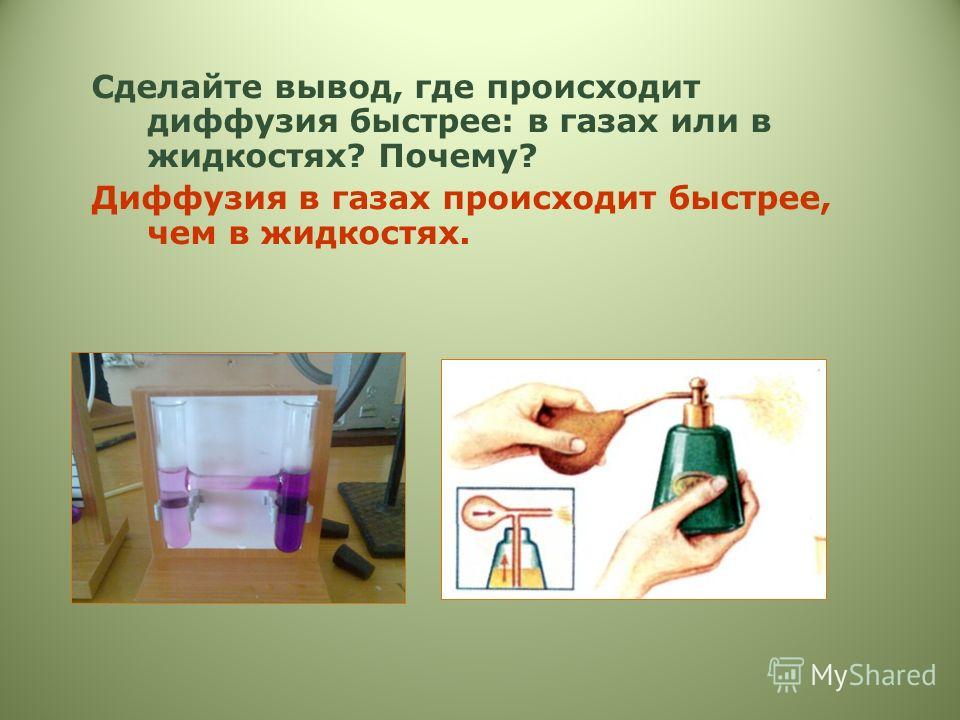 Фторотановый наркоз легко управляем. По активности фторотан в 3-4 раза превосходит эфир. Пробуждение наступает через 5-10 мин, посленаркозный сон непродолжителен. Препарат не раздражает слизистые оболочки, не вызывает нежелательных рефлекторных реакций, тошнота и рвота в посленаркозном периоде бывают редко. У фторотана практически нет анальгезирующего действия, что требует раннего назначения болеутоляющих средств после операции. Он не пригоден для ингаляционной анальгезии. Фторотан умеренно угнетает дыхательный центр. Пропорционально глубине наркоза ослабляет сократимость миокарда и снижает артериальное давление. Брадикардия, вызываемая фторотаном, связана с возбуждением блуждающего нерва и снимается введением М-холиноблокаторов (атропина). Как и другие галоидсодержащие анестетики, фторотан повышает чувствительность миокарда к адреналину, что может привести к возникновению сердечных аритмий. На фоне фторотанового наркоза не следует применять адреналин и норадреналин. Из побочных эффектов фторотана следует отметить возможность поражения печени, особенно при повторном применении.
Фторотановый наркоз легко управляем. По активности фторотан в 3-4 раза превосходит эфир. Пробуждение наступает через 5-10 мин, посленаркозный сон непродолжителен. Препарат не раздражает слизистые оболочки, не вызывает нежелательных рефлекторных реакций, тошнота и рвота в посленаркозном периоде бывают редко. У фторотана практически нет анальгезирующего действия, что требует раннего назначения болеутоляющих средств после операции. Он не пригоден для ингаляционной анальгезии. Фторотан умеренно угнетает дыхательный центр. Пропорционально глубине наркоза ослабляет сократимость миокарда и снижает артериальное давление. Брадикардия, вызываемая фторотаном, связана с возбуждением блуждающего нерва и снимается введением М-холиноблокаторов (атропина). Как и другие галоидсодержащие анестетики, фторотан повышает чувствительность миокарда к адреналину, что может привести к возникновению сердечных аритмий. На фоне фторотанового наркоза не следует применять адреналин и норадреналин. Из побочных эффектов фторотана следует отметить возможность поражения печени, особенно при повторном применении.
Трихлорэтилен -летучая жидкость, в обычных (для анестезиологии) концентрациях не воспламеняется и не взрывается. Мощное наркозное средство. Дает быстрое введение в наркоз, хорошую анальгезию как при введении в наркоз, так и после пробуждения, быстрый выход из наркоза. Применяется для кратковременного наркоза, для анальгезии при небольших хирургических вмешательствах или болезненных манипуляциях, для аутоанальгезии при сильных болях, не снимаемых наркотическими анальгетиками (инфаркт, травмы, невралгия тройничного нерва). Поскольку трихлорэтилен, повышая чувствительность сердца к катехоламинам, может спровоцировать аритмию, при его применении не следует добавлять к местным анестетикам адреналин или норадреналин.
Метоксифлуран, обладающий высокой наркотической и анальгетической активностью, дает медленное введение в наркоз и постепенный выход из наркоза, длительное сохранение анальгезии. Однако он нефротоксичен и аритмогенен (повышает чувствительность миокарда к катехоламинам). В связи с токсичностью для самостоятельного наркоза не применяется. Иногда используется для наркоза в стадии анальгезии и для аутоанальгезии.
В связи с токсичностью для самостоятельного наркоза не применяется. Иногда используется для наркоза в стадии анальгезии и для аутоанальгезии.
Хлороформ и хлорэтил, являющиеся мощными наркозными средствами, имеют малую широту наркотического действия и высокую токсичность, в связи с чем в настоящее время исключены из практики анестезиологии.
Хлороформ — клеточный яд, вызывающий раздражение тканей с последующим понижением их чувствительности, что позволяет назначать его для «отвлекающей терапии».
Хлорэтил -летучая жидкость, имеющая температуру кипения 12°С. При нанесении на кожу хлорэтил быстро испаряется, вызывая сильное охлаждение, ишемию тканей, понижение чувствительности. Это свойство хлорэтила можно использовать для кратковременного местного обезболивания (холодовая анестезия) при проведении небольших поверхностных операций. Иногда хлорэтил применяют для криотерапии, при невралгиях, рожистом воспалении, термических ожогах и т.д.
Азота закись -бесцветный газ, не воспламеняется, но поддерживает горение. Вдыхание азота закиси обеспечивает быстрое введение в наркоз и быстрое пробуждение. Препарат обладает слабой наркозной активностью и не дает достаточного расслабления мышц, поэтому используют смесь 80% азота закиси и 20% кислорода, и перед наркозом проводят медикаментозную подготовку пациента. Часто ее сочетают с другими общими анестетиками (эфиром, фторотаном). Так как азота закись вызывает состояние опьянения и выраженную анальгезию, она может назначаться для купирования сильных болевых приступов (при инфаркте, панкреатите, невралгии и т.д.), не снимающихся наркотическими анальгетиками (морфином, фентанилом и т.д.). Для получения длительной анальгезии азота закись можно вводить подкожно (не раздражает ткани, малотоксична).
Вдыхание азота закиси обеспечивает быстрое введение в наркоз и быстрое пробуждение. Препарат обладает слабой наркозной активностью и не дает достаточного расслабления мышц, поэтому используют смесь 80% азота закиси и 20% кислорода, и перед наркозом проводят медикаментозную подготовку пациента. Часто ее сочетают с другими общими анестетиками (эфиром, фторотаном). Так как азота закись вызывает состояние опьянения и выраженную анальгезию, она может назначаться для купирования сильных болевых приступов (при инфаркте, панкреатите, невралгии и т.д.), не снимающихся наркотическими анальгетиками (морфином, фентанилом и т.д.). Для получения длительной анальгезии азота закись можно вводить подкожно (не раздражает ткани, малотоксична).
Циклопропан -бесцветный газ, не раздражающий слизистые оболочки, обладающий высокой анальгетической и наркозной активностью.
Листать назад Оглавление Листать вперёд
Наш сайт использует файлы cookie, чтобы улучшить работу сайта, повысить его эффективность и удобство. Продолжая использовать сайт rlsnet.ru, вы соглашаетесь с условиями использования файлов cookie.
Продолжая использовать сайт rlsnet.ru, вы соглашаетесь с условиями использования файлов cookie.
эфир | химическое соединение | Britannica
- Ключевые люди:
- Дж. Фрейзер Стоддарт Александр Уильям Уильямсон
- Похожие темы:
- этиловый эфир метил-трет-бутиловый эфир метиловый эфир Неролин II тетрагидрофуран
Просмотреть весь связанный контент →
Резюме
Прочтите краткий обзор этой темы
простой эфир , любое из класса органических соединений, характеризующееся атомом кислорода, связанным с двумя алкильными или арильными группами. Эфиры по структуре аналогичны спиртам, а эфиры и спирты по структуре аналогичны воде. В спирте один атом водорода в молекуле воды замещен алкильной группой, тогда как в эфире оба атома водорода замещены алкильной или арильной группами.
При комнатной температуре эфиры представляют собой бесцветные жидкости с приятным запахом. По сравнению со спиртами простые эфиры обычно менее плотные, менее растворимы в воде и имеют более низкие температуры кипения. Они относительно нереакционноспособны, поэтому их можно использовать в качестве растворителей жиров, масел, восков, отдушек, смол, красителей, смол и углеводородов. Пары некоторых эфиров используются как инсектициды, акарициды и фумиганты для почвы.
По сравнению со спиртами простые эфиры обычно менее плотные, менее растворимы в воде и имеют более низкие температуры кипения. Они относительно нереакционноспособны, поэтому их можно использовать в качестве растворителей жиров, масел, восков, отдушек, смол, красителей, смол и углеводородов. Пары некоторых эфиров используются как инсектициды, акарициды и фумиганты для почвы.
Эфиры также важны в медицине и фармакологии, особенно для использования в качестве анестетиков. Например, этиловый эфир (CH 3 CH 2 ―O―CH 2 CH 3 ), известный просто как эфир, впервые был использован в качестве хирургического анестетика в 1842 году. Кодеин, сильнодействующее болеутоляющее средство , представляет собой метиловый эфир морфина. Поскольку эфир легко воспламеняется, его заменили менее воспламеняющимися анестетиками, включая закись азота (N 2 O) и галотан (CF 3 — CHClBr).
Этиловый эфир является отличным растворителем для экстракции и широкого спектра химических реакций. Он также используется в качестве летучей пусковой жидкости для дизельных двигателей и бензиновых двигателей в холодную погоду. Диметиловый эфир используется в качестве топлива для распыления и хладагента. Метил t -бутиловый эфир (МТБЭ) представляет собой присадку к бензину, повышающую октановое число и снижающую содержание оксидов азота в выхлопных газах. Эфиры этиленгликоля используются в качестве растворителей и пластификаторов.
Он также используется в качестве летучей пусковой жидкости для дизельных двигателей и бензиновых двигателей в холодную погоду. Диметиловый эфир используется в качестве топлива для распыления и хладагента. Метил t -бутиловый эфир (МТБЭ) представляет собой присадку к бензину, повышающую октановое число и снижающую содержание оксидов азота в выхлопных газах. Эфиры этиленгликоля используются в качестве растворителей и пластификаторов.
Общие названия простых эфиров просто дают названия двух алкильных групп, связанных с кислородом, и добавляют слово эфир . Текущая практика состоит в том, чтобы перечислять алкильные группы в алфавитном порядке ( t -бутилметиловый эфир), но более старые названия часто перечисляют алкильные группы в порядке возрастания размера (метил t -бутиловый эфир). Если в названии описана только одна алкильная группа, это подразумевает две идентичные группы, как в этиловом эфире для диэтилового эфира.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчас
Подпишитесь сейчас
Систематические (IUPAC) названия простых эфиров используют более сложную группу в качестве корневого названия, с атомом кислорода и меньшей группой, называемой алкоксизаместителем. Примерами, приведенными выше, являются этоксиэтан (диэтиловый эфир), метоксиэтан (метилэтиловый эфир), 2-метокси-2-метилпропан (МТБЭ) и феноксибензол (дифениловый эфир). Номенклатура ИЮПАК хорошо работает для соединений с дополнительными функциональными группами, поскольку другие функциональные группы могут быть описаны в корневом названии.
Физические свойства простых эфиров
В эфирах отсутствуют гидроксильные группы спиртов. Без сильно поляризованной связи O—H молекулы эфира не могут образовывать водородные связи друг с другом. Однако у простых эфиров есть несвязывающие электронные пары на атомах кислорода, и они могут образовывать водородные связи с другими молекулами (спиртами, аминами и т. д.), которые имеют связи O-H или N-H. Способность образовывать водородные связи с другими соединениями делает эфиры особенно хорошими растворителями для широкого круга органических соединений и удивительно большого числа неорганических соединений. (Для получения дополнительной информации о водородных связях, см. химическая связь: межмолекулярные силы.)
(Для получения дополнительной информации о водородных связях, см. химическая связь: межмолекулярные силы.)
Щелкните здесь, чтобы увидеть таблицу в полном размере. Поскольку молекулы эфира не могут образовывать водородные связи друг с другом, они имеют гораздо более низкую температуру кипения, чем спирты с аналогичной молекулярной массой. Например, температура кипения диэтилового эфира (C 4 H 10 O, молекулярная масса [MW] 74) составляет 35 °C (95 °F), но температура кипения 1-бутанола (или n -бутиловый спирт C 4 H 10 O, молекулярная масса 74) составляет 118 ° C (244 ° F). На самом деле точки кипения простых эфиров намного ближе к точкам кипения алканов с аналогичным молекулярным весом; температура кипения пентана (C 5 H 12 , молекулярная масса 72) составляет 36 ° C (97 ° F), что близко к температуре кипения диэтилового эфира.
Комплексы простых эфиров с реагентами
Уникальные свойства простых эфиров (то есть, они сильно полярны, с несвязывающими электронными парами, но без гидроксильной группы) способствуют образованию и использованию многих реагентов. Например, реактивы Гриньяра не могут образовываться, если не присутствует эфир, который разделяет свою неподеленную пару электронов с атомом магния. Комплексообразование атома магния стабилизирует реактив Гриньяра и помогает удерживать его в растворе.
Например, реактивы Гриньяра не могут образовываться, если не присутствует эфир, который разделяет свою неподеленную пару электронов с атомом магния. Комплексообразование атома магния стабилизирует реактив Гриньяра и помогает удерживать его в растворе.
Электронодефицитные реагенты также стабилизируются эфирами. Например, боран (BH 3 ) является полезным реагентом для получения спиртов. Чистый боран существует в виде его димера, диборана (B 2 H 6 ), токсичного газа, который неудобен и опасен в использовании. Однако боран образует стабильные комплексы с простыми эфирами, и его часто поставляют и используют в виде жидкого комплекса с тетрагидрофураном (ТГФ). Точно так же газообразный трифторид бора (BF 3 ) легче использовать в виде его жидкого комплекса с диэтиловым эфиром, называемого BF 3 эфират, а не как токсичный коррозионный газ.
Краун-эфиры представляют собой специализированные циклические полиэфиры, которые окружают определенные ионы металлов, образуя циклические комплексы в форме короны. Они названы с использованием родительского имени Crown , которому предшествует число, описывающее размер кольца, а за ним следует количество атомов кислорода в кольце. В комплексе краун-эфира ион металла помещается в полость краун-эфира и сольватируется атомами кислорода. Внешний вид комплекса неполярный, замаскированный алкильными группами краун-эфира. Многие неорганические соли можно сделать растворимыми в неполярных органических растворителях путем их комплексообразования с соответствующим краун-эфиром. Ионы калия (К + ) образуют комплексы с 18-краун-6 (18-членное кольцо с 6 атомами кислорода), ионами натрия (Na + ) с 15-краун-5 (15-членное кольцо, 5 атомов кислорода) и литием ионы (Li + ) по 12-краун-4 (12-членное кольцо, 4 атома кислорода).
Они названы с использованием родительского имени Crown , которому предшествует число, описывающее размер кольца, а за ним следует количество атомов кислорода в кольце. В комплексе краун-эфира ион металла помещается в полость краун-эфира и сольватируется атомами кислорода. Внешний вид комплекса неполярный, замаскированный алкильными группами краун-эфира. Многие неорганические соли можно сделать растворимыми в неполярных органических растворителях путем их комплексообразования с соответствующим краун-эфиром. Ионы калия (К + ) образуют комплексы с 18-краун-6 (18-членное кольцо с 6 атомами кислорода), ионами натрия (Na + ) с 15-краун-5 (15-членное кольцо, 5 атомов кислорода) и литием ионы (Li + ) по 12-краун-4 (12-членное кольцо, 4 атома кислорода).
В каждом из этих краун-эфирных комплексов только катион сольватируется краун-эфиром. В неполярном растворителе анион не сольватируется, а увлекается в раствор катионом. Эти «голые» анионы в неполярных растворителях могут быть гораздо более реакционноспособными, чем в полярных растворителях, которые сольватируют и экранируют анион. Например, комплекс 18-краун-6 перманганата калия, KMnO 4 , растворяется в бензоле с образованием «фиолетового бензола» с чистым ионом MnO 4 − , действующим как мощный окислитель. Точно так же чистый ион — OH в гидроксиде натрия (NaOH), растворимый в гексане (C 6 H 14 ) с помощью 15-краун-5, является более мощным основанием и нуклеофилом, чем когда он сольватирован полярные растворители, такие как вода или спирт.
Например, комплекс 18-краун-6 перманганата калия, KMnO 4 , растворяется в бензоле с образованием «фиолетового бензола» с чистым ионом MnO 4 − , действующим как мощный окислитель. Точно так же чистый ион — OH в гидроксиде натрия (NaOH), растворимый в гексане (C 6 H 14 ) с помощью 15-краун-5, является более мощным основанием и нуклеофилом, чем когда он сольватирован полярные растворители, такие как вода или спирт.
Физические свойства эфира — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 35774
Диметиловый эфир и этилметиловый эфир являются газами при обычной температуре. Остальные низшие гомологи — бесцветные, приятно пахнущие, летучие жидкости с характерным эфирным запахом.
Остальные низшие гомологи — бесцветные, приятно пахнущие, летучие жидкости с характерным эфирным запахом.
Температуры кипения
Связи С-О в эфире полярны, поэтому эфиры имеют суммарный дипольный момент. Слабая полярность простых эфиров не оказывает заметного влияния на их температуры кипения, которые сравнимы с температурами кипения алкенов с сопоставимой молекулярной массой. Эфиры имеют гораздо более низкую температуру кипения по сравнению с изомерными спиртами. Это связано с тем, что молекулы спиртов связаны водородными связями, а молекулы эфира — нет.
Растворимость
Эфиры, содержащие до 3 атомов углерода, растворимы в воде благодаря образованию водородных связей с молекулами воды.
Растворимость уменьшается с увеличением числа атомов углерода. Относительное увеличение углеводородной части молекулы снижает тенденцию к образованию Н-связи. Эфиры заметно растворимы в органических растворителях, таких как спирт, бензол, ацетон и т. д.
Структура эфиров
Эфиры представляют собой класс органических соединений, содержащих sp 3 гибридизуют кислород между двумя алкильными группами и имеют формулу R-O-R’. эти соединения используются в красках, парфюмерии, маслах, восках и других промышленных целях. Алифатические эфиры не имеют арильных групп, непосредственно связанных с кислородом эфира.
Примеры алифатических эфиров
Ароматические эфиры имеют по крайней мере одно арильное кольцо, непосредственно связанное с кислородом эфира. В ариловых эфирах неподеленные пары атомов кислорода сопряжены с ароматическим кольцом, что существенно изменяет свойства эфира.
Пример ароматических эфиров
Гибридизация кислорода sp 3 дает эфирам примерно такую же геометрию, как спирты и вода. Валентный угол R-O-R’ близок к ожидаемому в тетраэдрической геометрии. Валентный угол диметилового эфира составляет 112 o , что больше валентного угла HOH в воде (104,5 o ) из-за стерического отталкивания метильных групп.
Наличие электроотрицательного атома кислорода придает эфирам небольшой дипольный момент.
Сравнение физических свойств спиртов и простых эфиров
У простых эфиров, в отличие от спиртов, нет атома водорода на атоме кислорода (то есть нет группы ОН). Следовательно, межмолекулярная водородная связь между молекулами эфира отсутствует, что делает их температуру кипения намного ниже, чем у спирта с аналогичной массой. Несмотря на наличие небольшого дипольного момента, эфиры имеют температуры кипения примерно такие же, как у алканов сопоставимой молярной массы. (таблица 18.1.2).
| Краткая структурная формула | Наименование | Молярная масса | Температура кипения (°С) | Межмолекулярные водородные связи в чистой жидкости? |
|---|---|---|---|---|
| CH 3 CH 2 CH 3 | пропан | 44 | –42 | нет |
| СН 3 ОСН 3 | диметиловый эфир | 46 | – 25 | нет |
| CH 3 CH 2 ОН | спирт этиловый | 46 | 78 | да |
| CH 3 CH 2 CH 2 CH 2 CH 3 | пентан | 72 | 36 | нет |
| CH 3 CH 2 OCH 2 CH 3 | диэтиловый эфир | 74 | 35 | № |
| CH 3 CH 2 CH 2 CH 2 OH | бутиловый спирт | 74 | 117 | да |
Однако молекулы эфира содержат атом кислорода и образуют водородные связи с молекулами воды. Следовательно, эфир имеет примерно такую же растворимость в воде, как изомерный ему спирт. Например, диметиловый эфир и этанол (оба имеют молекулярную формулу C 2 H 6 O) полностью растворимы в воде, тогда как диэтиловый эфир и 1-бутанол (оба C 4 H 10 O) практически не растворимы в воде (8 г/100 мл воды).
Следовательно, эфир имеет примерно такую же растворимость в воде, как изомерный ему спирт. Например, диметиловый эфир и этанол (оба имеют молекулярную формулу C 2 H 6 O) полностью растворимы в воде, тогда как диэтиловый эфир и 1-бутанол (оба C 4 H 10 O) практически не растворимы в воде (8 г/100 мл воды).
Образование пероксидов
Многие простые эфиры могут реагировать с кислородом с образованием взрывоопасных пероксидных соединений в ходе свободнорадикального процесса, называемого автоокислением. По этой причине эфиры не следует хранить в течение длительного времени и не следует хранить в стеклянных бутылках. Опасность особенно велика, когда эфирные растворы перегоняются почти досуха. Гидропероксиды могут стать более концентрированными во время перегонки, потому что они, как правило, имеют несколько более высокую температуру кипения, чем соответствующий эфир. Перед проведением перегонки с эфиром необходимо тщательно проверить наличие перекисей.
Авторы
Бинод Шреста (Университет Лотарингии)
Physical Properties of Ether распространяется по незаявленной лицензии и был создан, изменен и/или курирован LibreTexts.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Показать страницу TOC
- нет на странице
- Метки
Эфиры | Камео Химикаты | NOAA
Добавить в MyChemicals Страница для печати
Реактивная группа Лист данных
Что такое реактивные группы?
Реакционноспособные группы представляют собой категории химических веществ, которые обычно реагируют сходным образом. способами, поскольку они сходны по своему химическому строению. Каждое вещество с
лист химических данных был назначен одной или нескольким реакционноспособным группам, и
CAMEO Chemicals использует присвоение реактивных групп, чтобы определить свою реакционную способность.
предсказания.
Подробнее о прогнозах реактивности…
способами, поскольку они сходны по своему химическому строению. Каждое вещество с
лист химических данных был назначен одной или нескольким реакционноспособным группам, и
CAMEO Chemicals использует присвоение реактивных групп, чтобы определить свою реакционную способность.
предсказания.
Подробнее о прогнозах реактивности…
Если вы не можете найти химическое вещество в базе данных, но знаете, какая реактивная группа он принадлежит — вместо этого вы можете добавить реактивную группу в MyChemicals, чтобы чтобы увидеть прогнозы реактивности.
Есть 391 химический паспорт относятся к этой реактивной группе.
Описание
Воспламеняемость
Низкомолекулярные эфиры представляют собой легковоспламеняющиеся газы (диметиловый эфир) или жидкости (метилэтиловый эфир или диэтиловый эфир), которые при испарении и смешивании с воздухом могут образовывать взрывоопасные смеси. Эфиры образуют перекиси при контакте с кислородом или воздухом во время хранения; пероксиды эфира могут детонировать при трении, ударе или нагревании, высвобождая достаточно энергии, чтобы вызвать вторичное возгорание в неперекисном эфире.
Реакционная способность
Эфиры имеют тенденцию образовывать нестабильные пероксиды при контакте с кислородом. Этиловый, изобутиловый, этилтретбутиловый и этилтретпентиловый эфиры особенно опасны в этом отношении. Пероксиды эфира иногда можно наблюдать в виде прозрачных кристаллов, которые могут быть чувствительными к ударам и осаждаться на контейнерах или на поверхности жидкости. Простые эфиры обычно действуют как слабые основания Льюиса. Они образуют соли с сильными кислотами и комплексы присоединения с кислотами Льюиса. Примером может служить комплекс между диэтиловым эфиром и трифторидом бора. Эфиры могут бурно реагировать с сильными окислителями. В других реакциях, которые обычно включают разрыв связи углерод-кислород, простые эфиры относительно неактивны.
Токсичность
Как группа эфиры умеренно токсичны. Низкомолекулярные эфиры являются мощными быстродействующими наркотиками при вдыхании. Токсические эффекты этих соединений обычно бывают острыми, а не хроническими. Проглатывание одной-двух унций жидкого эфира может привести к летальному исходу.
Проглатывание одной-двух унций жидкого эфира может привести к летальному исходу.
Прочие характеристики
Простые эфиры содержат атом кислорода, связанный с двумя органическими группами, то есть они имеют общую формулу R-O-R’, где R и R’ представляют собой органические группы. Эфиры получают синтезом Вильямсона (реакция алкоксида металла с алкилгалогенидом), а также реакцией алкилгидросульфатов со спиртами. Это сводится к смешиванию спиртов с серной кислотой и нагреванию. Этот процесс дает простые эфиры в качестве побочных продуктов при получении спиртов из олефинов в присутствии H3SO4.
Примеры
Фениловый эфир, этиловый эфир, аллилэтиловый эфир, анизидин, анизол, бутилметиловый эфир, бутилвиниловый эфир, диаллиловый эфир, изопропиловый эфир, дивиниловый эфир, метиловый эфир.
Документация по реактивности
Воспользуйтесь ссылками ниже, чтобы узнать, как эта реактивная группа взаимодействует с любым
реактивных групп в базе данных.

 4
4