Какое будущее ждет амфибию «ДРОЗД»
Представлял уникальную машину Сергей Терешенков — инженер из Санкт-Петербурга. Кстати, название «ДРОЗД» — аббревиатура функционального предназначения и конструкции: дозорно-разведывательная однокорпусная земноводно-двухсредная.
С одной стороны, это глиссирующий катер с характерной лодочной формой корпуса и мощным катерным дизелем. По воде мчится со скоростью 70 км/час. С другой — это и достаточно комфортабельный автомобиль, способный идти по шоссе со скоростью 100 км/час. Грузоподъемность — 1,5 тонны при полной массе 3,5 тонны. Запас хода по земле — 800 км, по воде — 300 км. Есть восемь пассажирских посадочных мест.
Шесть лет назад Терешенков разработал концепт-проект, обошел с ним все, как ему казалось, заинтересованные структуры и ведомства. Везде его идею оценили высоко, но финансировать разработки отказались. Ему говорили: сделай сам, покажи готовый продукт, вот тогда мы и решим — нужен ли он нам.
Сказали — сделал, решив при этом, казалось бы, нерешаемые задачи.
Например, для достижения скоростных характеристик требовался мощный, но в то же время легкий дизельный мотор, которые ставят на катера. Такой мотор мощностью 260 л.с. он нашел. Но катерный дизель требует постоянного охлаждения. На воде проблема решается легко с помощью забортной воды. А на суше? Терешенков придумал и собрал уникальную систему охлаждения, подобных которой нет ни на одном транспортном средстве в мире. Она не дает возможности перегреться двигателю ни при каких условиях.
Эффект глиссирования достигается тем, что при спуске на воду передние колеса поджимаются и частично убираются в корпус, задние втягиваются в корпус полностью.
Сергей Терешенков строил свою амфибию шесть лет. Фото: Константин Завражин/РГ
Надо сказать, что амфибии с убирающимися колесами, способные развивать большую скорость на воде, сегодня производят в нескольких странах мира. Но это легкие машины, с небольшими колесами, предназначенные для почитателей экстремального туризма по воде и суше. Столь мощных как «ДРОЗД» не выпускают нигде. Их нет даже в проектах.
Столь мощных как «ДРОЗД» не выпускают нигде. Их нет даже в проектах.
Наша амфибия способна идти без потери скорости при волнении моря в 3 балла. Она способна входить в воду и выходить из нее с необорудованного берега, в том числе заболоченного. Не просто выходить, а буквально выпрыгивать.
Водометный движитель эффективно работает даже в замусоренной воде, заросшей водорослями. Все зарубежные, так сказать, аналоги требуют берега пологого, чистого и такой же воды при плавании.
Какова сфера применений амфибии «ДРОЗД»? Поистине безгранична. Для состоятельных любителей экстремального туризма и рыбалки — это идеальное и комфортное транспортное средство. Для МЧС — высокомобильная, скоростная и достаточно вместительная амфибия, позволяющая оказывать быструю помощь в самых экстремальных ситуациях. Для силовых структур за себя говорит название — дозор и разведка. Преимущество, в сравнении с привычными амфибиями, — скорость.
Стоит повторить, на форуме «Армия-2020» амфибия, созданная Сергеем Терешенковым на собственные деньги, была в центре внимания.
Но дальнейшая судьба уникальной разработки оказалась в полном тумане. Необходимы ресурсные и прочностные испытания. Для этого требуется еще несколько автомобилей, построить которые за свои деньги изобретатель не в состоянии.
В принципе, в рамках модной ныне диверсификации проект «ДРОЗД» для дальнейшей реализации мог бы взять один из автомобильных гигантов — ГАЗ, УАЗ или КАМАЗ. Терешенков, как он сам сказал, не против. Но и они не спешат с принятием решения. Между тем, пока аналогов в мире нет, Россия могла бы захватить внушительный сегмент на мировом рынке гражданских амфибий. А по линии «Рособоронэкспорта» машину можно было бы предлагать силовым структурам стран Юго-Восточной Азии, Тихоокеанского региона и Латинской Америки.
Сергея Терешенкова вполне можно уподобить Илону Маску. С той разницей, что Маск — хороший организатор, а Терешенков — и организатор, и человек, способный работать своими руками. К тому же Маск делает бизнес там, где позиции США всегда были сильными.
А вот Сергей Терешенков обошел Соединенные Штаты там, где они были лидерами исторически — в автомобилестроении. Он ведь не только спроектировал и построил машину, до идеи которой не додумались за океаном. Он создал технологическую оснастку для серийного производства.
И очень интересно, как оценят и поддержат ли отечественного автомобильного Илона Маска в нашей стране.
Водометный движитель эффективно работает даже в замусоренной воде. Фото: Константин Завражин/РГ
Кстати
На форуме «Армия-2020» я спросил Сергея Терешенкова, а что он будет делать с амфибией «ДРОЗД», если никто в России интереса к ней не проявит. Он пожал плечами и ответил: «Я мог бы ее оставить в своем личном пользовании — она же фактически моя собственность. Мог бы продать какому-то олигарху, амфибия в ее нынешнем виде — продукт недешевый. Но проблема в том, что «ДРОЗД» почти невозможно зарегистрировать».
Действительно, амфибия — машина двухсредная. И какие номера получать? Автомобильные или катерные? При этом требования к катерам и сухопутным авто принципиально разные. Нестыковка по 54 пунктам. К примеру, привязные ремни на катерах запрещены, а на автомобилях — обязательны. В море запрещен стеклотриплекс, остекление должно быть акриловое. На суше — наоборот.
Нестыковка по 54 пунктам. К примеру, привязные ремни на катерах запрещены, а на автомобилях — обязательны. В море запрещен стеклотриплекс, остекление должно быть акриловое. На суше — наоборот.
Как считает Сергей Терешенков, необходимо разработать своеобразный национальный класс регистрации амфибий и внедорожников, создаваемых в инициативном порядке. Пусть он будет пока признаваться только в России, но мы начнем формировать глобальный тренд. Ведь похожие машины проектируют и строят во всем мире, и везде проблемы с их регистрацией схожи.
Автомобиль –амфибия «Дрозд» проходит испытания
17:03 / 31.08.20
Автомобиль –амфибия «Дрозд» проходит испытания
19 августа в издательстве motor вышла в свет статья Анастасии Дубиной «Российские инженеры разработали 260-сильную военную амфибию «Дрозд» Двухсредный автомобиль проходит опытные испытания».[1]
В статье сообщается, что российские инженеры Балтийской машиностроительной компании разработали глиссирующую полноприводную амфибию для силовых структур. Полноприводная машина, получившая название «Дрозд», может передвигаться как по суше, так и по воде.
Полноприводная машина, получившая название «Дрозд», может передвигаться как по суше, так и по воде.
Что сразу же бросается в глаза и вызывает ряд вопросов к Анастасии Дубиной?
Во-первых, что такое двухсредный автомобиль? Вероятно, что это – транспортное средство, которое можно одинаково успешно применять в жидкой среде (воде) и в твердой среде – на суше.
Основное предназначение автомобилей –амфибий – передвижение по суше по дорогам или при отсутствии таковых и только в ряде случаев успешно перемещаться по водной поверхности.
Следовательно, такие транспортные средства должны получать в уполномоченных органах Одобрение типа транспортного средства (ОТТС). Одобрение типа транспортного средства (ОТТС) – это процедура официального подтверждения соответствия автомобиля или другого транспорта требованиям нормативно-правовых актов РФ. Процедура проводится аккредитованными органами по сертификации. По ее результатам выдается документ – ОТТС, который необходим для выдачи ПТС и постановки транспортного средства на учет. [2]
[2]
Образец Сертификата соответствия
На взгляд автора, это должен быть скорее автомобиль, чтобы имелась возможность использовать его по дорогам общего назначения, а не возить в соответствующем прицепе за автомобилем-тягачём.
Во-вторых, вызывают определённые сомнения слова Дубининой: «инженеры Балтийской машиностроительной компании разработали глиссирующую полноприводную амфибию для силовых структур».
На взгляд автора данной статьи Анатолия Черкашина, это ещё не транспортное средство, а концепт-кар. Это пока ещё не автомобиль. На концепте нет бамперов, нет брызговиков, нет зеркал заднего вида и многого другого, положенного для сертификации автомобиля. А как на водном катере, отсутствуют передние и задние ходовые огни, нет багра, весла, спасательных жилетов, спасательных кругов, буксирного (аварийного) линя, то есть всего положенного по Табелю.[3]
|
Наименование |
|
Количество на катере |
|
Буксирно-швартовый канат |
1 |
1 |
|
Отпорный крюк |
1 |
1 |
|
Якорь с канатом |
1 |
1 |
|
Спасательное кольцо с линем (спасательный круг) |
1 |
1 |
|
Вёсла |
2 |
2 |
|
Водоотливной насос |
- |
1 |
|
Огнетушитель |
- |
1 |
|
Ремонтная аптечка |
1 |
1 |
|
Медицинская аптечка |
1 |
1 |
|
Индивидуальные спасательные средства |
По числу людей на борту |
По числу людей на борту |
|
Звукосигнальное устройство |
1 |
1 |
|
Ракета бедствия парашютная |
2 |
3 |
На выставке «Армия-2020» представят первую российскую полноприводную глиссирующую амфибию. [4] Об этом издательству MIL.PRESS FLOT поведал Сергей Терешенков — главный конструктор и глава предприятия-производителя машины «Балтийской машиностроительной компании» («БМК»). «Дрозд» создан на основе одноимённой универсальной модульной амфибийной платформы. Он способен развивать скорость до 70 км/ч на воде и до 100 км/ч на суше. Опытный образец амфибии сейчас проходит испытания.
[4] Об этом издательству MIL.PRESS FLOT поведал Сергей Терешенков — главный конструктор и глава предприятия-производителя машины «Балтийской машиностроительной компании» («БМК»). «Дрозд» создан на основе одноимённой универсальной модульной амфибийной платформы. Он способен развивать скорость до 70 км/ч на воде и до 100 км/ч на суше. Опытный образец амфибии сейчас проходит испытания.
В связи с этим заявлением Сергея Терещенкова необходимо, на взгляд автора, заметить, что предлагаемый концепт-кар полностью лишён всех необходимых для военного транспортного средства аксессуаров.
Так на Дрозде не предусмотрены места для размещения радиостанции, средств навигации, фильтровентиляционной установки, кондиционера (для современных боевых модулей), бойниц, взрывозащищённых креплений сидений, мест крепления оружия, противорадиационного подбоя, взрывозащищающих ковриков, мест размещения ЗИП, материалов и средств специальной обработки и санитарно-технического оборудования (ведь эту машину конструкторы предполагают применять для десанта морской пехоты).
Отсюда вытекают выводы:
1. Рассматриваемое транспортное средство пока не является ни автомобилем и ни катером.
2. Разработка Дрозда идет инициативно и никаким техническим заданием от представителей МО РФ не регламентировано.
3. Практически разработчики изделия не понимают какое транспортное средство и для какого потребителя они разрабатывают.
4. Машина, как представляется, может получится интересной и нужной как для ВМФ, так и для Инженерных войск.
Некоторые известные ТТХ амфибии Дрозд.
|
Наименования параметров |
Значения |
|
Назначение |
Глиссирующая машина-амфибия (не потопляемая) |
|
Разработчик |
«Балтийская машиностроительная компания» («БМК») |
|
Боевая масса, кг |
2000 |
|
Грузоподъёмность, кг |
1500 |
|
Мореходность (волнение) |
3 балла (высота волны до 1,25 м) |
|
Водоизмещающий корпус |
Литой в форму в виде килевой лодки, закрытой сверху палубой и рубкой, в которой размещено отделение управления и десантное отделение. |
|
Двери: Отделения управления
Десантного отделения |
Две откидные (нижняя половина – трап) с откидной верхней частью. Одна распашная двухстворчатая в корме с встроенными в ней радиаторами и воздушными вентиляторами. |
|
Силовая установка, тип и мощность, л.с. |
Дизельный двигатель, мощность 260 |
|
Коробка перемены передач |
Автоматическая, 3-хступенчатая |
|
Раздаточная коробка |
Механическая, 2-ух ступенчатая, передаточное число понижающего ряда равно 1:4, с блокируемым межмостовым дифференциалом |
|
Мосты |
Поднимаемые в корпус, передние колёса складываются горизонтально, задние втягиваются в корпус, оснащены блокируемыми межколёсными дифференциалами. |
|
Время перехода на колёсный движитель после выброски судна на берег, сек. |
12 |
|
Движитель: Сухопутный
Водоходный, диаметр импеллера, мм |
Колёсный (4 Х 4) с системой централизованной накачки, колёса складываются для снижения гидравлического сопротивления при глиссировании. Водомётный движитель. 230 |
|
Колёса, тип и количество |
Односкатные, камерные, тип протектора – вездеходный, с регулируемым давлением в шинах. |
|
Система водооткачки |
Трюмный насос |
|
Параметры проходимости: — клиренс, мм — углы, град.: подъёма крена |
420 300 300 |
|
Скорость, км/ч: На суше На плаву |
100 70 (глиссирование) |
|
Запас хода по топливу, км: По суше На плаву |
800 300 |
|
Выход на берег |
Методом выбрасывания за урез воды или на припай льда толщиной до 10 см. |
|
Подвеска |
Запатентована БМК |
|
Рулевое управление |
Реечный механизм |
|
Материал для картеров мостов, картера РУ |
Морской алюминиевый сплав АМг61 |
|
Дополнительное оборудование: Лебёдка
Отопитель |
Высокоскоростная вертикальная лебедка (кабестан), она же – якорная Дополнительно и в десантном отсеке |
Несколько слов о устройстве амфибии Дрозд.
Анализ фотографий
Концепт-кар амфибии Дрозд, вид с передней части / Фото: flot.com
Амфибия Дрозд, вид с левого борта / Фото: flot.com
позволяет сделать умозаключение, что в основу конструкции заложена лодка. Она выполнена из карбона. Днище лодки имеет переменную килеватость с 210 до 160. Это применено в целях лучшей остойчивости и выхода на глиссирование.
Протопчина — передняя палуба имеет углубление для запасного колеса, которое в данном случае выполняет роль толкающего транца.
В запасном колесе размещается якорь, ленточный трос которого соединён с вертикальным барабаном лебёдки самовытаскивания и выдается из корпуса через буксирный клюз (он же и ступенька для посадки на катер). По краям протопчины выполнены по одной на каждый борт швартовые утки, которые могут выдвигаться вверх и способны выдержать полную массу амфибии при подъёме краном или парашютной системой. Такие же две утки выполнены в кормовой части крыши рубки.
По краям протопчины выполнены по одной на каждый борт швартовые утки, которые могут выдвигаться вверх и способны выдержать полную массу амфибии при подъёме краном или парашютной системой. Такие же две утки выполнены в кормовой части крыши рубки.
По левому борту наблюдается белый лючок, за которым располагается воздушный фильтр. Поступление воздуха к нему осуществляется через расположенный выше воздухозаборник, решётка которого видна. За решёткой устроена улитка и хлопушка, перекрывающая даступ воды в случае удара морской волны в борт амфибии. Внутреннего объема моторного отсека достаточно для работы дизеля без притока воздуха в течение 10 секунд.
В кормовой части за остеклением можно обнаружить расширенный кожух. Это – воздухозаборник для двух радиаторов, расположенных в каждой из створок задней двери. Выброс горячего воздуха осуществляется электровентиляторами через решётки створок дверей.
В десантном отсеке в полу выполнены лючки для доступа к приводному валу импеллера и собственно к импеллеру в целях их очистки от водорослей и тины.
Ватерлиния проходит на 5 сантиметров ниже верхней кромки пайолов (съёмного настила порога нижней откидной створки двери отделения управления). Нижняя половинка двери – трап для подъёма в машину. Она обладает повышенной плавучестью и не опускается в воде до упора вниз. В этом случае створку можно применять для приема груза или укладки спасаемого на воде человека.
На верхней палубе рубки – жёсткое покрытие. Что позволяет разместить различные варианты вооружения или всевозможные грузы.
Анализ существующих материалов позволяет сделать заключение о том, что после прекращения выпуска малого автомобиля водоплавающего (МАВ) в 1958 году армия автомобилей подобного класса на вооружение не получала. Военные глиссирующие амфибии в Мире мало известны. Завершение разработки такой машины под руководством МО РФ и доведения её до принятия на вооружение будет прорывом в оснащении ВС РФ.
Амфибийный автомобиль ГАЗ-46 (МАВ) / Фото: ru. wikipedia.org
wikipedia.org
Выводы:
1.После прекращения выпуска автомобиля ГАЗ-46 (МАВ) (годы выпуска 1953-1958 г.г.) для ВС СССР и ВС РФ промышленность не поставляла плавающих автомобилей подобного класса.
2. Выпуск амфибии Дрозд, в случае принятия её на вооружение, будет являться прорывом для нашей армии. Он может соответствовать лучшим мировым образцам подобных машин.
3.Концепт-кар, планируемый к демонстрации на выставке Армия-2020, имеет очевидные перспективы для дальнейшей разработки под патронажем МО РФ.
Источник: ИА «ОРУЖИЕ РОССИИ», Анатолий Черкашин, полковник в отставке кандидат военных наук
[1] Сайт: https://motor.ru/news/russian-drozd-19-08-2020.htm?utm_source=yxnews&utm_medium=desktop Статья Анастисии Дубиной «Российские инженеры разработали 260-сильную военную амфибию «Дрозд»
Двухсредный автомобиль проходит опытные испытания» в издательстве MOTOR от 19 августа 2020 года.
[2] Сайт: https://yandex.ru/search/?lr=213&text=cs-garant.ru%E2%80%BAodobrenie%20tipa%20transportnogo%20sredstva Статья «Одобрение типа транспортного средства: что это такое» Издано garant Всероссийским центром сертификации Обществом с ограниченной ответственностью «ГАРАНТ ПЛЮС» актуально на 2020 год.
[3] Сайт: https://www.vodkomotornik.ru/poleznoe/boat-motor/24-boat-table.html Таблица Комплектации предметами снабжения поднадзорных судов Актуально на 2020 год.
[4] Сайт: https://flot.com/2020/ФорумАрмия95/ Редакционная статья «Двухсредный «Дрозд»: глиссирующая полноприводная амфибия для силовиков станет премьерой «Армии-2020» в издании MIL.PRESS FLOT от 17 августа 2020 года
Теги: Среда применения, амфибия, судно, концепт-кар, конструкция, тактико-техническая характеристика (ТТХ)
В рамках исполнения ст. 4 закона РФ «О средствах массовой информации» редакция ИА «Оружие России» информирует о
том, что организации, информация о которых может быть указана в опубликованной статье, являются организациями,
деятельность которых в Российской Федерации запрещена, согласно перечню общественных и религиозных объединений, иных
организаций, в отношении которых судом принято вступившее в законную силу решение о ликвидации или запрете
деятельности по основаниям, предусмотренным Федеральным законом от 25 июля 2002 года N 114-ФЗ «О противодействии
экстремистской деятельности» (официальные источники: сайт «Российской газеты» (соответствующие разделы сайта
https://rg. ru/ или https://rg.ru/2018/12/05/spisok-dok.html) и сайт Минюста России (соответствующие разделы сайта
https://minjust.ru/ или https://minjust.ru/nko/perechen_zapret).
ru/ или https://rg.ru/2018/12/05/spisok-dok.html) и сайт Минюста России (соответствующие разделы сайта
https://minjust.ru/ или https://minjust.ru/nko/perechen_zapret).
Балтийская машиностроительная компания разрабатывает универсальную амфибию “Дрозд”: подробности проекта
Конструирование любой амфибии — это поиск разумного компромисса между мореходностью и сухопутностью. В случае с «Дроздом» акцент явно сделан на способности быстро и безопасно ходить по водной поверхности. «Балтийская машиностроительная компания» разрабатывает амфибию с 2014 года полностью в инициативном порядке. Первый спуск на воду ходового прототипа состоялся в ноябре 2018 года. Несмотря на то, что условия в сборочных цехах ненамного лучше гаражных, амфибия отличается сложными и нестандартными инженерными идеями. Прежде всего это полный привод вкупе с убирающимися внутрь лодки колесами. Для подобного технического решения разработчики заново спроектировали мосты, раздаточную коробку и сложную кинематику убирающегося шасси — в общей сложности подали 12 патентов. Необычное расположение запасного колеса на носовой части объясняется двумя причинами. Во-первых, это отличный отбойный кранец, позволяющий «Дрозду» достаточно жёстко швартоваться. А во-вторых, в корме колесу просто не нашлось места из-за расположенных радиаторов охлаждения силовой установки. И на распределение масс в лодке тяжелое запасное колесо на носу влияет благотворно. Швартовочные утки на корпусе, помимо своего основного назначения, могут использоваться для крепления парашютной системы десантирования.
Необычное расположение запасного колеса на носовой части объясняется двумя причинами. Во-первых, это отличный отбойный кранец, позволяющий «Дрозду» достаточно жёстко швартоваться. А во-вторых, в корме колесу просто не нашлось места из-за расположенных радиаторов охлаждения силовой установки. И на распределение масс в лодке тяжелое запасное колесо на носу влияет благотворно. Швартовочные утки на корпусе, помимо своего основного назначения, могут использоваться для крепления парашютной системы десантирования.
“Дрозд” в мореходном положении шасси. Источник: mag.auto.ru
Воспользуйтесь нашими услугами
Разработчики прямо говорят, что машина может быть полезной для ВДВ и морской пехоты. Среди потенциальных пользователей также рассматриваются сотрудники МЧС: у «Дрозда» мощный водометный движитель, который при необходимости может использоваться как помпа для тушения пожаров с воды.
260-сильный дизельный мотор Steyr располагается для большей остойчивости в центральной части лодки между водителем-рулевым и передним пассажиром. Как утверждают авторы, в ходе отработки конструкции перепробовали пять двигателей (отечественных и зарубежных), но именно Steyr оказался самым легким и компактным. Выбранный Steyr, помимо своих достоинств, имеет потенциал для разгона мощности до 300 л/с. Запас хода по топливу на суше составляет 800 км, на воде – 300 км.
Как утверждают авторы, в ходе отработки конструкции перепробовали пять двигателей (отечественных и зарубежных), но именно Steyr оказался самым легким и компактным. Выбранный Steyr, помимо своих достоинств, имеет потенциал для разгона мощности до 300 л/с. Запас хода по топливу на суше составляет 800 км, на воде – 300 км.
В связи с тем, что мотор вынужден работать на воде постоянно на высоких оборотах (специфика мореходной эксплуатации), инженерам пришлось разработать особую систему охлаждения. Радиаторы встроены в задние распашные двери и обеспечивают теплонагруженному дизелю гораздо эффективное охлаждение, чем в гражданском сухопутном исполнении. Силовая установка обеспечила амфибии замечательные мореходные качества: лодка в режиме глиссирования разгонятся на воде до 70 км/ч, при этом успешно выдерживает 3-балльный шторм. При большем волнении скорость хода на водоемах ожидаемо снижается. На суше «Дрозд» развивает максимальные 100 км/ч, при этом способен преодолевать серьезное бездорожье. Амфибия в первоначальном исполнении комплектуется трехдиапазонной автоматической коробкой переключения передач, заимствованной у тяжелых американских внедорожников. По словам конструктора Сергея Терешенкова, в ходе испытаний КПП пришлось адаптировать ее под мореходные нужды. В определенные моменты набора скорости «Дрозд» поднимал нос, что датчики коробки воспринимали как затяжной подъем (специфика сухопутной эксплуатации) и, само собой, понижали передачу. Вследствие этого темп разгона лодки снижался. Лечить врожденный недуг пришлось перепрограммированием КПП.
Амфибия в первоначальном исполнении комплектуется трехдиапазонной автоматической коробкой переключения передач, заимствованной у тяжелых американских внедорожников. По словам конструктора Сергея Терешенкова, в ходе испытаний КПП пришлось адаптировать ее под мореходные нужды. В определенные моменты набора скорости «Дрозд» поднимал нос, что датчики коробки воспринимали как затяжной подъем (специфика сухопутной эксплуатации) и, само собой, понижали передачу. Вследствие этого темп разгона лодки снижался. Лечить врожденный недуг пришлось перепрограммированием КПП.
«Дрозд» способен на скорости 20-30 км/ч в режиме глиссирования выброситься на берег, словно кит, и уже потом встать на колеса. Легкая и прочная карбоновая рама вкупе с композитным корпусом должны выдержать подобную нагрузку. Такие трюки «Дрозд» проделывает единственный в мире. Дорожный просвет в самой низкой точке киля составляет 360 мм, что обеспечивает неплохую геометрическую проходимость. Интересно, как Терешенков в одном из ознакомительных роликов описывает дизайнерские работы по проекту. По его словам, никаких эстетических изысков в ходе постройки прототипа не предусматривались: в 3D-редакторе просто «обтянули» салон на 10 мест композитным кузовом, и все. У «Дрозда» действительно функциональность форм стоит на первом месте. Кузов на первом экземпляре стеклопластиковый, что несколько увеличивает итоговый вес. В перспективе конструкторы предполагают перейти на полностью карбоновый кузов. О том, как это увеличит стоимость амфибии, информации нет. При снаряженной массе в 2000 килограммов «Дрозд» способен взять на борт полторы тонны груза. Потопить амфибию без разрушения невозможно: даже с открытыми дверями лодка будет сохранять положительную плавучесть. Центр тяжести лодки расположен таким образом, что при перевороте «Дрозд» возвращается в первоначальное положение. Как и любое морское судно, амфибия оснащается якорем (расположен в запасном колесе) с лебедкой, которая одновременно служит для самовытаскивания застрявшей машины на суше.
По его словам, никаких эстетических изысков в ходе постройки прототипа не предусматривались: в 3D-редакторе просто «обтянули» салон на 10 мест композитным кузовом, и все. У «Дрозда» действительно функциональность форм стоит на первом месте. Кузов на первом экземпляре стеклопластиковый, что несколько увеличивает итоговый вес. В перспективе конструкторы предполагают перейти на полностью карбоновый кузов. О том, как это увеличит стоимость амфибии, информации нет. При снаряженной массе в 2000 килограммов «Дрозд» способен взять на борт полторы тонны груза. Потопить амфибию без разрушения невозможно: даже с открытыми дверями лодка будет сохранять положительную плавучесть. Центр тяжести лодки расположен таким образом, что при перевороте «Дрозд» возвращается в первоначальное положение. Как и любое морское судно, амфибия оснащается якорем (расположен в запасном колесе) с лебедкой, которая одновременно служит для самовытаскивания застрявшей машины на суше.
Движение на воде амфибии обеспечивается водометным движителем с управляемым вектором тяги или поворотным соплом. Это позволяет лодке разворачиваться на воде буквально вокруг своей оси.
Это позволяет лодке разворачиваться на воде буквально вокруг своей оси.
Главной особенностью амфибии от «Балтийской машиностроительной компании» является способность выходить из воды на неприспособленный берег. Именно для этого на «Дрозде» относительно большие 40-дюймовые колеса с развитыми грунтозацепами, полноприводная трансмиссия и возможность изменения давления в шинах. Кстати, система централизованного регулирования давления в колесах появилась впервые на водоплавающих автомобилях армии США — так было проще выбираться из воды на топкий берег. И уже после войны в широкую серию систему запустили на отечественном вездеходе ЗИЛ-157. Грузовик на спущенных колесах значительно повышал свою проходимость по слабым грунтам. В дополнение ко всем вышеуказанным offroad-системам «Дрозд» оснащается блокировками всех дифференциалов и, естественно, независимой подвеской. В случае использования зависимой подвески складывания колес внутрь корпуса добиться было бы невозможно.
“Дрозд” в мореходном положении шасси. Источник: mag.auto.ru
Источник: mag.auto.ru
Внедорожная амфибия успела произвести впечатление на заокеанских журналистов, которые нарекли её машиной Джеймса Бонда. В то же время американские наблюдатели высказали сомнения о военных перспективах «Дрозда». И с ними тяжело не согласиться. Сейчас для российской армии появление подобной амфибии — явно не среди главных приоритетов. Последние десятилетия военные вообще в ней не нуждались. Со времен Советского Союза сохранились проекты плавающих автомобилей от ВАЗа и УАЗа, но должного развития они не получили. Еще раньше шли работы по обеспечению положительной плавучести грузовиков «Урал», однако и это оказалось невостребованным в армии. Вместо этого преодоление водных преград возложили на понтонные парки инженерных войск и специализированные транспортеры. Сама концепция плавающих машин, по большому счету, неполноценна. С одной стороны, лодка из машины получается не самая совершенная, а с другой — автомобиль достаточно посредственный. Примерно также обстоят дела с широко разрекламированными летающими автомобилями. Да, сейчас строятся единичные экземпляры подобной экзотики, но никто уже давно всерьез крылатые авто не воспринимает. Слишком много всего накладывается на оператора подобного универсального гаджет: и навыков управления воздушным судна требуют, и уровень риска во время полета не сравним с передвижением по суше.
Да, сейчас строятся единичные экземпляры подобной экзотики, но никто уже давно всерьез крылатые авто не воспринимает. Слишком много всего накладывается на оператора подобного универсального гаджет: и навыков управления воздушным судна требуют, и уровень риска во время полета не сравним с передвижением по суше.
Источник: rg.ru
Военным «Дрозд» подходит очень условно. В реалиях, когда противник до зубов оснащен стрелковым оружием, выпускать десять бойцов в стеклопластиковой сухопутной лодке в бой подобно убийству. Для самого примитивного бронирования у амфибии явно не хватает запаса грузоподъемности, да и перераспределение масс в данном случае негативно скажется на остойчивости судна. «Дрозд» может очень быстро перемещаться по воде — в этом его несомненный плюс. Но при эксплуатации на суше машина не может обеспечить военным даже простейшей защиты от осколков, не говоря уже о возможном подрыве. И здесь отечественные бронетранспортеры дадут сто очков вперед «Дрозду», пусть и за счет тихоходности на воде.
Наконец, вызывает вопросы и использование большого количества иностранных комплектующих. И если с дизелем Styer еще как-то можно разобраться (хотя сам Терешенков не смог) и заменить его на российский аналог, то с автоматической КПП все гораздо сложнее. В России, к сожалению, пока даже в разработке нет «автомата» подобного класса. Если, конечно, не заимствовать у представительского Aurus: агрегат для него строили в московской фирме КАТЕ.
В любом случае прецедент, когда владелец небольшой машиностроительной фирмы, производящей трубогибы и прицепы, строит на собственные деньги амфибию, не имеющую аналогов в мире, достоин уважения. Остается только надеяться, что разработка найдет своего клиента.
Автор: Евгений Федоров
Источник: https://topwar.ru/
Воспользуйтесь нашими услугами
Понравилась статья? Тогда поддержите нас, поделитесь с друзьями и заглядывайте по рекламным ссылкам!
ПОЛЕТ «ДРОЗДА» | МОДЕЛИСТ-КОНСТРУКТОР
Пожалуй, наиболее ярким и необычным экспонатом Международного военно-технического форума «Армия-2020» стал скоростной внедорожник-амфибия «Дрозд», разработанный конструкторами Балтийской Машиностроительной Компании (ООО «БМК»).
Внешне машина выглядит как пришелец из космоса. При том, что это концептуальная разработка, качество проработки и исполнения на уровне серийных образцов — хоть сегодня запускай в серию. Интерьер тоже необычный — своеобразный симбиоз дорогого катера и спорткара, что неудивительно, поскольку автомобиль предназначен для скоростного перемещения на воде и на суше, в том числе и по бездорожью.
На вопросы журнала «Моделист-конструктор» отвечает главный конструктор амфибии Сергей Терешенков.
Как родилась идея постройки «Дрозда»?
Мы давно занимается разработкой и производством комплектующих для внедорожной техники, в частности, выпускаем портальные мосты, также занимаемся реставрацией таких машин, изучаем их историю. Кроме того, море — это мое давнее хобби. Я — капитан парусной яхты, построил несколько катеров. Как-то раз мы реставрировали советскую амфибию ГАЗ-46. Их очень мало осталось, наш экземпляр использовался в деревне в качестве цветочной клумбы. Автомобиль был в ужасном состоянии, разукомплектованный, металл можно было пальцем проткнуть. Практически все пришлось воссоздавать заново. В процессе разработки технической документации по восстановлению данной машины возникла идея постройки амфибии аналогичного класса и назначения, но на новом технологическом уровне, с современными агрегатами, с более высокими техническими характеристиками. К этому времени был накоплен большой багаж знаний и технологий. Гидродинамику корпуса разрабатывал конструктор Александр Тараненко, фирма «КомпанМарин», у него 40-летний опыт проектирования и строительства катеров и яхт. Изначально была идея сделать не машину, которую предстояло научить плавать, и не лодку способную ездить, а аппарат, который на воде и на суше чувствовал бы себя, как в родной стихии.
Автомобиль был в ужасном состоянии, разукомплектованный, металл можно было пальцем проткнуть. Практически все пришлось воссоздавать заново. В процессе разработки технической документации по восстановлению данной машины возникла идея постройки амфибии аналогичного класса и назначения, но на новом технологическом уровне, с современными агрегатами, с более высокими техническими характеристиками. К этому времени был накоплен большой багаж знаний и технологий. Гидродинамику корпуса разрабатывал конструктор Александр Тараненко, фирма «КомпанМарин», у него 40-летний опыт проектирования и строительства катеров и яхт. Изначально была идея сделать не машину, которую предстояло научить плавать, и не лодку способную ездить, а аппарат, который на воде и на суше чувствовал бы себя, как в родной стихии.
Сколько времени понадобилось для разработки амфибии, есть ли планы ее серийного производства?
От идеи до воплощения прошло шесть лет Пока «Дрозд» существует в единственном экземпляре. По экспертным оценкам, потенциальный спрос на такую амфибию около 2 000 штук в год Мы такой объем не потянем, у нас нет соответствующей производственной базы. Но мы готовы к сотрудничеству, к развитию модельного ряда, нами разработан полный комплект документации, создана технологическая оснастка для серийного производства.
По экспертным оценкам, потенциальный спрос на такую амфибию около 2 000 штук в год Мы такой объем не потянем, у нас нет соответствующей производственной базы. Но мы готовы к сотрудничеству, к развитию модельного ряда, нами разработан полный комплект документации, создана технологическая оснастка для серийного производства.
Какие конструктивные особенности у амфибии «Дрозд», какими она обладает конкурентными преимуществами?
На сегодняшний день аналогов на мировом рынке у «Дрозда» нет, все существующие скоростные амфибии имеют ограниченную проходимость на бездорожье. они способны выходить из воды только на подготовленную поверхность, и наоборот, настоящие внедорожники не способны перемещаться по воде с высокой скоростью, у них ограниченная мореходность.
При движении по воле колеса амфибии втягиваются в корпусБольшой опыт по конструированию внедорожников, проектированию и производству их комплектующих позволил создать универсальную машину, способную на суше развивать скорость до 100 км/ч, на воде — до 70 км/ч. Столь высокие характеристики обеспечивает дизель Steyr мощностью 260 л.с., агрегатированный с автоматической коробкой передач. В отличие от автомобильных двигателей, где полная мощность нужна только на разгоне, да и то не всегда, при движении по водной поверхности мотор все время работает на высоких оборотах, поэтому мы выбрали Steyr в морском исполнении, который рассчитан на высокие нагрузки. Прорабатывали возможность установки отечественных двигателей, но они значительно тяжелее, а для амфибии вес имеет первостепенное значение.
Столь высокие характеристики обеспечивает дизель Steyr мощностью 260 л.с., агрегатированный с автоматической коробкой передач. В отличие от автомобильных двигателей, где полная мощность нужна только на разгоне, да и то не всегда, при движении по водной поверхности мотор все время работает на высоких оборотах, поэтому мы выбрали Steyr в морском исполнении, который рассчитан на высокие нагрузки. Прорабатывали возможность установки отечественных двигателей, но они значительно тяжелее, а для амфибии вес имеет первостепенное значение.
Чтобы построить эффективную амфибию — необходим симбиоз автомобильных и судостроительных технологий, в сочетании с культурой производства авиационной промышленности, иначе ничего не получится.
Интерьер напоминает дорогой катер или спорткарКресла — собственной разработкиПри проектировании машины мы считали каждый килограмм, многие узлы и детали здесь многофункциональные. Корпус и рама амфибии выполнены из кевлара, рама весит всего 15 кг, пассажирские сиденья собственной разработки весят 2,7 кг. На задних двустворчатых дверях размещаются радиаторы системы охлаждения двигателя, нижние створки боковых дверей можно использовать в качестве трапов, например, при спасательных операциях, поскольку в открытом положении они находятся выше ватерлинии. Запасное колесо для оптимальной развесовки установлено в передней верхней части кузова, к тому же, оно может использоваться как отбойный кранец.
На задних двустворчатых дверях размещаются радиаторы системы охлаждения двигателя, нижние створки боковых дверей можно использовать в качестве трапов, например, при спасательных операциях, поскольку в открытом положении они находятся выше ватерлинии. Запасное колесо для оптимальной развесовки установлено в передней верхней части кузова, к тому же, оно может использоваться как отбойный кранец.
Высокая культура веса позволила обеспечить большой запас плавучести, мореходность амфибии — 3 балла, но на самом деле она даже выше, просто при более высоком волнении снижается скорость передвижения. Полная масса машины 3500 кг, грузоподъемность 1500 кг. Амфибия может перевозить до 10 человек, или использоваться для перевозки различных грузов, установки вооружения.
Нижние створки боковых дверей можно использовать в качестве траповПри постройке «Дрозда» мы спроектировали и запатентовали оригинальную полноприводную трансмиссию. У машины постоянный полный привод с межосевой и межколесными блокировками, раздаточная коробка со встроенным валом отбора мощности собственной разработки. На оригинальные мосты получено 12 патентов. Все колеса убираются с помощью электроприводов. Герметичное рулевое управление также собственной разработки. Сопло водомета поворачивается вместе с передними колесами, благодаря этому на воде машина способна разворачиваться на месте. По проходимости амфибия не имеет себе равных, дорожный просвет машины составляет 360 мм. При необходимости, благодаря прочному корпусу, можно выбрасываться прямо на берег. Водометный движитель позволяет работать в замусоренных акваториях.
На оригинальные мосты получено 12 патентов. Все колеса убираются с помощью электроприводов. Герметичное рулевое управление также собственной разработки. Сопло водомета поворачивается вместе с передними колесами, благодаря этому на воде машина способна разворачиваться на месте. По проходимости амфибия не имеет себе равных, дорожный просвет машины составляет 360 мм. При необходимости, благодаря прочному корпусу, можно выбрасываться прямо на берег. Водометный движитель позволяет работать в замусоренных акваториях.
Для каких целей предназначен «Дрозд»?
Спектр применения очень широкий. Благодаря большому запасу хода (по земле 800 км, по воде 300 км) и высокой скорости, машину можно использовать для морских десантных операций, в качестве носителя различных видов оружия, в роли спасательного транспортного средства, а также в гражданских целях.
Для управления данной амфибией, наверное, требуется специальное водительское удостоверение?
Да нет, а кто ж его догонит! Шучу, конечно, необходимы права категории В и удостоверение судоводителя.
* * *
После детального знакомства с конструкцией «Дрозда» можно констатировать, что эта машина уникальна, прежде всего, своими внедорожными качествами. Хотя, стоит заметить, идея создания скоростной амфибии не нова. Еще в начале 1960-х годов в Советском Союзе была построена амфибия на подводных крыльях НАМИ-055В, позднее эти конструктивные решения были реализованы на машине ГАЗ-46Г в 1964 году, которая также не пошла в серию. Основой недостаток амфибий на подводных крыльях — сложность конструкции и большой вес, что снижает стоимость полезной нагрузки. К тому же, крылья можно легко повредить. Тем не менее, в 2004 году по такой схеме швейцарская компания Rinspeed Design сделала машину Splash.
Но все же для амфибии более предпочтительной выглядит конструкция с глиссирующим корпусом. Такие автомобили выпускает британская фирма Gibbs Technologies, однако по проходимости на суше они существенно уступают нашей разработке, да и стоят они как легкомоторный самолет.
Впереди «Дрозд» еще ждет период испытаний и доводки конструкции, и хочется пожелать разработчикам, чтобы данная машина добралась до серийного производства.
Технические характеристики амфибии «Дрозд»
Длина, мм 6000
Ширина, мм 2450
Высота, мм 2200
Дорожный просвет, мм 360
Полная масса, кг 3500
Грузоподъемность, кг 1500
Мощность двигателя, л.с 260
Максимальная скорость
на суше/на воде, км/ч 100/70
Запас хода на суше/на воде, км …. 800/300
Мореходность, баллов 3
Андрей НИКИТИН
Дрозд автомобиль амфибия — 68 фото
1
Водник (амфибия) ГАЗ-3937, 39371
2
Новая амфибия внедорожник
3
ВТС амфибия
4
Амфибия ВАТЕРКАР
5
Амфибия Ниссан
6
Машина-амфибия «Дрозд»
7
Катер амфибия Тритон-2
8
Автомобиль-амфибия WATERCAR Panther
9
Амфибия-внедорожник Дрозд
10
Амфибия Гиббс
11
Снегоболотоход Argo Aurora 950
12
Тритон 2 амфибия
13
Амфибия-внедорожник Дрозд
14
Машина амфибия Джеймса Бонда
15
Автомобиль-амфибия креатив
16
Endless Adventure Amphibious
17
Внедорожник Тритон
18
Volvo амфибия
19
Черный Дрозд амфибия
20
Hydra Spyder машина
21
Амфибия-внедорожник Дрозд
22
Глиссирующая амфибия Дрозд
23
Военный Humdinga Gibbs —военный вездеход, амфибия
24
Гибс квадскай
25
Плавающий ЛУАЗ 967
26
Глиссирующая амфибия Дрозд
27
Вездеход Дрозд
28
Ламборгини амфибия
29
Амфибия Дрозд салон
30
Автомобиль анфибия чёрный Дрозд
31
Российский автомобиль амфибия
32
Шкода амфибия
33
Дрозд автомобиль амфибия
34
Gibbs 15, 17
35
Амфибия машина Военная Дрозд
36
Gibbs Humdinga 2
37
Амфибия Дрозд
38
Амфибия 2020
39
Глиссирующая амфибия Дрозд
40
Дрозд автомобиль амфибия
41
Хонда амфибия
42
Вездеход Дрозд
43
Вездеход Дрозд
44
Chevrolet амфибия
45
Дрозд автомобиль амфибия
46
Машина-амфибия «Дрозд»
47
Новая амфибия для вс РФ
48
Hydra Spyder машина
49
Дрозд автомобиль амфибия
50
Глиссирующая машина-амфибия «Дрозд»
51
Амфибия Дрозд
52
Автомобиль амфибия Hidra
53
Водомет для амфибии
54
Глиссирующая амфибия Дрозд
55
Амфибия Аквада
56
Автомобиль Дрозд
57
Катер внедорожник
58
Вездеход Дрозд
59
Gibbs Humdinga 2
60
Humdinga Gibbs — вездеход, амфибия
61
Амфибия ВАТЕРКАР
62
Humdinga Gibbs — вездеход, амфибия
63
Кабриолет амфибия
64
Машина-амфибия «Дрозд»
65
Плавучий автомобиль
66
ВПК многоцелевая амфибия
67
Дрозд автомобиль амфибия
Как выглядит российский «Дрозд»: kirill_potapov — LiveJournal
Как выглядит российский «Дрозд»: kirill_potapov — LiveJournal ?- catIsShown({ humanName: ‘армия’ })» data-human-name=»армия»> Армия
- Птицы
- Cancel
Как заявляет производитель «Балтийская машиностроительная компания», машина практически непотопляема и способна разгоняться до 70 км/ч на воде и до 100 км/ч на суше.
Высокая проходимость позволяет использовать амфибию на дорогах общего пользования, по бездорожью, в акваториях рек, озер и морей, сообщает телеканал «Звезда».
Корпус амфибии сделан из композитных материалов, в частности углепластика. Грузоподъемность — 1,5 тонны, а весит он около 2 тонн. В десантном отделении машины помещаются до восьми человек.
Грузоподъемность — 1,5 тонны, а весит он около 2 тонн. В десантном отделении машины помещаются до восьми человек.
На амфибию можно установить различное вооружение — от пулеметов и боевых модулей до ракетных установок залпового огня. Дрозд оснащается дизельным мотором мощностью 260 л.с., который агрегатируется 3-ступенчатой автоматической коробкой передач.
Теперь выражение «дать дрозда» заиграло новыми красками:) Как вам новый российский «Дрозд»?
Фото:Антон Новодережкин/ТАСС
Tags: авто, армия, выставка, техника
Subscribe
«С теплом в душе и перцем в сердце»
Удивление! Такие прекрасные конфеты «с огоньком» нашли в новогодних подарках омским детям. В состав сладости с ликом президента входит…
Самый большой в мире самовар на колёсах
Не зря город Ирбит считается мотоциклетной столицей России. Именно здесь в годы Второй мировой войны было принято решение о переводе Московского…
Больница для простых смертных
В больнице для простых смертных можно мусор не убирать? В Ирбитской районной больнице пациентов заставляют покупать бахилы, но при этом, выносить…
Отгадай, где живёт патриот?
Пока гулял по городу Серову, случайным образом обнаружил, где живёт настоящий патриот России: Возможно, это бывший моряк, возможно, он просто…
Детский сад.
 Штаны на лямках
Штаны на лямкахВот так выражают своё отношение к происходящему в мире жители деревни Буланова, что находится в Ирбитском районе Свердловской области. В деревне,…
Патриотизм головного мозга
И вот такие экспонаты выходили вчера на праздник, посвященный Дню Победы! Кто мне скажет, что в головах у этих…как назвать их? Пруфы…
Photo
Hint http://pics.livejournal.com/igrick/pic/000r1edq
Previous
← Ctrl
← Alt
- 1
- 2
Next
Ctrl →
Alt →
- 32 comments
Previous
← Ctrl
← Alt
- 1
- 2
Next
Ctrl →
Alt →
«С теплом в душе и перцем в сердце»
Удивление! Такие прекрасные конфеты «с огоньком» нашли в новогодних подарках омским детям.
 В состав сладости с ликом президента входит…
В состав сладости с ликом президента входит…Самый большой в мире самовар на колёсах
Не зря город Ирбит считается мотоциклетной столицей России. Именно здесь в годы Второй мировой войны было принято решение о переводе Московского…
Больница для простых смертных
В больнице для простых смертных можно мусор не убирать? В Ирбитской районной больнице пациентов заставляют покупать бахилы, но при этом, выносить…
Отгадай, где живёт патриот?
Пока гулял по городу Серову, случайным образом обнаружил, где живёт настоящий патриот России: Возможно, это бывший моряк, возможно, он просто…
Детский сад. Штаны на лямках
Вот так выражают своё отношение к происходящему в мире жители деревни Буланова, что находится в Ирбитском районе Свердловской области. В деревне,…
Патриотизм головного мозга
И вот такие экспонаты выходили вчера на праздник, посвященный Дню Победы! Кто мне скажет, что в головах у этих.
 ..как назвать их? Пруфы…
..как назвать их? Пруфы…
Хлорид натрия подавляет рост и инфекционную способность амфибийного хитридиевого грибка и повышает выживаемость хозяев
1. Skerratt LF, Berger L, Speare R, Cashins S, McDonald KR, et al. Распространение хитридиомикоза вызвало быстрое глобальное сокращение и вымирание лягушек. ЭкоЗдоровье. 2007; 4: 125–134. [Google Scholar]
2. Berger L, Speare R, Daszak P, Green DE, Cunningham AA, et al. Хитридиомикоз вызывает смертность амфибий, связанную с сокращением популяции в тропических лесах Австралии и Центральной Америки. Труды Национальной академии наук Соединенных Штатов Америки. 1998;95:9031–9036. [Бесплатная статья PMC] [PubMed] [Google Scholar]
3. Stuart SN, Chanson JS, Cox NA, Young BE, Rodrigues ASL, et al. Состояние и тенденции сокращения и вымирания земноводных во всем мире. Наука. 2004; 306: 1783–1786. [PubMed] [Google Scholar]
2004; 306: 1783–1786. [PubMed] [Google Scholar]
4. Berger L, Hyatt AD, Spear R, Longcore JE. Стадии жизненного цикла Batrachochytrium dendrobatidis (Longcore), хитрида-амфибия. Болезни водных организмов. 2005; 68: 51–63. [PubMed] [Академия Google]
5. Voyles J, Berger L, Young S, Speare R, Webb R, et al. Электролитное истощение и осмотический дисбаланс у земноводных с хитридиомикозом. Болезни водных организмов. 2007; 77: 113–118. [PubMed] [Google Scholar]
6. Voyles J, Young S, Berger L, Campbell C, Voyles WF, et al. Патогенез хитридиомикоза, причины катастрофической гибели амфибий. Наука. 2009; 326: 582–585. [PubMed] [Google Scholar]
7. Пэррис М.Дж., Корнелиус Т.О. Грибной патоген вызывает конкурентный стресс и стресс развития в личиночных сообществах амфибий. Экология. 2004; 85: 3385–339.5. [Google Scholar]
8. Bd-Maps (nd) Global Bd-Mapping Project. 11 http://wwwbd-mapsnet, доступ 5/6/ [Google Scholar]
9. Бергер Л., Спиэр Р. , Хаятт А. Хитридные грибы и упадок амфибий: обзор, последствия и будущие направления. В: Кэмпбелл А, редактор. Сокращение и исчезновение австралийских лягушек. Канберра: Окружающая среда Австралии; 1999. [Google Scholar]
, Хаятт А. Хитридные грибы и упадок амфибий: обзор, последствия и будущие направления. В: Кэмпбелл А, редактор. Сокращение и исчезновение австралийских лягушек. Канберра: Окружающая среда Австралии; 1999. [Google Scholar]
10. McDonald KR, Mendez D, Muller R, Freeman AB, Spear R. Снижение распространенности хитридиомикоза в популяциях лягушек в Северном Квинсленде, Австралия. Тихоокеанская природоохранная биология. 2005; 11: 114–120. [Академия Google]
11. Retallick RW, McCallum H, Speare R. Эндемическая инфекция амфибийного хитридиевого грибка в сообществе лягушек после упадка. PloS Биология. 2004;2:e351. [Бесплатная статья PMC] [PubMed] [Google Scholar]
12. Stockwell MP, Clulow S, Clulow J, Mahony M. Воздействие хитридного гриба-амфибии Batrachochytrium dendrobatidis на зеленую и золотую лягушку-колокольчик Litoria aurea программа реинтродукции в Центре водно-болотных угодий Хантера в Австралии в районе Хантер штата Новый Южный Уэльс. Австралийский зоолог. 2008;34:379–386. [Google Scholar]
2008;34:379–386. [Google Scholar]
13. Кригер К.М., Герой Дж.М. Выживаемость диких лягушек, зараженных хитридиомикозом. ЭкоЗдоровье. 2006; 3: 171–177. [Google Scholar]
14. Harris RN, James TY, Lauer A, Simon MA, Patel A. Патоген амфибий Batrachochytrium dendrobatidis ингибируется кожными бактериями земноводных. ЭкоЗдоровье. 2006; 3: 53–56. [Google Scholar]
15. Harris RN, Lauer A, Simon MA, Banning JL, Alford RA. Добавление противогрибковых кожных бактерий к саламандрам ослабляет последствия хитридиомикоза. Болезни водных организмов. 2009 г.;83:11–16. [PubMed] [Google Scholar]
16. Роллинз-Смит, Л.А. Роль антимикробных пептидов амфибий в защите амфибий от патогенов, связанных с глобальными амфибиями, снижается. Biochimica Et Biophysica Acta-Biomembranes. 2009; 1788: 1593–1599. [PubMed] [Google Scholar]
17. Rollins-Smith LA, Carey C, Longcore JE, Doersam JK, Boutte A, et al. Активность антимикробных кожных пептидов лягушек Ranid в отношении Batrachochytrium dendrobatidis , грибка, связанного с глобальными амфибиями, снижается. Развивающая и сравнительная иммунология. 2002; 26: 471–479.. [PubMed] [Google Scholar]
Развивающая и сравнительная иммунология. 2002; 26: 471–479.. [PubMed] [Google Scholar]
18. Woodhams DC, Ardipraja K, Alford RA, Marantelli G, Reinert LK, et al. Устойчивость к хитридиомикозу различается у разных видов земноводных и коррелирует с защитой пептидов кожи. Сохранение животных. 2007; 10: 409–417. [Google Scholar]
19. Woodhams DC, Vredenburg VT, Simon MA, Billheimer D, Shakhtour B, et al. Симбиотические бактерии способствуют врожденной иммунной защите находящейся под угрозой исчезновения горной желтоногой лягушки, Rana muscosa . Биологическая консервация. 2007;138:390–398. [Google Scholar]
20. Rollins-Smith LA, Ramsey JP, Reinert LK, Woodhams DC, Livo LJ, et al. Иммунная защита Xenopus laevis против Batrachochytrium dendrobatidis . Границы в бионауке. 2009; 1:68–91. [PubMed] [Google Scholar]
21. Stice MJ, Briggs CJ. Иммунизация неэффективна для предотвращения инфекции и смертности, вызванной амфибийным хитридиевым грибком Batrachochytrium dendrobatidis . Журнал болезней диких животных. 2010;46:70–77. [PubMed] [Академия Google]
Журнал болезней диких животных. 2010;46:70–77. [PubMed] [Академия Google]
22. Гарнер TWJ, Гарсия Г., Кэрролл Б., Фишер М.С. Использование итраконазола для устранения инфекции Batrachochytrium dendrobatidis и последующая депигментация головастиков Alytes muletensis . Болезни водных организмов. 2009; 83: 257–260. [PubMed] [Google Scholar]
23. Martel A, Rooij P, Vercauteren G, Baert K, Waeyenberghe L, et al. медицинская микология; 2010. Разработка безопасного противогрибкового протокола лечения для элиминации Batrachochytrium dendrobatidis у амфибий. [PubMed] [Академия Google]
24. Тамукай К., Уне Ю., Томинага А., Судзуки К., Гока К. Журнал ветеринарной медицины; 2010. Лечение спонтанного хитридиомикоза у амфибий, содержащихся в неволе, с помощью итраконазола. [PubMed] [Google Scholar]
25. Murray KA, Retallick RWR, Puschendorf R, Skerratt LF, Rosauer D, et al. Оценка пространственных моделей риска болезней для биоразнообразия: последствия для борьбы с патогеном амфибий, Batrachochytrium dendrobatidis . Журнал прикладной экологии. 2011;48:163–173. [Академия Google]
Журнал прикладной экологии. 2011;48:163–173. [Академия Google]
26. Puschendorf R, Carnaval AC, VanDerWal J, Zumbado-Ulate H, Chaves G, et al. Модели распространения земноводных хитрид Batrachochytrium dendrobatidis в Коста-Рике: предложение климатических убежищ в качестве инструмента сохранения. Разнообразие и распространение. 2009; 15: 401–408. [Google Scholar]
27. Рон С.Р. Прогнозирование распространения возбудителя земноводных Batrachochytrium dendrobatidis в Новом Свете. Биотропика. 2005; 37: 209–221. [Академия Google]
28. Бломберг А., Адлер Л. Дженнингс Д., изд. Толерантность грибов к NaCl. Стрессоустойчивость грибов. 1993. С. 209–231.
29. Райт К.М., Уитакер Б.Р. Фармакотерапия. В: Райт К.М., Уитакер Б.Р., редакторы. Земноводная медицина и содержание в неволе. Малабар, Флорида: издательство Krieger Publishing Company; 2001. С. 309–319. [Google Scholar]
30. Mifsud C, Rowland SJ. Использование соли для борьбы с ихтиофтириозом и профилактики сапролегниоза у серебряного окуня, Bidyanus bidyanus . Исследования аквакультуры. 2008;39: 1175–1180. [Google Scholar]
Исследования аквакультуры. 2008;39: 1175–1180. [Google Scholar]
31. Li MH, Wise DJ, Robinson EH. Химическая профилактика и лечение зимнего сапролегниоза («зимней гибели») канального сома Ictalurus puncfatus . Журнал Всемирного общества аквакультуры. 1996; 27:1–6. [Google Scholar]
32. Schreier TM, Rach JJ, Howe GE. Эффективность формалина, перекиси водорода и хлорида натрия в отношении зараженной грибком икры радужной форели. Аквакультура. 1996; 140:323–331. [Google Scholar]
33. Waterstrat PR, Marking LL. Клиническая оценка применения формалина, перекиси водорода и хлорида натрия для лечения паразитарной сапролегнии на осенней икре чавычи. Прогрессивный рыбовод. 1995;57:287–291. [Google Scholar]
34. Бергер Л., Спир Р., Марантелли Г., Скерратт Л.Ф. Метод ингибирования зооспор для оценки активности противогрибковых соединений против Batrachochytrium dendrobatidis и безуспешное лечение экспериментально инфицированных зеленых древесных лягушек ( Litoria cerulea ) флуконазолом и хлоридом бензалкония. Исследования в области ветеринарии. 2009; 87: 106–110. [PubMed] [Google Scholar]
Исследования в области ветеринарии. 2009; 87: 106–110. [PubMed] [Google Scholar]
35. Джонсон М.Л., Бергер Л., Филипс Л., Спиэр Р. Фунгицидное действие химических дезинфицирующих средств, УФ-излучения, высыхания и тепла на хитрид амфибий Batrachochytrium dendrobatidis . Болезни водных организмов. 2003; 57: 255–260. [PubMed] [Google Scholar]
36. Sparling DW. Критерии качества воды для амфибий. В: Додд CKJ, редактор. Экология и охрана амфибий. Нью-Йорк: Издательство Оксфордского университета; 2010. С. 105–120. [Google Scholar]
37. Stockwell MP, Clulow J, Mahony MJ. Эффективность окрашивания жизнеспособности SYBR 14/йодидом пропидия в отношении амфибийного хитридного гриба Batrachochytrium dendrobatidis . Болезни водных организмов. 2010; 88: 177–181. [PubMed] [Академия Google]
38. Спиэр Р., Бергер Л. Статус хитридиомикоза диких амфибий в Австралии. 2005; 12 http://wwwjcueduau/school/phtm/PHTM/frogs/chy-au-statushtm Доступ 14/3/ [Google Scholar]
39. Berger L, Marantelli G, Skerratt LF, Speare R. Virulence of the амфибийный хитридный гриб Batrachochytrium dendrobatidis зависит от штамма. Болезни водных организмов. 2005; 68: 47–50. [PubMed] [Google Scholar]
Berger L, Marantelli G, Skerratt LF, Speare R. Virulence of the амфибийный хитридный гриб Batrachochytrium dendrobatidis зависит от штамма. Болезни водных организмов. 2005; 68: 47–50. [PubMed] [Google Scholar]
40. Boyle DB, Boyle DB, Olsen V, Morgan JAT, Hyatt AD. Быстрое количественное определение хитридиомикоза ( Batrachochytrium dendrobatidis ) в образцах амфибий с использованием ПЦР Taqman в реальном времени. Болезни водных организмов. 2004; 60: 141–148. [PubMed] [Google Scholar]
41. McConnell TH. Балтимор, США: Липпинкотт, Уильямс и Уилкинс; 2007. Природа болезни. [Google Scholar]
42. Stockwell MP, Clulow J, Mahony MJ. Виды-хозяева определяют, превышает ли инфекционная нагрузка пороговые значения, вызывающие заболевание, после воздействия амфибийного хитридиевого гриба. Сохранение животных. 2010; 13:62–71. [Академия Google]
43. Вреденбург В.Т., Кнапп Р.А., Танстолл Т.С., Бриггс С.Дж. Динамика возникающих болезней приводит к крупномасштабному вымиранию популяций амфибий. Труды Национальной академии наук. 2010;107:9689–9694. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Труды Национальной академии наук. 2010;107:9689–9694. [Бесплатная статья PMC] [PubMed] [Google Scholar]
44. Carey C, Bruzgul JE, Livo LJ, Walling ML, Kuehl KA, et al. Экспериментальное воздействие на бореальных жаб ( Bufo boreas ) патогенного хитридиевого грибка ( Batrachochytrium dendrobatidis ). ЭкоЗдоровье. 2006; 3: 5–21. [Академия Google]
45. Berger L, Speare R, Hines H, Marantelli G, Hyatt AD, et al. Влияние сезона и температуры на смертность земноводных от хитридиомикоза. Австралийский ветеринарный журнал. 2004; 82: 434–440. [PubMed] [Google Scholar]
46. Вудхэмс Д.С., Алфорд Р.А., Марантелли Г. Новые болезни амфибий, излечиваемые повышенной температурой тела. Болезни водных организмов. 2003; 55: 65–67. [PubMed] [Google Scholar]
47. Мосс А.С., Редди Н.С., Дортаж И.М., Франсиско М.Дж.С. Хемотаксис амфибийного возбудителя Batrachochytrium dendrobatidis и его реакция на различные аттрактанты. Микология. 2008; 100:1–5. [PubMed] [Google Scholar]
48. Gleason FH, Midgley DJ, Letcher PM, McGee PA. Может ли почва Chytridiomycota выживать и расти при различных осмотических потенциалах? Микологические исследования. 2006; 110:869–875. [PubMed] [Google Scholar]
Gleason FH, Midgley DJ, Letcher PM, McGee PA. Может ли почва Chytridiomycota выживать и расти при различных осмотических потенциалах? Микологические исследования. 2006; 110:869–875. [PubMed] [Google Scholar]
49. Rachowicz LJ, Hero J-M, Alford R, Taylor SK, Morgan LA, et al. Гипотеза нового и эндемического патогена: конкурирующие объяснения происхождения возникающих инфекционных заболеваний диких животных. Биология сохранения. 2005;19: 1441–1448. [Google Scholar]
50. Стоквелл член парламента. Кандидатская диссертация, Университет Ньюкасла; 2011. Воздействие и смягчение последствий новой инфекционной болезни хитридиомикоза на находящихся под угрозой исчезновения зеленых и золотых лягушек-колокольчиков. [Google Scholar]
51. Кэри С., Коэн Н., Роллинз-Смит Л. Снижение амфибий: иммунологическая перспектива. Развивающая и сравнительная иммунология. 1999; 23: 459–472. [PubMed] [Google Scholar]
52. Halse SA, Ruprecht JK, Pinder AM. Засоление и перспективы биоразнообразия рек и водно-болотных угодий юго-западной Австралии. Австралийский журнал ботаники. 2003; 51: 673–688. [Академия Google]
Австралийский журнал ботаники. 2003; 51: 673–688. [Академия Google]
53. Маккензи Н.Л., Бербидж А.Х., Рольф Дж.К. Влияние солености на мелких наземных животных в пшеничном поясе Западной Австралии. Австралийский журнал ботаники. 2003; 51: 725–740. [Google Scholar]
Грибковые инфекции у животных: лоскутное одеяло из разных ситуаций
1. Колер Дж.Р., Касадевалл А., Перфект Дж. Спектр грибов, поражающих человека. Колд Спринг Харб Перспект Мед. 2015 г.; 5:a019273. [Бесплатная статья PMC] [PubMed] [Google Scholar]
2. Фишер М.С., Хенк Д.А., Бриггс С.Дж. и др.. Новые грибковые угрозы здоровью животных, растений и экосистем. Природа. 2012 г.; 484: 186–194. [Бесплатная статья PMC] [PubMed] [Google Scholar]
3. Касадеваль А, Пирофски Л.А. Взаимодействие хозяин-патоген: основные понятия микробного комменсализма, колонизации, инфекции и болезни. Заразить иммун. 2000 г.; 68: 6511–6518. [Бесплатная статья PMC] [PubMed] [Google Scholar]
4.
Гуарро Дж. , Джин Дж. Стчигель А.М.
Развитие таксономии грибов. Clin Microbiol Rev. 1999; 12: 454–500. [Бесплатная статья PMC] [PubMed] [Google Scholar]
, Джин Дж. Стчигель А.М.
Развитие таксономии грибов. Clin Microbiol Rev. 1999; 12: 454–500. [Бесплатная статья PMC] [PubMed] [Google Scholar]
5. Сейедмусави С., Гийо Дж., Толооэ А. и др.. Забытые грибковые зоонозы: скрытые угрозы человеку и животным. Клин Микробиол Инфект. 2015 г.; 21: 416–425. [PubMed] [Академия Google]
6. Джонс К.Е., Патель Н.Г., Леви М.А. и др.. Глобальные тенденции новых инфекционных заболеваний. Природа. 2008 г.; 451: 990–993. [Бесплатная статья PMC] [PubMed] [Google Scholar]
7. Сейедмусави С., Гийо Дж., Арне П. и др.. Аспергиллез и аспергиллез у диких и домашних животных: глобальная проблема здравоохранения, имеющая параллели с болезнями человека. Мед Микол. 2015 г.; 53: 765–797. [PubMed] [Google Scholar]
8. Скажи ЛА. Аспергиллез млекопитающих и птиц: влияние на ветеринарию. Мед Микол. 2005 г.; 43: С71–73. [PubMed] [Академия Google]
9.
Питт Дж.
Текущая роль Aspergillus и Penicillium в здоровье человека и животных. J Med Vet Mycol. 1994 год; 32: 17–32. [PubMed] [Google Scholar]
J Med Vet Mycol. 1994 год; 32: 17–32. [PubMed] [Google Scholar]
10. Хайтман Дж. Микробные возбудители в царстве грибов. Fungal Biol Rev. 2011; 25: 48–60. [Бесплатная статья PMC] [PubMed] [Google Scholar]
11. Петерсон С.В., Варга Дж., Фрисвад Дж.К. и др.. Филогения и подродовая систематика Aspergillus. Wageningen: Wageningen Academic Publishers, 2008. [Google Scholar]
12. Змейли О.С., Субани АО. Легочный аспергиллез: клиническое обновление. QJM. 2007 г.; 100: 317–334. [PubMed] [Google Scholar]
13. Ямаути Х., Такай Ю., Ямасаки Х. и др.. Масса грудной клетки яванского макака (Macaca fascicularis). Вет Патол. 2011 г.; 48: Е1–5. [PubMed] [Google Scholar]
14. Ким К., CD Харвелла. Взлет и падение шестилетней коралло-грибковой эпизоотии. Я Нат. 2004 г.; 164: С52–63. [PubMed] [Google Scholar]
15.
Паддак М.Дж., Рейнольдс Д.Д., Агилар С. и др..
Недавнее сокращение численности карибских рифовых рыб в масштабах всего региона. Карр Биол. 2009 г.; 19: 590–595. [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
16. Нагелькеркен И., Грол М.Г., Мамби П.Дж. Влияние морских заповедников в сравнении с наличием ареалов нагула на структуру сообществ рифовых рыб. ПЛОС Один. 2012 г.; 7: e36906. [Бесплатная статья PMC] [PubMed] [Google Scholar]
17. Бейли Л. Инфекционные болезни пчел. Лондон: Земельная книга, 1963. [Google Scholar]
18. Гиллиам М., Ванденберг Д.Д. Грибы. Медина, Огайо: А.И. Root Company, 1997. [Google Scholar]
19. Бернсайд CE. Грибковые болезни медоносной пчелы. Технический бюллетень Министерства сельского хозяйства США 1930: 149. [Google Scholar]
20. Гирлинг С.Дж., Фрейзер М.А. Лечение инфекции видов Aspergillus у рептилий итраконазолом в метаболически масштабируемых дозах. Ветеринар Рек. 2009 г.; 165: 52–54. [PubMed] [Google Scholar]
21. Джейкобсон Э.Р., Читвуд Дж.Л., Максвелл Л.К. Микотические болезни рептилий. J Exotic Pet Med. 2000 г.; 9: 94–101. [Google Scholar]
22.
Арне П., Тьерри С. , Ван Д и др.. Aspergillus fumigatus у домашней птицы. Int J Microbiol. 2011 г.; 2011: 746356. [Бесплатная статья PMC] [PubMed] [Google Scholar]
, Ван Д и др.. Aspergillus fumigatus у домашней птицы. Int J Microbiol. 2011 г.; 2011: 746356. [Бесплатная статья PMC] [PubMed] [Google Scholar]
23. Бернарт Л.А., Пасманс Ф., Ван Вайенберге Л. и др.. Инфекции Aspergillus у птиц: обзор. Авиан Патол. 2010 г.; 39: 325–331. [PubMed] [Google Scholar]
24. Mc Dougle HC, Vaught RW. Эпизоотия аспергиллеза канадских гусей. Дж Управление дикой природой 1968; 32: 577–578. [Google Scholar]
25. Кункл Р.А., Сакко Р.Э. Восприимчивость выздоравливающих индеек к легочному аспергиллезу. Авиан Дис. 1998 год; 42: 787–790. [PubMed] [Академия Google]
26. Шарман М.Дж., Мэнсфилд CS. Синоназальный аспергиллез у собак: обзор. J Small Anim Pract. 2012 г.; 53: 434–444. [PubMed] [Google Scholar]
27. Баррс В.Р., Холлидей С., Мартин П. и др.. Синоназальный и синоорбитальный аспергиллез у 23 кошек: этиология, клинико-патологические особенности и результаты лечения. Вет Дж. 2012; 191: 58–64. [PubMed] [Google Scholar]
28. Баррс В.Р., Талбот Дж.Дж.
Аспергиллез кошек. Ветеринарные клиники Северной Америки. 2014; 44: 51–73. [PubMed] [Академия Google]
Баррс В.Р., Талбот Дж.Дж.
Аспергиллез кошек. Ветеринарные клиники Северной Америки. 2014; 44: 51–73. [PubMed] [Академия Google]
29. Sharp NJH HC, Салливан М. Назальный аспергиллез/пенициллез собак. Compend Cont Educ Pract Vet. 1991 год; 13: 41–49. [Google Scholar]
30. Барачетти Л., Мортелларо С.М., Ди Джанкамильо М. и др.. Двусторонний орбитальный и назальный аспергиллез у кошки. Вет офтальмол. 2009 г.; 12: 176–182. [Бесплатная статья PMC] [PubMed] [Google Scholar]
31. Гамильтон Х.Л., Уитли Р.Д., Маклафлин С.А. Экзофтальм, вторичный по отношению к аспергиллезу у кошки. J Am Anim Hosp Assoc. 2000 г.; 36: 343–347. [PubMed] [Академия Google]
32. Кано Р., Итамото К., Окуда М. и др.. Выделение Aspergillus udagawae из летального случая орбитального аспергиллеза кошек. Микозы. 2008 г.; 51: 360–361. [PubMed] [Google Scholar]
33.
Barrs VR, van Doorn TM, Houbraken J и др.. Aspergillus felis sp. nov., нового агента инвазивного аспергиллеза у людей, кошек и собак. Плос Один. 2013; 8: e64871. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Плос Один. 2013; 8: e64871. [Бесплатная статья PMC] [PubMed] [Google Scholar]
34. Пантенни С.Б., Ван Ю., Форсберг Н.Е. Микотические инфекции у домашнего скота: последние данные и исследования по этиологии, диагностике и профилактике синдрома геморрагического кишечника. Юго-западная конференция по вопросам питания и управления. Тусон: Университет Аризоны, факультет зоотехники, 49 лет.63. [Google Scholar]
35. Добесова О., Шварц Б., Вельде К. и др.. Микоз горлового мешка у лошадей: ретроспективное исследование 28 случаев. Ветеринарная рек. 2012 г.; 171: 561. [PubMed] [Google Scholar]
36. Бломм Э., Дель Пьеро Ф., Ла Перл КМД и др.. Аспергиллез у лошадей: обзор. Ветеринарное образование лошадей. 1998 год; 10: 86–93. [Google Scholar]
37. Сансом Дж., Фезерстоун Х., Барнетт К.С. Кератомикоз у шести лошадей в Соединенном Королевстве. Ветеринарная рек. 2005 г.; 156: 13–17. [PubMed] [Академия Google]
38.
Вада С., Хобо С., Оде Х. и др..
Кератомикоз лошадей в Японии. Вет офтальмол. 2013; 16: 1–9. [PubMed] [Google Scholar]
Вет офтальмол. 2013; 16: 1–9. [PubMed] [Google Scholar]
39. Скотти Н. Кератомикоз лошадей. Clin Tech Equine Pract. 2005 г.; 4: 29–46. [Google Scholar]
40. Абдо В., Кавачи Т., Сакаи Х. и др.. Диссеминированный микоз косатки ( Orcinus orca ). Джей Вет Диагн Инвест. 2012 г.; 24: 211–218. [PubMed] [Google Scholar]
41. Хаустейн С.В., Колтерман А.Дж., Сундблад Дж.Дж. и др.. Инфекции нечеловеческих приматов после трансплантации органов. ИЛАР Дж. 2008; 49: 209–219. [Бесплатная статья PMC] [PubMed] [Google Scholar]
42. Хоффманн К., Павловска Дж., Вальтер Г. и др.. Семейная структура Mucorales: синоптическая ревизия, основанная на комплексных мультигенных генеалогиях. Персония. 2013; 30: 57–76. [Бесплатная статья PMC] [PubMed] [Google Scholar]
43. Дженсен ХЭ. Системный аспергиллез крупного рогатого скота и зигомикоз в Дании со ссылкой на патогенез, патологию и диагностику. Дополнение АПМИС. 1994 год; 42: 1–48. [PubMed] [Академия Google]
44. Cunha SC, Aguero C, Damico CB и др..
Перфорация двенадцатиперстной кишки, вызванная видами Rhizomucor у кошки. J Feline Med Surg. 2011 г.; 13: 205–207. [PubMed] [Google Scholar]
Cunha SC, Aguero C, Damico CB и др..
Перфорация двенадцатиперстной кишки, вызванная видами Rhizomucor у кошки. J Feline Med Surg. 2011 г.; 13: 205–207. [PubMed] [Google Scholar]
45. Мьюир М., Райдал С.Р. Некротизирующий вентрикулит вследствие комбинированной инфекции Rhizopus microsporus var. chinensis и Candida krusei у попугая-эклектуса ( Eclectus roratus ). Ауст Вет Дж. 2012; 90: 277–280. [PubMed] [Google Scholar]
46. Рейнальди Ф.Дж., Джакобони Г., Кордова С.Б. и др.. Мукормикоз вследствие Saksenaea vasiformis у собаки. Med Mycol Case Rep. 2017; 16: 4–7. [Бесплатная статья PMC] [PubMed] [Google Scholar]
47. Guillot J, Collobert C, Jensen HE и др.. Два случая мукормикоза лошадей, вызванного Absidia corymbifera. Ветеринар по лошадям Дж. 2000; 32: 453–456. [PubMed] [Google Scholar]
48.
Тирион-Делаланд С., Гийо Дж., Дженсен Х.Э. и др..
Распространенный острый сопутствующий аспергиллез и мукормикоз у пони. J Vet Med A. 2005; 52: 121–124. [PubMed] [Академия Google]
J Vet Med A. 2005; 52: 121–124. [PubMed] [Академия Google]
49. Исидоро-Айза М., Перес Л., Кабанес Ф.Дж. и др.. Мукормикоз центральной нервной системы, вызванный Cunninghamella bertholletiae у афалин ( Tursiops truncatus ). Дж. Уайлдл Дис. 2014; 50: 634–638. [PubMed] [Google Scholar]
50. Дженсен Х.Э., Шонхейдер Х., Йоргенсен Дж.Б. Кишечный и легочный микотический лимфаденит крупного рогатого скота. J Комп Патол. 1990 г.; 102: 345–355. [PubMed] [Google Scholar]
51. Дженсен Х.Е., Олсен С.Н., Албек Б. Гастроинтестинальный аспергиллез и зигомикоз крупного рогатого скота. Вет Патол. 1994; 31: 28–36. [PubMed] [Google Scholar]
52. Дженсен Х.Э., Бассе А., Альбек Б. Микозы желудочных отделов крупного рогатого скота. Акта Вет Сканд. 1989 год; 30: 409–423. [Бесплатная статья PMC] [PubMed] [Google Scholar]
53. Карраско Л., Сьерра М.А., Шонхейдер Х. и др.. Зигомикоз рубца и сычуга овец. Малый жвачный Res. 1993 год; 10: 357–362. [Google Scholar]
54. Дженсен HE, Монтерос AEDL, Карраско Л.
Мастит коз, вызванный аспергиллезом и зигомикозом: патологоанатомическое и иммуногистохимическое исследование. J Комп Патол. 1996; 114: 183–191. [PubMed] [Google Scholar]
Дженсен HE, Монтерос AEDL, Карраско Л.
Мастит коз, вызванный аспергиллезом и зигомикозом: патологоанатомическое и иммуногистохимическое исследование. J Комп Патол. 1996; 114: 183–191. [PubMed] [Google Scholar]
55. Дженсен Х.Э., Аальбек Б., Бассе А. и др.. Возникновение грибов в тканях крупного рогатого скота в зависимости от входных ворот и факторов окружающей среды. J Комп Патол. 1992 год; 107: 127–140. [PubMed] [Google Scholar]
56. Ортега Дж., Узал Ф.А., Уокер Р. и др.. Зигомикотический лимфаденит убойного откормочного скота. Вет Патол. 2010 г.; 47: 108–115. [PubMed] [Google Scholar]
57. Дженсен Х.Э., Крог Х.В., Шонхейдер Х. Микотический аборт крупного рогатого скота – сравнительное исследование методов диагностики. Zentralbl Veterinarmed B. 1991; 38: 33–40. [PubMed] [Google Scholar]
58.
Шереди Л, Сентирмай К.
Желудочный зигомикоз у свиньи с мультисистемным синдромом истощения после отъема — отчет о клиническом случае. Акта Вет Хунг. 2008 г.; 56: 207–213. [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
59. Авадин В., Мосбах Э., Юссеф Э.С. и др.. Случай подкожной деструктивной опухоли лица у собаки, вызванной видов Mucor . J Vet Sci Med Diag. 2015 г.; 4; дои: 10.4172/2325-9590.1000163. [Google Scholar]
60. Судзута Ф., Кимура К., Уракава Р. и др.. Вариации морфологии Rhizomucor pusillus при гранулематозных поражениях магеллановых пингвинов ( Spheniscus magellanicus ). J Vet Med Sci. 2015 г.; 77: 1029–1031. [Бесплатная статья PMC] [PubMed] [Google Scholar]
61. Джеффри Дж. С., Чин Р. П., Шивапрасад Х. Л. и др.. Провентрикулит и вентрикулит, связанные с зигомикозом у страусиных цыплят. Авиан Дис. 1994 год; 38: 630–634. [PubMed] [Google Scholar]
62. Гульбахар М.Ю., Агаоглу З., Бийик Х. и др.. Зигомикотический провентрикулит и вентрикулит у страусов ( Struthio camelus ) с импакцией. Ост Вет Дж. 2000; 78: 247–249. [PubMed] [Google Scholar]
63.
Карраско Л., Гомес-Вильямандос Х.С., Дженсен Х.Э.
Системный кандидоз и сопутствующие аспергиллез и зигомикоз у двух амазонских попугаев ( Amazona aestiva ). Микозы. 1998 год; 41: 297–301. [PubMed] [Google Scholar]
Микозы. 1998 год; 41: 297–301. [PubMed] [Google Scholar]
64. де лос Монтерос А.Е., Карраско Л., Кинг Дж.М. и др.. Носовой зигомикоз и легочный аспергиллез у американского бизона. Дж. Уайлдл Дис. 1999 г.; 35: 790–795. [PubMed] [Google Scholar]
65. Барнетт Дж. Э., Дэвисон Н. Дж., Торнтон С. М. и др.. Системный мукормикоз у хохлача ( Cystophora cristata ). J Zoo Wildl Med. 2011 г.; 42: 338–341. [PubMed] [Google Scholar]
66. Моран Г., Коулман Д., Салливан Д. Знакомство с важными с медицинской точки зрения видами Candida . В: Calderone RA, Clancy CJ, eds., Candida and Candidiasis, Washington, DC: ASM Press, 2012. [Google Scholar]
67. Япар Н. Эпидемиология и факторы риска инвазивного кандидоза. Ther Clin Risk Manag. 2014; 10: 95–105. [Бесплатная статья PMC] [PubMed] [Google Scholar]
68.
Бассетти М., Мерелли М., Риги Э. и др..
Эпидемиология, распространение видов, противогрибковая чувствительность и исход кандидемии в пяти местах в Италии и Испании. Дж. Клин Микробиол. 2013; 51: 4167–4172. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Дж. Клин Микробиол. 2013; 51: 4167–4172. [Бесплатная статья PMC] [PubMed] [Google Scholar]
69. Дикема Д., Арбефевиль С., Бойкен Л. и др.. Изменение эпидемиологии кандидемии, связанной с оказанием медицинской помощи, за три десятилетия. Диагностика Microbiol Infect Dis. 2012 г.; 73: 45–48. [PubMed] [Google Scholar]
70. Льюис РЭ. Обзор изменяющейся эпидемиологии кандидемии. Curr Med Res Opin. 2009 г.; 25: 1732–1740. [PubMed] [Google Scholar]
71. Мобон Д., Гарно С., Каландра Т. и др.. Резистентность Candida spp. к противогрибковым препаратам в отделении интенсивной терапии: где мы сейчас? Интенсивная терапия Мед. 2014; 40: 1241–1255. [PubMed] [Google Scholar]
72. Паппас П.Г. Инвазивный кандидоз. Заразить Dis Clin North Am. 2006 г.; 20: 485–506. [PubMed] [Google Scholar]
73. Пфаллер М.А., Дикема Д.Дж. Эпидемиология инвазивного кандидоза: постоянная проблема общественного здравоохранения. Clin Microbiol Rev 2007; 20: 133–163. [Бесплатная статья PMC] [PubMed] [Google Scholar]
74. Шансы ФК.
Экология Candida и эпидемиология кандидоза. В: Кандида и кандидоз. Лондон: Байер Тиндалл, 1988: 68–93. [Google Академия]
Шансы ФК.
Экология Candida и эпидемиология кандидоза. В: Кандида и кандидоз. Лондон: Байер Тиндалл, 1988: 68–93. [Google Академия]
75. Аль-Ясири М.Х., Норманд А.С., Пиарру Р. и др.. Сообщества кишечных дрожжей в Larus michahellis из различных гнездовых колоний. Мед Микол. 2016; 55: 436–444. [PubMed] [Google Scholar]
76. Пачинская Я.А. Дрожжеподобные грибы и дрожжи, выделенные от здоровых племенных лошадей. Польский J Vet Sci. 2013; 16:69–76. [PubMed] [Google Scholar]
77. Розански П, Сласка Б, Розанска Д. Распространенность дрожжей у чистокровных английских кобыл. Микопатология. 2013; 175: 339–344. [Бесплатная статья PMC] [PubMed] [Google Scholar]
78. Brito EH, Fontenelle RO, Brilhante RS и др.. Анатомическое распределение и антимикробная чувствительность видов дрожжей, выделенных от здоровых собак. Вет Дж. 2009; 182: 320–326. [PubMed] [Google Scholar]
79.
Odds FC, Davidson AD, Jacobsen MD и др..
9Поддержание, замена и микровариация штамма 0009 Candida albicans , продемонстрированные мультилокусным типированием последовательности. Дж. Клин Микробиол. 2006 г.; 44: 3647–3658. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Дж. Клин Микробиол. 2006 г.; 44: 3647–3658. [Бесплатная статья PMC] [PubMed] [Google Scholar]
80. Нуччи М., Анаисси Э. Возвращаясь к источнику кандидемии: кожа или кишечник? 2001 г.; 33: 1959–1967. [PubMed] [Google Scholar]
81. Ван Катсем Дж., Рошетт Ф. Микозы у домашних животных. Бирс, Бельгия: Исследовательский фонд Янссен, 1991. [Google Scholar]
82. Куинн БКМ П.Дж., Картер М.Е., Доннелли В.Дж., Леонард Ф.К. Ветеринарная микробиология и микробные заболевания. Оксфорд, Великобритания: Blackwell Science, 2002. [Google Scholar]
83. Полман Л.М., Ченгаппа М.М. ветеринарная микробиология; Дрожжи — Cryptococcus, Malassezia и Candida: Wiley-Blackwell, 2013. [Google Scholar]
84. Эггиманн П., Питт Д. Индекс колонизации Candida и последующая инфекция у тяжелобольных хирургических пациентов: 20 лет спустя. Интенсивная терапия Мед. 2014; 40: 1429–1448. [Бесплатная статья PMC] [PubMed] [Google Scholar]
85.
Кульберг Б.Дж., Арендруп М. К.
Инвазивный кандидоз. N Engl J Med. 2015 г.; 373: 1445–1456. [PubMed] [Академия Google]
К.
Инвазивный кандидоз. N Engl J Med. 2015 г.; 373: 1445–1456. [PubMed] [Академия Google]
86. Yurayart C, Chindamporn A, Suradhat S и др.. Сравнительный анализ частоты, распределения и размеров популяций дрожжей, связанных с себорейным дерматитом собак и здоровой кожей. Вет микробиол. 2011 г.; 148: 356–362. [PubMed] [Google Scholar]
87. Ли Х.А., Хонг С., Чхве О и др.. Пристеночный фолликулит и алопеция с кожным кандидозом у гончей собаки. Лабораторные животные Res. 2011 г.; 27: 63–65. [Бесплатная статья PMC] [PubMed] [Google Scholar]
88. Моретти А., Постераро Б., Бонсио Л. и др.. Диффузный кожный кандидоз у собаки: диагностика методом ПЦР-РЭА. Преподобный Ибероам Миколог. 2004 г.; 21: 139–142. [PubMed] [Google Scholar]
89. Мюллер Р.С., Беттеней С.В., Шипстоун М. Кандидоз кожи у собаки, вызванный Candida guilliermondii . Ветеринар Рек. 2002 г.; 150: 728–730. [PubMed] [Google Scholar]
90.
Макьюэн Н.А.
Инфекции Malassezia и Candida у бультерьеров с летальным акродерматитом. J Small Anim Pract. 2001 г.; 42: 291–297. [PubMed] [Google Scholar]
J Small Anim Pract. 2001 г.; 42: 291–297. [PubMed] [Google Scholar]
91. Бланко Дж.Л., Гедеха-Маррон Дж., Онтесильяс Р. и др.. Микробиологическая диагностика хронического наружного отита у собак. Zentralbl Veterinarmed B. 1996; 43: 475–482. [PubMed] [Google Scholar]
92. Дейл Дж. Э. Дерматоз собак, вызванный Candida parapsilosis . Вет мед. 1972 год; 67: 548–549. [PubMed] [Google Scholar]
93. McKellar QA, Rycroft A, Anderson L и др.. Наружный отит в стае фоксхаундов, связанный с Candida albicans . Ветеринарная рек. 1990 г.; 127: 15–16. [PubMed] [Google Scholar]
94. Бернардо Ф.М., Мартинс Х.М., Мартинс М.Л. Обследование микотического наружного отита собак в Лиссабоне. Преподобный Ибероам Миколог.1998; 15: 163–165. [PubMed] [Google Scholar]
95.
Редиг П.
Грибковые инфекции у птиц II: Candida , Криптококкоз и птичьи желудочные бактерии (FKA Megabacteria). Североамериканская ветеринарная конференция;
Орландо, Флорида, США. [Google Scholar]
[Google Scholar]
96. Дхама К., Чакраборти С., Верма А.К. и др.. Грибковые/микотические болезни птицы — диагностика, лечение и контроль: обзор. Пак J Biol Ssci. 2013; 16: 1626–1640. [PubMed] [Google Scholar]
97. Харрисон Г.Дж., Лайтфут Т. Клиническая птичья медицина. 1 . Палм-Бич, Флорида: Spix Publishing, 2005. [Google Scholar]
98. МакКлюр Дж.Дж., Аддисон Дж.Д., Миллер Р.И. Иммунодефицит проявляется кандидозом полости рта и бактериальной септицемией у жеребят. J Am Vet Med Assoc. 1985 год; 186: 1195–1197. [PubMed] [Google Scholar]
99. Гросс Т.Л., Мэйхью И.Г. Желудочно-пищеводные язвы и кандидоз у жеребят. J Am Vet Med Assoc. 1983 год; 182: 1370–1373. [PubMed] [Google Scholar]
100. Злотовский П., Розза Д.Б., Пескадор К.А. и др.. Слизисто-кожный кандидоз у двух свиней с мультисистемным синдромом истощения после отъема. Вет Дж. 2006; 171: 566–569. [PubMed] [Google Scholar]
101.
Брэдфорд К., Мейнкот Дж., Маккирнен К. и др. . Candida перитонит у собак: отчет о 5 случаях. Ветеринар Клин Патол. 2013; 42: 227–233. [PubMed] [Google Scholar]
. Candida перитонит у собак: отчет о 5 случаях. Ветеринар Клин Патол. 2013; 42: 227–233. [PubMed] [Google Scholar]
102. Онг Р.К., Раисис А.Л., Суинделлс К.Л. Candida albicans перитонит у собаки. J Vet Emerg Cri Care. 2010 г.; 20: 143–147. [PubMed] [Google Scholar]
103. Берджесс Х.Дж., Гонт М.С. Патология на практике: Перитонит, вызванный инфекцией C albicans у собаки. J Am Vet Med Assoc. 2014; 245: 1107–1109. [PubMed] [Google Scholar]
104. Роджерс С.Л., Гибсон С., Митчелл С.Л. и др.. Диссеминированный кандидоз, вторичный по отношению к грибковому и бактериальному перитониту у молодой собаки. J Vet Emerg Crit Care. 2009 г.; 19: 193–198. [PubMed] [Google Scholar]
105. Duchaussoy AC, Rose A, Talbot JJ и др.. Желудочно-кишечная гранулема, вызванная Candida albicans , у иммунокомпетентной кошки. Med Mycol Case Rep. 2015; 10: 14–17. [Бесплатная статья PMC] [PubMed] [Google Scholar]
106.
Кано Р., Хаттори Ю. , Окузуми К. и др..
Обнаружение и идентификация видов Candida по анализу 25S рибосомной ДНК в моче при кандидозном цистите. J Vet Med Sci. 2002 г.; 64: 115–117. [PubMed] [Google Scholar]
, Окузуми К. и др..
Обнаружение и идентификация видов Candida по анализу 25S рибосомной ДНК в моче при кандидозном цистите. J Vet Med Sci. 2002 г.; 64: 115–117. [PubMed] [Google Scholar]
107. Пресслер Б.М., Ваден С.Л., Лейн И.Ф. и др.. Candida spp. инфекции мочевыводящих путей у 13 собак и семи кошек: предрасполагающие факторы, лечение и исход. J Am Anim Hosp Assoc. 2003 г.; 39: 263–270. [PubMed] [Google Scholar]
108. Альварес-Перес С., Гарсия М.Е., Кутули М.Т. и др.. Приобретенная устойчивость к мультиазолам у Candida tropicalis при персистирующей инфекции мочевыводящих путей у собаки. Med Mycol Case Rep. 2016; 11: 9–12. [Бесплатная статья PMC] [PubMed] [Google Scholar]
109. Озава Х., Окабаяси К., Кано Р. и др.. Быстрая идентификация Candida tropicalis при цистите собак. Микопатология. 2005 г.; 160: 159–162. [PubMed] [Google Scholar]
110.
Толл Дж., Эш К.М., Трепанье Л.А.
Внутрипузырное введение клотримазола для лечения кандидурии у кошки с сахарным диабетом. J Am Vet Med Assoc. 2003 г.; 223: 1156–1158, 29. [PubMed] [Google Scholar]
J Am Vet Med Assoc. 2003 г.; 223: 1156–1158, 29. [PubMed] [Google Scholar]
111. Джин И, Лин Д. Грибковые инфекции мочевыводящих путей у собак и кошек: ретроспективное исследование (2001-2004 гг.). J Am Anim Hosp Assoc. 2005 г.; 41: 373–381. [PubMed] [Google Scholar]
112. Фултон Р.Б. младший, Уокер Р.Д. Candida albicans уроцистит у кошки. J Am Vet Med Assoc. 1992 год; 200: 524–526. [PubMed] [Google Scholar]
113. Эндерс А., Ван дер Вурдт А., Донован Т. Эндогенный микотический эндофтальмит у собаки с кандидурией и синдромом Эванса. Вет офтальмол. 2017; 20: 84–88. [PubMed] [Академия Google]
114. Сикдар А., Сингх Г., Банерджи М.С. и др.. Выделение Candida pseudotropicalis из случаев аборта у кобыл: примечание. Индийская J Animal Sci. 1972 год; 42: 737–738. [PubMed] [Google Scholar]
115.
Стефанетти В., Маренцони М.Л., Лепри Э. и др..
Случай аборта Candida guilliermondii у арабской кобылы. Med Mycol Case Rep. 2014; 4: 19–22. [Бесплатная статья PMC] [PubMed] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [Google Scholar]
116. Сэнфорд С.Э., Джозефсон Г.К. Онтарио. Кандидоз парапсилоза аборт у коровы. Кан Вет Дж. 1988; 29: 458. [Бесплатная статья PMC] [PubMed] [Google Scholar]
117. Фоли Г.Л., Шлафер Д.Х. Candida аборт у крупного рогатого скота. Вет Патол. 1987 год; 24: 532–536. [PubMed] [Google Scholar]
118. Вольгемут К., Кнудсон В. Аборт крупного рогатого скота, связанный с Candida tropicalis . J Am Vet Med Assoc. 1973 год; 162: 460–461. [PubMed] [Google Scholar]
119. де Касиа душ Сантуш Р., Марин Дж.М. Выделение Candida spp. из маститного коровьего молока в Бразилии. Микопатология. 2005 г.; 159: 251–253. [PubMed] [Google Scholar]
120.
Скаккабароцци Л., Локателли С., Пизони Г. и др..
Краткое сообщение: Эпидемиология и генотипирование штаммов Candida rugosa , ответственных за персистирующие интрамаммарные инфекции у молочных коров. Дж. Молочная наука. 2011 г. ; 94: 4574–4577. [PubMed] [Google Scholar]
; 94: 4574–4577. [PubMed] [Google Scholar]
121. Круковски Х., Титце М., Маевски Т. и др.. Обследование дрожжевого мастита в молочных стадах мелких ферм в Люблинском районе, Польша. Микопатология. 2001 г.; 150: 5–7. [PubMed] [Академия Google]
122. Коста Э.О., Гандра Ч.Р., Пирес М.Ф. и др.. Исследование коровьего микотического мастита в молочных стадах в штате Сан-Паулу, Бразилия. Микопатология. 1993 год; 124: 13–17. [PubMed] [Google Scholar]
123. Китамура Х., Анри А., Фьюз К. и др.. Хронический мастит, вызванный Candida maltosa у коровы. Вет Патол. 1990 г.; 27: 465–466. [PubMed] [Google Scholar]
124. Элад Д., Шпигель Н.Ю., Винклер М. и др.. Контаминация корма Candida krusei как вероятный источник микотического мастита у молочных коров. J Am Vet Med Assoc. 1995; 207: 620–622. [PubMed] [Google Scholar]
125.
Спанамберг А., Вундер Э.А. младший, Брайер Перейра Д.И. и др..
Разнообразие дрожжей от мастита крупного рогатого скота в Южной Бразилии. Преподобный Ибер Микол. 2008 г.; 25: 154–156. [PubMed] [Google Scholar]
Преподобный Ибер Микол. 2008 г.; 25: 154–156. [PubMed] [Google Scholar]
126. Альбек Б., Стендеруп Дж., Дженсен Х.Э. и др.. Грибковый и водорослевый мастит крупного рогатого скота в Дании. АПМИС. 1994 год; 102: 451–456. [PubMed] [Google Scholar]
127. Фарнсворт Р.Дж., Соренсен Д.К. Распространенность и видовое распределение дрожжей в молочных железах молочных коров в Миннесоте. Может ли J Comp Med. 1972; 36: 329–332. [Бесплатная статья PMC] [PubMed] [Google Scholar]
128. Кроушоу В.М., Макдональд Н.Р., Дункан Г. Вспышка мастита Candida rugosa в молочном стаде после интрамаммарного лечения антибиотиками. Ветеринар Рек. 2005 г.; 156: 812–813. [PubMed] [Google Scholar]
129. Дворецка-Кашак Б., Круткевич А., Шопа Д. и др.. Высокая распространенность дрожжей Candida в образцах молока от коров, страдающих маститом, в Польше. Мир науки Дж. 2012; 2012: 196347. [Бесплатная статья PMC] [PubMed] [Google Scholar]
130.
Фарнсворт Р.Дж.
Значение грибкового мастита. J Am Vet Med Assoc. 1977 год; 170: 1173–1174. [PubMed] [Google Scholar]
J Am Vet Med Assoc. 1977 год; 170: 1173–1174. [PubMed] [Google Scholar]
131. Годи К.М., Рэгг П.Н., Барбер А.М. Вспышка болезни, вызванной Candida krusei , в небольшом молочном стаде в Великобритании. Ветеринарная рек. 2009 г.; 165: 535–537. [PubMed] [Google Scholar]
132. Хаяши Т., Сугита Т., Хата Э. и др.. Молекулярная идентификация дрожжей, выделенных при клиническом мастите крупного рогатого скота в Японии. J Vet Med Sci. 2013; 75: 387–390. [PubMed] [Google Scholar]
133. Ксури С., Джебир С., Хадеф Ю. и др.. Исследование микотического мастита крупного рогатого скота при различных состояниях молочной железы в двух северо-восточных регионах Алжира. Микопатология. 2015 г.; 179: 327–331. [PubMed] [Google Scholar]
134. Чжоу И, Жэнь И, Фан Си и др.. Исследование микотического мастита у молочных коров из провинции Хэйлунцзян, Китай. Trop Animal Health Pprod. 2013; 45: 1709–1714. [PubMed] [Google Scholar]
135.
Ричард Дж. Л., Макдональд Дж. С., Фихтнер Р. Е. и др..
Идентификация дрожжей из инфицированных молочных желез крупного рогатого скота и их экспериментальная инфекционность у крупного рогатого скота. Am J Vet Res. 1980; 41: 1991–1994. [PubMed] [Google Scholar]
С., Фихтнер Р. Е. и др..
Идентификация дрожжей из инфицированных молочных желез крупного рогатого скота и их экспериментальная инфекционность у крупного рогатого скота. Am J Vet Res. 1980; 41: 1991–1994. [PubMed] [Google Scholar]
136. Kwon-Chung KJ, Bennett JE, Wickes BL и др.. Обоснование принятия номенклатуры «видовой комплекс» для этиологических агентов криптококкоза. мсфера. 2017; 2. [Бесплатная статья PMC] [PubMed] [Google Scholar]
137. Мейер В., Ааненсен Д.М., Бёкхаут Т. и др.. Консенсусная мультилокусная схема типирования последовательностей для Cryptococcus neoformans и Cryptococcus gattii . Мед Микол. 2009 г.; 47: 561–570. [Бесплатная статья PMC] [PubMed] [Google Scholar]
138. Квон-Чунг К.Дж., Варма А. Поддерживают ли концепции основных видов один, два или более видов Cryptococcus neoformans? Женские дрожжи Res. 2006 г.; 6: 574–587. [PubMed] [Google Scholar]
139.
Бекхаут Т., Тилен Б., Диас М. и др..
Гибридные генотипы у патогенных дрожжей Cryptococcus neoformans . Микробиология. 2001 г.; 147: 891–907. [PubMed] [Google Scholar]
Микробиология. 2001 г.; 147: 891–907. [PubMed] [Google Scholar]
140. Харрис Дж., Локхарт С., Чиллер Т. Cryptococcus gattii : куда нам двигаться дальше? Мед Микол. 2012 г.; 50: 113–129. [PubMed] [Google Scholar]
141. Вебер А, Шафер Р. Встречаемость Cryptococcus neoformans в образцах фекалий птиц, содержащихся в местах проживания людей. Берл Мунк Tierarztl Wochenschr. 1991 год; 104: 419–421. [PubMed] [Google Scholar]
142. Лазера М.С., Кавальканти М.А., Триллес Л. и др.. Cryptococcus neoformans var. gattii — свидетельство естественной среды обитания, связанное с гниющей древесиной в дупле глиняного дерева. Мед Микол. 1998 год; 36: 119–122. [PubMed] [Академия Google]
143. Эллис Д.Х., Пфайффер Т.Дж. Естественная среда обитания Cryptococcus neoforman s var. гаттии. Дж. Клин Микробиол. 1990 г.; 28: 1642–1644. [Бесплатная статья PMC] [PubMed] [Google Scholar]
144.
Гилад А., Бакал-Вайс М., Блюм С.Е. и др.. Исследование окружающей среды на Cryptococcus gattii в израильском зоопарке, где обитают животные из Австралии.
Isr J Vet Med. 2015 г.; 70: 47–51. [Google Академия]
Исследование окружающей среды на Cryptococcus gattii в израильском зоопарке, где обитают животные из Австралии.
Isr J Vet Med. 2015 г.; 70: 47–51. [Google Академия]
145. Воелз К., Джонстон С.А., Смит Л.М. и др.. «Разделение труда» в ответ на окислительный взрыв хозяина приводит к фатальным последствиям.0009 Вспышка Cryptococcus gattii . Нац коммун. 2014; 5: 5194. [Бесплатная статья PMC] [PubMed] [Google Scholar]
146. де Абреу DPB, Machado CH, Makita MT и др.. Поражение кишечника у собаки, вызванное Cryptococcus gattii Type VGII, и обзор опубликованных случаев желудочно-кишечного криптококкоза собак. Микопатология. 2017; 182: 597–602. [PubMed] [Google Scholar]
147. Кидд С.Э., Хаген Ф., Чарке Р.Л. и др.. Редкий генотип Cryptococcus gattii вызвал вспышку криптококкоза на острове Ванкувер (Британская Колумбия, Канада). Proc Natl Acad Sci U S A. 2004; 101: 17258–17263. [Бесплатная статья PMC] [PubMed] [Google Scholar]
148. Кастелла Г., Абарка М.Л., Кабанес Ф.Дж.
Криптококкоз и домашние животные. Преподобный Ибер Микол. 2008 г.; 25: С19–24. [PubMed] [Google Scholar]
Кастелла Г., Абарка М.Л., Кабанес Ф.Дж.
Криптококкоз и домашние животные. Преподобный Ибер Микол. 2008 г.; 25: С19–24. [PubMed] [Google Scholar]
149. Пал М., Мехротра Б.С. Криптококковый мастит молочных животных. Микосен. 1983 год; 26: 615–616. [PubMed] [Google Scholar]
150. Secombe CJ, Lester GD, Krockenberger MB. Легочный криптококкоз лошадей: сравнительный обзор литературы и оценка монотерапии флуконазолом. Микопатология. 2017; 182: 413–423. [PubMed] [Академия Google]
151. Стивен С., Лестер С., Блэк В. и др.. Многовидовая вспышка криптококкоза на юге острова Ванкувер, Британская Колумбия. Кан Вет Дж. 2002 г.; 43: 792–794. [Бесплатная статья PMC] [PubMed] [Google Scholar]
152. Дункан С, Стивен С, Кэмпбелл Дж. Клинические характеристики и предикторы смертности от инфекции Cryptococcus gattii у собак и кошек на юго-западе Британской Колумбии. Кан Вет Дж. 2006 г.; 47: 993–998. [Бесплатная статья PMC] [PubMed] [Google Scholar]
153.
Хедли С.А., Мота ФК, Линдси С. и др.. Cryptococcus neoformans вар. grubii -индуцированный артрит с энцефалитной диссеминацией у собаки и обзор опубликованной литературы. Микопатология. 2016; 181: 595–601. [PubMed] [Google Scholar]
и др.. Cryptococcus neoformans вар. grubii -индуцированный артрит с энцефалитной диссеминацией у собаки и обзор опубликованной литературы. Микопатология. 2016; 181: 595–601. [PubMed] [Google Scholar]
154. GarciaHermoso D, MathoulinPelissier S, Couprie B и др.. Типирование ДНК предполагает, что голубиный помет является источником патогенного Cryptococcus neoformans серотипа D. Дж. Клин Микробиол. 1997 год; 35: 2683–2685. [Бесплатная статья PMC] [PubMed] [Google Scholar]
155. Хаджех Р.А., Конн Л.А., Стивенс Д.С. и др.. Криптококкоз: популяционный мультигосударственный активный эпиднадзор и факторы риска у лиц, инфицированных вирусом иммунодефицита человека. Криптококковая группа активного наблюдения. J заразить Dis. 1999 г.; 179: 449–454. [PubMed] [Google Scholar]
156. Элад Д. Пациенты с ослабленным иммунитетом и их домашние животные: все еще лучшие друзья? Вет Дж. 2013; 197: 662–669. [PubMed] [Google Scholar]
157.
Ямамото Ю. , Коно С., Кога Х. и др..
Случайный амплифицированный анализ полиморфной ДНК клинически и экологически изолированных Cryptococcus neoformans в Нагасаки.
Дж. Клин Микробиол. 1995 год; 33: 3328–3332. [Бесплатная статья PMC] [PubMed] [Google Scholar]
, Коно С., Кога Х. и др..
Случайный амплифицированный анализ полиморфной ДНК клинически и экологически изолированных Cryptococcus neoformans в Нагасаки.
Дж. Клин Микробиол. 1995 год; 33: 3328–3332. [Бесплатная статья PMC] [PubMed] [Google Scholar]
158. Санджорджи Г. Бластомикоз спонтанный муриди. Патология. 1922 г.; 14: 493–495. [Google Академия]
159. Эммонс CW, Белл Дж. А., Олсон Б. Дж. Естественный гистоплазмоз у Mus musculus и Rattus norvegicus . Опубликованная Рекомендация о здоровье. 1947 год; 62: 1642–1646. [PubMed] [Google Scholar]
160. Сингх С.М., Найду Дж., Шарма А. и др.. Первый случай криптококкоза у нового вида бандикутов ( Bandicota indica ), вызываемый Cryptococcus neoformans var. грубой. Мед Микол. 2007 г.; 45: 89–93. [PubMed] [Google Scholar]
161.
Сингх К., Рани Дж., Нилабх Рай Г.К., Сингх М.
Домовая мышь из Юго-Восточной Азии ( Mus musculus castaneus Linn.) как новый пассажир-хозяин для Cryptococcus neoformans var. грубой молекулярного типа ВНИ. Мед Микол 2017; doi: 10.1093/mmy/myx001. [PubMed] [Google Scholar]
грубой молекулярного типа ВНИ. Мед Микол 2017; doi: 10.1093/mmy/myx001. [PubMed] [Google Scholar]
162. Аплин К.П., Сузуки Х., Чинен А.А. и др.. Множественное географическое происхождение комменсализма и сложная история расселения черных крыс. ПЛОС Один. 2011 г.; 6: е26357. [Бесплатная статья PMC] [PubMed] [Google Scholar]
163. Морера Н., Хаген Ф., Хуан-Саллес С. и др.. Хорьки как индикаторы присутствия патогенных видов Cryptococcus в среде Средиземноморья. Микопатология. 2014; 178: 145–151. [Бесплатная статья PMC] [PubMed] [Google Scholar]
164. Сейедмусави С., Гийо Дж., де Хоог Г.С. Феогифомикозы, эмерджентные оппортунистические заболевания животных. Clin Microbiol Rev. 2013; 26: 19–35. [Бесплатная статья PMC] [PubMed] [Google Scholar]
165. Реванкар С.Г., Саттон Д.А. Меланизированные грибы в болезнях человека. Clin Microbiol Rev. 2010; 23: 884–8928. [Бесплатная статья PMC] [PubMed] [Google Scholar]
166.
Янонг РП.
Грибковые болезни рыб. Ветклиника Северная Ам. 2003 г.; 6: 377–400. [PubMed] [Google Scholar]
Ветклиника Северная Ам. 2003 г.; 6: 377–400. [PubMed] [Google Scholar]
167. Денсмор CL, Грин DE. Болезни амфибий. Илар Дж. 2007; 48: 235–254. [PubMed] [Google Scholar]
168. Бегер В.А., Пай М.Р., Остренский А. и др.. Летаргическая крабовая болезнь: междисциплинарные данные подтверждают грибковую этиологию. Мем Инст Освальдо Круз. 2005 г.; 100: 161–167. [PubMed] [Академия Google]
169. Бегер В. А., Пай М. Р., Висенте В. и др.. Гистопатология мангровых сухопутных крабов Ucides cordatus (Ocypodidae), пораженных летаргической болезнью крабов. Дис Аква Орг. 2007 г.; 78: 73–81. [PubMed] [Google Scholar]
170. Фрэнк С., Вемулапалли Р., Лин Т. Церебральный феогифомикоз, вызванный Cladophialophora bantiana у Huacaya alpaca ( Vicugna pacos ). J Комп Патол. 2011 г.; 145: 410–413. [PubMed] [Google Scholar]
171.
Халигур М., Озмен О., Доррестейн Г.М.
Смертельный системный кладоспориоз в отаре овец-мериносов. Микопатология. 2010 г.; 170: 411–415. [PubMed] [Академия Google]
2010 г.; 170: 411–415. [PubMed] [Академия Google]
172. Сейедмусави С., Нетеа М.Г., Мутон Дж.В. и др.. Черные дрожжи и их нитчатые родственники: принципы патогенеза и защиты хозяина. Clin Microbiol Rev. 2014; 27: 527–542. [Бесплатная статья PMC] [PubMed] [Google Scholar]
173. де Хоог Г.С., Висенте В.А., Наджафзаде М.Дж. и др.. Передается через воду Exophiala видов, вызывающих заболевания у хладнокровных животных. Персония. 2011 г.; 27: 46–72. [Бесплатная статья PMC] [PubMed] [Google Scholar]
174. Кейрос-Теллес Ф., де Хоог С., Сантос Д.В. и др.. Хромобластомикоз. Clin Microbiol Rev. 2017; 30: 233–276. [Бесплатная статья PMC] [PubMed] [Google Scholar]
175. Веласкес LFV, Рестрепо AM. Хромомикоз жабы ( Bufo marinus ) и сравнение этиологического агента с грибами, вызывающими хромомикоз человека. Сабураудиа. 1975 год; 13: 1–9. [PubMed] [Google Scholar]
176.
Бубе А., Буркхардт Э., Вайс Р.
Спонтанный хромомикоз у морской жабы ( Bufo marinus ). J Комп Патол. 1992 год; 106: 73–77. [PubMed] [Google Scholar]
J Комп Патол. 1992 год; 106: 73–77. [PubMed] [Google Scholar]
177. Лангвад Ф., Педерсен О., Энджом К. Грибковое заболевание, вызываемое Exophiala sp. nov в выращиваемом на ферме атлантическом лососе в Западной Норвегии. В: Патология рыб и моллюсков. Лондон: Академическая, 1985. [Google Scholar]
178. Carvalho TF, Tinoco HP, Malta MCP и др.. Системная инфекция Spencermartinsiella sp. у нильского крокодила ( Crocodylus niloticus ). Braz J Vet Res Anim Sci. 2016; 53: 1–7. [Google Академия]
179. Гаскинс Дж. Э., Чунг П. Дж. Exophiala pisciphila : исследование его развития. Микопатология. 1986 год; 93: 173–184. [PubMed] [Google Scholar]
180.
Ньяоке А., Вебер Э.С., Иннис С. и др..
Диссеминированный феогифомикоз у сорных морских драконов ( Phyllopteryx taeniolatus ) и лиственных морских драконов ( Phycodurus eques ), вызываемых видами Exophiala , включая новый вид. Джей Вет Диагн Инвест. 2009 г.; 21: 69–79. [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
181. Поллаччи Г. Miceti del corpo umano e degli animali. Научная Ботаническая Мед. 1923 г.; 18: 1–9. [Google Академия]
182. Манхарт А., Лембергер К., Мыльниченко Н. и др.. Распространенный феогифомикоз, вызванный видом Exophiala, у галапагосской черепахи, Geochelone nigra . J Herpetol Med Surg. 2005 г.; 15: 20–26. [Google Академия]
183. Висенте В.А., Орелис-Рибейро Р., Наджафзаде М.Дж. и др.. Черные дрожжеподобные грибы, связанные с летаргической болезнью крабов (LCD) у мангровых наземных крабов, Ucides cordatus (Ocypodidae). Вет микробиол. 2012 г.; 158: 109–122. [PubMed] [Google Scholar]
184. Миллер Э.А., Монтали Р.Дж., Рамзи Э.К. и др.. Диссеминированный хромобластомикоз в колонии декоративнорогих лягушек ( Ceratophrys ornata ). J Zoo Wildlife Med. 1992; 23: 433–438. [Google Академия]
185.
Элкан Э, Филпот СМ.
Микотические инфекции у лягушек, вызванные Phialophora -подобным грибком. Сабураудиа. 1973 год; 11: 99–105. [PubMed] [Google Scholar]
Сабураудиа. 1973 год; 11: 99–105. [PubMed] [Google Scholar]
186. Fisher MC, Koenig GL, White TJ и др.. Молекулярное и фенотипическое описание Coccidioides posadasii sp. nov., ранее признанной некалифорнийской популяцией Coccidioides immitis . Микология. 2002 г.; 94: 73–84. [PubMed] [Академия Google]
187. Баркер МБ. Кокцидиоидомикоз у животных. В: Сейедмусави С., Гийо Дж., Де Хоог С. и др., ред. Возникающие и эпидемические грибковые инфекции у животных. Нью-Йорк: Springer, 2017. [Google Scholar]
188. Де Хоог С., Гуарро Дж., Джин Дж. Атлас клинических грибов: лучший настольный инструмент для диагностики. Утрехт, Нидерланды: Centraalbureau voor Schimmelcultures, KNAW Fungal. Центр биоразнообразия/Университет Ровира и Виргили, 2009 г. [Google Scholar]
189.
Гийо Дж., Герен С., Шерметт Р.
Гистоплазмоз у животных. В: Сейедмусави С., Гийо Дж., Де Хоог С. и др., ред. Возникающие и эпидемические грибковые инфекции у животных. Нью-Йорк: Springer, 2017..jpg) [Google Scholar]
[Google Scholar]
190. Браммер Э., Кастанеда Э., Рестрепо А. Паракокцидиоидомикоз: обновление. Clin Microbiol Rev. 1993; 6: 89–117. [Бесплатная статья PMC] [PubMed] [Google Scholar]
191. Бокка А.Л., Амарал А.С., Тейшейра М.М. и др.. Паракокцидиоидомикоз: экоэпидемиология, таксономия и клинико-терапевтические вопросы. Будущая микробиология. 2013; 8: 1177–1191. [PubMed] [Google Scholar]
192. Teixeira MM, Theodoro RC, Nino-Vega G и др.. Комплекс видов Paracoccidioides: экология, филогения, половое размножение и вирулентность. PLoS Патог. 2014; 10: e1004397. [Бесплатная статья PMC] [PubMed] [Google Scholar]
193. Шиканай-Ясуда М.А., Теллес Филью Ф. де К., Мендес Р.П. и др.. Руководство по паракокцидиоидомикозу. Rev Soc Bras Med Trop. 2006 г.; 39: 297–310. [PubMed] [Google Scholar]
194. Coutinho ZF, Wanke B, Travassos C и др.. Госпитальная заболеваемость паракокцидиомикозом в Бразилии (1998–2006 гг.). Троп Мед Int Health. 2015 г.; 20: 673–680. [PubMed] [Google Scholar]
195. Риччи Г., Мота Ф.Т., Вакамацу А., Серафим Р.С., Борра Р.С., Франко М..
Паракокцидиоидомикоз собак. Мед Микол. 2004 г.; 42: 379–383. [PubMed] [Google Scholar]
Риччи Г., Мота Ф.Т., Вакамацу А., Серафим Р.С., Борра Р.С., Франко М..
Паракокцидиоидомикоз собак. Мед Микол. 2004 г.; 42: 379–383. [PubMed] [Google Scholar]
196. Фариас М.Р., Кондас ЛАЗ, Рибейро М.Г. и др.. Паракокцидиоидомикоз у собаки: клинический случай генерализованной лимфаденомегалии. Микопатология. 2011 г.; 172: 147–152. [PubMed] [Google Scholar]
197. Багальи Э., Франко М., Боско Сде М. и др.. Высокая частота инфекции Paracoccidioides brasiliensis у броненосцев ( Dasypus novemcinctus ): экологическое исследование. Мед Микол. 2003 г.; 41: 217–223. [PubMed] [Академия Google]
198. Брэдшер Р.В., младший Эндемический мимикрирующий: бластомикоз болезнь, которую часто неправильно диагностируют. Ассоциация климатических исследований Trans Am Clin. 2014; 125: 188–202; обсуждение -3. [Бесплатная статья PMC] [PubMed] [Google Scholar]
199.
Гилкрист Т.К., Стоукс В.Р.
Случай псевдо- Lupus vulgaris , вызванный бластомикозом. J Эксперт Мед. 1898 г.; 3: 53–78. [Бесплатная статья PMC] [PubMed] [Google Scholar]
1898 г.; 3: 53–78. [Бесплатная статья PMC] [PubMed] [Google Scholar]
200. Баумгарднер Д.Дж., Парецкий Д.П., Йопп А.С. Эпидемиология бластомикоза у собак: северо-центральный Висконсин, США. J Med Vet Mycol. 1995; 33: 171–176. [PubMed] [Google Scholar]
201. Херрманн Дж.А., Костюк С.Л., Дворкин М.С. и др.. Временное и пространственное распределение случаев бластомикоза среди людей и собак в Иллинойсе (2001–2007 гг.). J Am Vet Med A. 2011; 239: 335–343. [PubMed] [Google Scholar]
202. Сайкс Дж. Э., Меркель Л. К. Бластомикоз. В: Сайкс Дж. Э., изд. Инфекционные болезни собак и кошек. Сент-Луис, Миссури: Elsevier, 2014, 574–586. [Google Академия]
203. Van Rooij P, Martel A, Haesebrouck F и др.. Амфибийный хитридиомикоз: обзор, посвященный взаимодействию грибок-хозяин. Вет рез. 2015 г.; 46: 137. [Бесплатная статья PMC] [PubMed] [Google Scholar]
204.
Бергер Л., Спиэр Р., Дашак П. и др..
Хитридиомикоз вызывает смертность амфибий, связанную с сокращением популяции в тропических лесах Австралии и Центральной Америки. Proc Natl Acad Sci U S A. 1998; 95: 9031–9036. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Proc Natl Acad Sci U S A. 1998; 95: 9031–9036. [Бесплатная статья PMC] [PubMed] [Google Scholar]
205. Липс К., Диффендорфер Дж., Мендельсон И.Дж. и др.. На волне: примирение ролей болезней и изменения климата в сокращении численности амфибий. Биология PLoS. 2008 г.; 6: 441–454. [Бесплатная статья PMC] [PubMed] [Google Scholar]
206. Скеррат Л.Ф., Бергер Л., Спиэр Р. и др.. Распространение хитридиомикоза вызвало быстрое глобальное сокращение и вымирание лягушек. Экоздоровье. 2007 г.; 4: 125–134. [Google Академия]
207. Ровито С.М., Парра-Олеа Г., Васкес-Алмазан Ч.Р. и др.. Резкое сокращение популяций неотропических саламандр является важной частью глобального кризиса амфибий. Proc Natl Acad Sci U S A. 2009; 106: 3231–3236. [Бесплатная статья PMC] [PubMed] [Google Scholar]
208.
Фаррер Р.А., Вейнерт Л.А., Билби Дж. и др..
Множественные появления генетически разнообразных хитридов, заражающих амфибий, включают глобальную гипервирулентную рекомбинантную линию. P Natl Acad Sci U S A. 2011; 108: 18732–18736. [Бесплатная статья PMC] [PubMed] [Google Scholar]
P Natl Acad Sci U S A. 2011; 108: 18732–18736. [Бесплатная статья PMC] [PubMed] [Google Scholar]
209. Шмеллер Д.С., Блуи М., Мартель А. и др.. Микроскопические водные хищники сильно влияют на динамику заражения глобально появившимся патогеном. Карр Биол. 2014; 24: 176–180. [PubMed] [Google Scholar]
210. Роза Г.М., Сабино-Пинто Дж., Лаурентино Т.Г. и др.. Влияние асинхронного появления двух летальных патогенов на сообщества амфибий. Научный представитель 2017; 7: 43260. [Бесплатная статья PMC] [PubMed] [Google Scholar]
211. Пасманс Ф., Ван Рой П. Блуи М. и др.. Устойчивость к хитридиомикозу европейских плетодонтидных саламандр рода Спелеомант . PloS Один. 2013; 8: e63639. [Бесплатная статья PMC] [PubMed] [Google Scholar]
212. Мартель А., Блуи М., Адриансен С. и др.. Недавняя интродукция хитридиевого грибка представляет опасность для западнопалеарктических саламандр. Наука. 2014; 346: 630–631. [Бесплатная статья PMC] [PubMed] [Google Scholar]
213. Шпитцен-ван дер Слуйс А., Мартель А., Ассельбергс Дж. и др..
Расширение распространения летального амфибийного грибка Batrachochytrium salamandrivorans в Европе.
Эмердж Инфекция Дис. 2016; 22: 1286–1288. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Шпитцен-ван дер Слуйс А., Мартель А., Ассельбергс Дж. и др..
Расширение распространения летального амфибийного грибка Batrachochytrium salamandrivorans в Европе.
Эмердж Инфекция Дис. 2016; 22: 1286–1288. [Бесплатная статья PMC] [PubMed] [Google Scholar]
214. Стеген Г., Пасманс Ф., Шмидт Б.Р. и др.. Факторы истребления саламандры, опосредованные Batrachochytrium salamandrivorans . Природа. 2017; 544: 353–356. [PubMed] [Google Scholar]
215. Лейкинг А.Э., Нго Х.Н., Пасманс Ф. и др.. Batrachochytrium salamandrivorans является преобладающим хитридиевым грибом у вьетнамских саламандр. Научный представитель 2017; 7: 44443. [Бесплатная статья PMC] [PubMed] [Google Scholar]
216. Колби Дж. Э., Смит К. М., Бергер Л. и др.. Первые признаки амфибийного хитридиевого гриба ( Batrachochytrium dendrobatidis ) и ранавирус в торговле амфибиями в Гонконге. ПЛОС Один. 2014; 9: е
. [Бесплатная статья PMC] [PubMed] [Google Scholar]
217. Гроган Л.Ф., Бергер Л., Роуз К. и др..
Надзор за возникающими болезнями биоразнообразия диких животных. PLoS Патог. 2014; 10: e1004015. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Гроган Л.Ф., Бергер Л., Роуз К. и др..
Надзор за возникающими болезнями биоразнообразия диких животных. PLoS Патог. 2014; 10: e1004015. [Бесплатная статья PMC] [PubMed] [Google Scholar]
218. Гарнер Т.В., Шмидт Б.Р., Мартель А. и др.. Смягчение хитридиомикозов амфибий в природе. Philos Trans R Soc Lond B Biol Sci. 2016; 371; дои: 10.1098/рстб.2016.0207. [Бесплатная статья PMC] [PubMed] [Google Scholar]
219. МакМахон Т.А., Сирс Б.Ф., Венески М.Д. и др.. Земноводные приобретают устойчивость к живым и мертвым грибам, преодолевая грибковую иммуносупрессию. Природа. 2014; 511: 224–227. [Бесплатная статья PMC] [PubMed] [Google Scholar]
220. Бош Дж., Санчес-Томе Э., Фернандес-Лорас А. и др.. Успешная ликвидация смертельной инфекционной болезни диких животных в природе. Биол Летт. 2015 г.; 11: 20150874. [Бесплатная статья PMC] [PubMed] [Google Scholar]
221.
Блетц М.С., Лаудон А.Х., Беккер М.Х. и др..
Смягчение хитридиомикоза амфибий с помощью биоаугментации: характеристики эффективных пробиотиков и стратегии их выбора и использования. Эколь Летт. 2013; 16: 807–820. [PubMed] [Google Scholar]
Эколь Летт. 2013; 16: 807–820. [PubMed] [Google Scholar]
222. Шмеллер Д.С., Блуи М., Мартель А. и др.. Микроскопические водные хищники сильно влияют на динамику заражения глобально появившимся патогеном. Карр Биол. 2014; 24: 176–180. [PubMed] [Google Scholar]
223. Блехерт Д.С., Хикс А.С., Бер М. и др.. Синдром белого носа летучей мыши: новый грибковый патоген? Наука. 2009 г.; 323: 227. [PubMed] [Google Scholar]
224. Гаргас А., Трест М.Т., Кристенсен М. и др.. Geomyces destructans sp nov связаны с синдромом белого носа летучих мышей. Микотаксон. 2009 г.; 108: 147–154. [Google Академия]
225. Лорх Дж.М., Метейер К.У., Бер М.Дж. и др.. Экспериментальное заражение летучих мышей Geomyces destructans вызывает синдром белого носа. Природа. 2011 г.; 480: 376–378. [PubMed] [Google Scholar]
226.
Миннис А.М., Линднер Д.Л.
Филогенетическая оценка Geomyces и его союзники не выявили близких родственников Pseudogymnoascus destructans , гребенка. nov., у летучих мышей hibernacula на востоке Северной Америки. Грибковая биол. 2013; 117: 638–649. [PubMed] [Google Scholar]
nov., у летучих мышей hibernacula на востоке Северной Америки. Грибковая биол. 2013; 117: 638–649. [PubMed] [Google Scholar]
227. Frick WF, Puechmaille SJ, Hoyt JR и др.. Болезнь изменяет макроэкологические модели летучих мышей Северной Америки. Глобал Экол Биогеогр. 2015 г.; 24: 741–749. [Google Академия]
228. Meteyer CU, Buckles EL, Blehert DS и др.. Гистопатологические критерии для подтверждения синдрома белого носа у летучих мышей. Джей Вет Диагн Инвест. 2009 г.; 21: 411–414. [PubMed] [Google Scholar]
229. Cryan PM, Meteyer CU, Boyles JG и др.. Патология крыльев синдрома белого носа у летучих мышей предполагает опасные для жизни нарушения физиологии. БМС Биол. 2010 г.; 8: 135. [Бесплатная статья PMC] [PubMed] [Google Scholar]
230. Варнеке Л., Тернер Дж. М., Боллинджер Т. К. и др.. Патофизиология синдрома белого носа у летучих мышей: механистическая модель, связывающая повреждение крыльев со смертностью. Биол Летт. 2013; 9: 20130177. [Бесплатная статья PMC] [PubMed] [Google Scholar]
231. Лорх Дж.М., Палмер Дж.М., Линднер Д.Л. и др..
Первое обнаружение синдрома белого носа летучих мышей в западной части Северной Америки.
мсфера. 2016; 1; doi: 10.1128/mSphere.00148-16. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Лорх Дж.М., Палмер Дж.М., Линднер Д.Л. и др..
Первое обнаружение синдрома белого носа летучих мышей в западной части Северной Америки.
мсфера. 2016; 1; doi: 10.1128/mSphere.00148-16. [Бесплатная статья PMC] [PubMed] [Google Scholar]
232. Раджкумар С.С., Ли С.Дж., Радд Р.Дж. и др.. Клональный генотип geomyces destructans у летучих мышей с синдромом белого носа, Нью-Йорк, США. Эмердж Инфекция Дис. 2011 г.; 17: 1273–1276. [Бесплатная статья PMC] [PubMed] [Google Scholar]
233. Puechmaille SJ, Wibbelt G, Korn V и др.. Общеевропейское распространение грибка синдрома белого носа ( Geomyces destructans ), не связанный с массовой гибелью. PloS Один. 2011 г.; 6: e19167. [Бесплатная статья PMC] [PubMed] [Google Scholar]
234. Леопарди С., Блейк Д., Пюшмейл С.Дж. Гриб синдрома белого носа завезен из Европы в Северную Америку. Карр Биол. 2015 г.; 25: Р217–219. [PubMed] [Google Scholar]
235.
Мэн Дж.Дж., Бойлз Дж.Г.
Летучие мыши инициируют жизненно важные агроэкологические взаимодействия в кукурузе. Proc Natl Acad Sci U S A. 2015; 112: 12438–12443. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Proc Natl Acad Sci U S A. 2015; 112: 12438–12443. [Бесплатная статья PMC] [PubMed] [Google Scholar]
236. Черметт Р., Феррейро Л., Гийо Дж. Дерматофитии у животных. Микопатология. 2008 г.; 166: 385–405. [PubMed] [Google Scholar]
237. Миньон Б.Р., Лоссон Б.Дж. Распространенность и характеристика носительства Microsporum canis у кошек. J Med Vet Mycol. 1997 год; 35: 249–256. [PubMed] [Google Scholar]
238. Мориелло К.А., Койнер К., Патерсон С., Миньон Б. Диагностика и лечение дерматофитии у собак и кошек.: Клинические согласованные рекомендации Всемирной ассоциации ветеринарной дерматологии. Вет Дерматол. 2017; 28: 266–e68. [PubMed] [Академия Google]
239. Вермут С., Табарт Дж., Бальдо А. и др.. Патогенез дерматофитии. Микопатология. 2008 г.; 166: 267–275. [PubMed] [Google Scholar]
240.
Броута Ф., Декамп Ф., Моно М. и др..
Секретируемый ген металлопротеазы семейства Microsporum canis . Заразить иммун. 2002 г.; 70: 5676–5683. [Бесплатная статья PMC] [PubMed] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [Google Scholar]
241. Миньон Б., Суиннен М., Бушара Дж. П. и др.. Очистка и характеристика кератинолитической субтилизиноподобной сериновой протеазы 315 кДа из Microsporum canis и доказательства ее секреции у кошек, инфицированных естественным путем. Мед Микол. 1998; 36: 395–404. [PubMed] [Google Scholar]
242. Миньон Б.Р., Леклипте Т., Фокант С. и др.. Гуморальный и клеточный иммунный ответ на сырой экзо-антиген и очищенную кератиназу Microsporum canis у экспериментально инфицированных морских свинок. Мед Микол. 1999 г.; 37: 123–129. [PubMed] [Google Scholar]
243. Вермут С., Табарт Дж., Бальдо А. и др.. Сайленсинг РНК у дерматофитов Microsporum canis. FEMS Microbiol Lett. 2007 г.; 275: 38–45. [PubMed] [Академия Google]
244. Табарт Дж., Бальдо А., Вермут С. и др.. Реконструированный межфолликулярный эпидермис кошек как модель дерматофитии Microsporum canis . J Med Microbiol. 2007 г.; 56: 971–975. [PubMed] [Google Scholar]
245. Бальдо А., Мати А., Табарт Дж. и др..
Секретируемый субтилизин Sub3 из Microsporum canis необходим для прикрепления к эпидермису, но не для инвазии в него. Брит Джей Дерматол. 2010 г.; 162: 990–997. [PubMed] [Google Scholar]
Бальдо А., Мати А., Табарт Дж. и др..
Секретируемый субтилизин Sub3 из Microsporum canis необходим для прикрепления к эпидермису, но не для инвазии в него. Брит Джей Дерматол. 2010 г.; 162: 990–997. [PubMed] [Google Scholar]
246. Мехул Б., Гу З., Джомард А. и др.. Sub6 (Tri r 2), маркер онихомикоза, выявленный протеомным анализом Trichophyton rubrum секретировал белки в образцах ногтей пациентов. Джей Инвест Дерматол. 2016; 136: 331–333. [PubMed] [Google Scholar]
247. Тран В.Д., Де Кой Н., Фейерманн М. и др.. Реаннотация генома дерматофита Arthroderma benhamiae на основе секвенирования РНК и характеристика его секретома и профиля экспрессии всего гена во время инфекции. mSystems. 2016; 1: e00036–16. [Бесплатная статья PMC] [PubMed] [Google Scholar]
248. Альшахни М.М., Ямада Т. Генетические манипуляции у дерматофитов. Микопатология. 2017; 182: 33–43. [PubMed] [Академия Google]
249.
Камбье Л., Хайнен М.П., Миньон Б.
Соответствующие животные модели в исследованиях дерматофитов. Микопатология. 2017; 182: 229–240. [PubMed] [Google Scholar]
Микопатология. 2017; 182: 229–240. [PubMed] [Google Scholar]
250. Маримон Р., Кано Дж., Жене Дж. и др.. Sporothrix brasiliensis, S. globosa и S. mexicana , три новых вида Sporothrix , представляющих клинический интерес. Дж. Клин Микробиол. 2007 г.; 45: 3198–3206. [Бесплатная статья PMC] [PubMed] [Google Scholar]
251. Родригес А.М., Круз Чоаппа Р., Фернандес Г.Ф. и др.. Sporothrix chilensis sp. ноябрь ( Ascomycota : Ophiostomatales ), передающийся через почву возбудитель споротрихоза человека со слабопатогенным потенциалом для млекопитающих. Грибковая биол. 2016; 120: 246–264. [PubMed] [Google Scholar]
252. Чжан Ю., Хаген Ф., Стилов Б. и др.. Филогеография и закономерности эволюции Sporothrix , охватывающие более 14 000 отчетов о случаях заболевания людей и животных. Персония. 2015 г.; 35: 1–20. [Бесплатная статья PMC] [PubMed] [Google Scholar]
253.
Родригес А.М., де Хоог Г.С., Камарго З. П. Sporothrix видов, вызывающих вспышки среди животных и людей, вызванные передачей инфекции от животного к животному. PLoS Патог. 2016: doi: 10.1371/journal.ppat.1005638. [Бесплатная статья PMC] [PubMed] [Google Scholar]
П. Sporothrix видов, вызывающих вспышки среди животных и людей, вызванные передачей инфекции от животного к животному. PLoS Патог. 2016: doi: 10.1371/journal.ppat.1005638. [Бесплатная статья PMC] [PubMed] [Google Scholar]
254. Гремиао ИДФ, Миранда ЛХМ, Рейс Э.Г. и др.. Зоонозная эпидемия споротрихоза: передача от кошки к человеку. Плос-патогены. 2017; doi: 10.1371.jounal.ppat.1006677. [Бесплатная статья PMC] [PubMed] [Google Scholar]
255. Шубах А., Шубах Т. М., Баррос М. Б. и др.. Споротрихоз, передающийся кошками, Рио-де-Жанейро, Бразилия. Эмердж Инфекция Дис. 2005 г.; 11: 1952–1954. [Бесплатная статья PMC] [PubMed] [Google Scholar]
256. Перейра С.А., Гремиао IDF, Китада А.А.Б. и др.. Эпидемиологический сценарий кошачьего споротрихоза в Рио-де-Жанейро, штат Рио-де-Жанейро, Бразилия. Rev Soc Bras Med Tro. 2014; 47: 392–393. [PubMed] [Google Scholar]
257.
Черногория Х., Родригес А.М., Гальвао Диас М.А. и др..
Споротрихоз кошек, вызванный Sporothrix brasiliensis : новая инфекция животных в Сан-Паулу, Бразилия. BMC Vet Res. 2014; 10: 269. [Бесплатная статья PMC] [PubMed] [Google Scholar]
BMC Vet Res. 2014; 10: 269. [Бесплатная статья PMC] [PubMed] [Google Scholar]
258. Санхотене К.О., Мадрид И.М., Клафке Г.Б. и др.. Sporothrix brasiliensis Вспышки и быстрое возникновение кошачьего споротрихоза. Микозы. 2015 г.; 58: 652–658. [PubMed] [Google Scholar]
259. Альба-Фьерро К.А., Перес-Торрес А., Ториелло К. и др.. Иммунный ответ, индуцированный иммунодоминантным 60 кДа гликопротеином клеточной стенки Sporothrix schenckii у двух линий мышей с экспериментальным споротрихозом. Дж. Иммунол Рез. 2016; 2016: 6525831. [Бесплатная статья PMC] [PubMed] [Google Scholar]
260. Nascimento RC, Алмейда SR. Гуморальный иммунный ответ против растворимых и фракционированных антигенов при экспериментальном споротрихозе. FEMS Immunol Med Microbiol. 2005 г.; 43: 241–247. [PubMed] [Google Scholar]
261.
Ниё К.А., Ричард Дж.Л., Ниё Ю. и др..
Влияние приема внутрь микотоксина Т-2 на фагоцитоз Конидии Aspergillus fumigatus альвеолярными макрофагами кролика и гематологические, биохимические и патологические изменения в сыворотке крови кроликов. Am J Vet Res. 1988 год; 49: 1766–1773. [PubMed] [Google Scholar]
Am J Vet Res. 1988 год; 49: 1766–1773. [PubMed] [Google Scholar]
262. Ниё К.А., Ричард Дж.Л., Ниё Ю. и др.. Патологические, гематологические и серологические изменения у кроликов, получавших микотоксин Т-2 перорально и подвергшихся воздействию аэрозолей конидий Aspergillus fumigatus . Am J Vet Res. 1988 год; 49: 2151–2160. [PubMed] [Google Scholar]
263. Аупанун С., Поаполатеп С., Джорджи М. и др.. Обзор токсикологии и токсикокинетики фузаренона-X, трихотеценового микотоксина типа B. J Vet Med Sci. 2017; 79: 6–13. [Бесплатная статья PMC] [PubMed] [Google Scholar]
264. Кабак Б., Добсон А.Д., Вар И. Стратегии предотвращения заражения микотоксинами продуктов питания и кормов для животных: обзор. Crit Rev Food Sci Nutr. 2006 г.; 46: 593–619. [PubMed] [Google Scholar]
265. Кенслер Т.В., Робак Б.Д., Воган Г.Н. и др.. Афлатоксин: 50-летняя одиссея механистической и трансляционной токсикологии. Токсикол науч. 2011 г.; 120: С28–48. [Бесплатная статья PMC] [PubMed] [Google Scholar]
266. Хусейн Х.С., Бразель Дж.М.
Токсичность, метаболизм и влияние микотоксинов на человека и животных. Токсикология. 2001 г.; 167: 101–134. [PubMed] [Академия Google]
Хусейн Х.С., Бразель Дж.М.
Токсичность, метаболизм и влияние микотоксинов на человека и животных. Токсикология. 2001 г.; 167: 101–134. [PubMed] [Академия Google]
267. Беннет Дж. В., Клих М. Микотоксины. Clin Microbiol Rev. 2003; 16: 497–516. [Бесплатная статья PMC] [PubMed] [Google Scholar]
268. Ривз Э.П., Мессина К.Г., Дойл С. и др.. Корреляция между продукцией глиотоксина и вирулентностью Aspergillus fumigatus в Galleria mellonella . Микопатология. 2004 г.; 158: 73–79. [PubMed] [Google Scholar]
269. Строснидер Х., Аззиз-Баумгартнер Э., Банзигер М. и др.. Отчет рабочей группы: стратегии общественного здравоохранения по снижению воздействия афлатоксинов в развивающихся странах. Перспектива охраны окружающей среды. 2006 г.; 114: 1898–1903. [Бесплатная статья PMC] [PubMed] [Google Scholar]
270.
Smith EE, Kubena LF, Braithwaite CE и др..
Токсикологическая оценка афлатоксина и циклопиазоновой кислоты у цыплят-бройлеров. Poult Sci. 1992 год; 71: 1136–1144. [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
271. Баркер А.К., Шталь С., Энсли С.М. и др.. Треморгенный микотоксикоз у собак. Compend Contin Educ Vet. 2013; 35: Е2. [PubMed] [Google Scholar]
272. Дикман М.А., Грин М.Л. Микотоксины и репродукция в домашнем скоте. J Anim Sci. 1992; 70: 1615–1627. [PubMed] [Google Scholar]
273. Дикман М.А., Грин М.Л. Микотоксины и репродукция в домашнем скоте. J Anim Sci. 1992 год; 70: 1615–1627. [PubMed] [Google Scholar]
274. Рит-Корреа Ф., Риверо Р., Одриосола Э. и др.. Микотоксикозы жвачных животных и лошадей. Джей Вет Диагн Инвест. 2013; 25: 692–708. [PubMed] [Google Scholar]
275. Дуарте СК, Пенья А, Лино СМ. Биомаркеры человеческого охратоксина а — от воздействия до эффекта. Критический преподобный Toxicol. 2011 г.; 41: 187–212. [PubMed] [Академия Google]
276. Скотт ПМ. Биомаркеры воздействия на человека охратоксина А. Контаминация пищевых добавок. 2005 г.; 22: 99–107. [PubMed] [Google Scholar]
277.
Лэмб Д. К., Келли Д.Э., Шунк В.Х. и др..
Мутация T315A в стерол-14-альфа-деметилазе Candida albicans вызывает снижение активности фермента и резистентность к флуконазолу за счет снижения аффинности. Дж. Биол. Хим. 1997 год; 272: 5682–5688. [PubMed] [Google Scholar]
К., Келли Д.Э., Шунк В.Х. и др..
Мутация T315A в стерол-14-альфа-деметилазе Candida albicans вызывает снижение активности фермента и резистентность к флуконазолу за счет снижения аффинности. Дж. Биол. Хим. 1997 год; 272: 5682–5688. [PubMed] [Google Scholar]
278. Лэмб Д.С., Келли Д.Э., Уайт Т.С. и др.. Аминокислотная замена R467K в Candida albicans стерол 14 альфа-деметилаза вызывает лекарственную устойчивость за счет снижения сродства. Противомикробные агенты Chemother. 2000 г.; 44: 63–67. [Бесплатная статья PMC] [PubMed] [Google Scholar]
279. Лоффлер Дж., Келли С.Л., Хебарт Х. и др.. Молекулярный анализ cyp51 из устойчивых к флуконазолу штаммов Candida albicans . FEMS Microbiol Lett. 1997 год; 151: 263–268. [PubMed] [Google Scholar]
280.
Ванден Босше Х., Маричал П., Горренс Дж. и др..
Мутация в цитохроме P -450-зависимая 14а-деметилаза приводит к снижению сродства к азольным противогрибковым средствам. Биохим Сок Транс. 1990 г.; 18: 56–9. [PubMed] [Google Scholar]
1990 г.; 18: 56–9. [PubMed] [Google Scholar]
281. Белый ТС. Наличие аминокислотной замены R467K и потеря аллельной вариации коррелируют с азол-резистентной ланостерол-14-альфа-деметилазой в Candida albicans . Противомикробные агенты Chemother. 1997 год; 41: 1488–1494. [Бесплатная статья PMC] [PubMed] [Google Scholar]
282. Франц Р., Келли С.Л., Лэмб Д.С. и др.. Множественные молекулярные механизмы способствуют ступенчатому развитию резистентности к флуконазолу в клинических условиях.0009 Candida albicans штаммов. Противомикробные агенты Chemother. 1998 год; 42: 3065–3072. [Бесплатная статья PMC] [PubMed] [Google Scholar]
283. Лопес-Рибо Дж.Л., МакЭти Р.К., Переа С. и др.. Множественные резистентные фенотипы Candida albicans сосуществуют во время эпизодов ротоглоточного кандидоза у пациентов, инфицированных вирусом иммунодефицита человека. Противомикробные агенты Chemother. 1999 г.; 43: 1621–1630. [Бесплатная статья PMC] [PubMed] [Google Scholar]
284. Паркинсон Т., Фалконер Д.Дж., Хичкок, Калифорния.
Резистентность к флуконазолу из-за энергозависимого оттока препарата в Candida glabrata . Противомикробные агенты Chemother. 1995 год; 39: 1696–1699. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Паркинсон Т., Фалконер Д.Дж., Хичкок, Калифорния.
Резистентность к флуконазолу из-за энергозависимого оттока препарата в Candida glabrata . Противомикробные агенты Chemother. 1995 год; 39: 1696–1699. [Бесплатная статья PMC] [PubMed] [Google Scholar]
285. Миядзаки Х., Миядзаки Ю., Гебер А. и др.. Резистентность к флуконазолу связана с оттоком лекарства и повышенной транскрипцией гена переносчика лекарства, PDh2, у Candida glabrata . Противомикробные агенты Chemother. 1998 год; 42: 1695–1701. [Бесплатная статья PMC] [PubMed] [Google Scholar]
286. Санглард Д., Ишер Ф., Калабрезе Д. и др.. Ген переносчика АТФ-связывающей кассеты CgCDR1 из Candida glabrata участвует в формировании устойчивости клинических изолятов к азольным противогрибковым средствам. Противомикробные агенты Chemother. 1999 г.; 43: 2753–2765. [Бесплатная статья PMC] [PubMed] [Google Scholar]
287.
Катияр СК, Эдлинд ТД.
Идентификация и экспрессия генов транспортеров ABC, связанных с множественной лекарственной устойчивостью, у Candida krusei. Мед Микол. 2001 г.; 39: 109–116. [PubMed] [Google Scholar]
Мед Микол. 2001 г.; 39: 109–116. [PubMed] [Google Scholar]
288. Сангинетти М., Постераро Б., Фиори Б. и др.. Механизмы устойчивости к азолам у клинических изолятов Candida glabrata, собранных во время больничного исследования устойчивости к противогрибковым препаратам. Противомикробные агенты Chemother. 2005 г.; 49: 668–679. [Бесплатная статья PMC] [PubMed] [Google Scholar]
289. Брун С., Бержес Т., Пупард П. и др.. Механизмы устойчивости к азолу у petite мутантов Candida glabrata . Противомикробные агенты Chemother. 2004 г.; 48: 1788–1796. [Бесплатная статья PMC] [PubMed] [Google Scholar]
290. Марр К.А., Лайонс К.Н., Рустад Т.Р. и др.. Быстрая временная резистентность к флуконазолу у Candida albicans связана с повышенным уровнем мРНК CDR. Противомикробные агенты Chemother. 1998; 42: 2584–2589. [Бесплатная статья PMC] [PubMed] [Google Scholar]
291.
Флинг М.Е., Копф Дж., Тамаркин А. и др..
Анализ гена Candida albicans , который кодирует новый механизм устойчивости к беномилу и метотрексату. Мол Ген Жене. 1991 год; 227: 318–329. [PubMed] [Google Scholar]
Мол Ген Жене. 1991 год; 227: 318–329. [PubMed] [Google Scholar]
292. Vermeulen E, Lagrou K, Verweij PE. Устойчивость к азолу у Aspergillus fumigatus : растущая проблема общественного здравоохранения. Curr Opin Infect Dis. 2013; 26: 493–500. [PubMed] [Академия Google]
293. Сейедмусави С., Мутон Дж.В., Мелчерс В.Дж. и др.. Роль азолов в лечении азолрезистентного аспергиллеза: от скамейки к постели. Обновление устойчивости к наркотикам. 2014; 17: 37–50. [PubMed] [Google Scholar]
294. Ховард С.Дж., Серар Д., Андерсон М.Дж. и др.. Частота и эволюция резистентности к азолам у Aspergillus fumigatus , связанные с неэффективностью лечения. Эмердж Инфекция Дис. 2009 г.; 15: 1068–1076. [Бесплатная статья PMC] [PubMed] [Google Scholar]
295.
Мелладо Э., Гарсия-Эффрон Г., Алькасар-Фуоли Л. и др..
Новый механизм устойчивости Aspergillus fumigatus , обеспечивающий перекрестную устойчивость in vitro к азольным противогрибковым препаратам, включает комбинацию изменений cyp51A. Противомикробные агенты Chemother. 2007 г.; 51: 1897–1904. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Противомикробные агенты Chemother. 2007 г.; 51: 1897–1904. [Бесплатная статья PMC] [PubMed] [Google Scholar]
296. Бельтер К.А., Чеонг С.Х., Коутиньо да Силва М.А. Ретроспективное исследование грибковых изолятов матки лошадей и моделей чувствительности к противогрибковым препаратам (1999–2011 гг.). Ветеринар по лошадям J Suppl. 2012 г.; 43: 84–87. [PubMed] [Академия Google]
297. Cordeiro Rde A, de Oliveira JS, Castelo-Branco Dde S и др.. Изоляты Candida tropicalis , полученные из ветеринарных источников, проявляют устойчивость к азолам и продуцируют факторы вирулентности. Мед Микол. 2015 г.; 53: 145–152. [PubMed] [Google Scholar]
298. Brilhante RS, Bittencourt PV, Castelo-Branco Dde S и др.. Тенденции в противогрибковой чувствительности и вирулентности Candida spp. из носослезного канала лошадей. Мед Микол. 2016; 54: 147–154. [PubMed] [Академия Google]
299.
Brilhante RS, de Alencar LP, Cordeiro Rde A и др..
Обнаружение видов Candida , устойчивых к азолам, в микробиоте нанду ( Rhea americana ): возможные последствия для здоровья человека и животных. J Med Microbiol. 2013; 62: 889–895. [PubMed] [Google Scholar]
J Med Microbiol. 2013; 62: 889–895. [PubMed] [Google Scholar]
300. Сидрим Дж.Дж., Майя Д.К., Брилханте Р.С. и др.. видов Candida , выделенных из желудочно-кишечного тракта корелл ( Nymphicus hollandicus ): профиль противогрибковой чувствительности in vitro и активность фосфолипазы. Вет микробиол. 2010 г.; 145: 324–328. [PubMed] [Академия Google]
301. Роча М.Ф., Бандейра С.П., де Аленкар Л.П. и др.. Устойчивость к азолу у Candida albicans животных: основные моменты активности откачивающей помпы и сверхэкспрессии генов. Микозы. 2017; 60: 462–468. [PubMed] [Google Scholar]
302. Лорд А.Т., Мохандас К., Соманатх С. и др.. Дрожжи с множественной лекарственной устойчивостью у синантропных диких птиц. Энн Клин Микробиол Антимикроб. 2010 г.; 9: 11. [Бесплатная статья PMC] [PubMed] [Google Scholar]
303.
Аль-Ясири М.Х., Норманд А.С., Л’Оливье С. и др..
Условно-патогенный грибковый возбудитель Candida glabrata циркулирует между людьми и желтоногими чайками. Научный представитель 2016 г.; 6: 36157. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Научный представитель 2016 г.; 6: 36157. [Бесплатная статья PMC] [PubMed] [Google Scholar]
304. Brilhante RS, Castelo Branco DS, Duarte GP и др.. Дрожжевая микробиота хищных птиц: возможный инструмент экологического мониторинга. Представитель Environ Microbiol, 2012 г.; 4: 189–193. [PubMed] [Google Scholar]
305. Гонсалвес С.С., Соуза А.С., Чоудхари А. и др.. Эпидемиология и молекулярные механизмы устойчивости к противогрибковым препаратам Candida и Aspergillus . Микозы. 2016; 59: 198–219. [PubMed] [Google Scholar]
306.
Пфаллер М.А., Мессер С.А., Вусли Л.Н. и др..
Профили противогрибковой чувствительности к эхинокандину и триазолу для клинических изолятов условно-патогенных дрожжей и плесени, собранных с 2010 по 2011 год: применение новых клинических пограничных значений CLSI и эпидемиологических пороговых значений для характеристики географических и временных тенденций устойчивости к противогрибковым препаратам. Дж. Клин Микробиол. 2013; 51: 2571–2581. [Бесплатная статья PMC] [PubMed] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [Google Scholar]
307. Verweij PE, Ananda-Rajah M, Andes D и др.. Мнение международного эксперта о ведении инфекций, вызванных устойчивым к азолам Aspergillus fumigatus . Препарат RResist Uupdat. 2015 г.; 21: 30–40. [PubMed] [Google Scholar]
308. Бунскоек П.Е., Сейедмусави С., Ганс С.Дж. и др.. Успешное лечение резистентного к азолам инвазивного аспергиллеза у афалин высокими дозами позаконазола. Med Mycol Case Rep. 2017; 16: 16–19. [Бесплатная статья PMC] [PubMed] [Google Scholar]
309. Сейедмусави С., Видерхольд Н.П., Эбель Ф., Хедаяти М.Т., Вервей Ч.Е. Противогрибковое применение в ветеринарной практике и возникновение резистентности. В Seyedmousavi S, Guillot JG, de Hoog GS, Verweij PE, ред. Эмерджентные и эпидемические грибковые инфекции. Спрингер; 2017. Под давлением. [Google Scholar]
Исследователь животных
Обратная связь
Обратная связь
Можете ли вы найти земноводных, рептилий, рыб, птиц или млекопитающих? Есть ли такие, которые не входят в эти группы?
Земноводные
Обыкновенная лягушка
Гладкий тритон
Рептилии
Черепаха
Крокодил
Травяная змея
Рыба
Акула
Птицы
Пингвин
сорока
Млекопитающие
Человек
Овец
Беспозвоночные
пчела
Паук
Червь
Улитка
Бабочка
Вопрос: 1 из 3
Распредели этих животных по правильным группам.
Перетащите нужных животных в ячейки
Земноводные
Рептилии
Млекопитающие
Проверять
Вопрос: из 3
Рассортируйте этих животных по правильным группам.
Перетащите нужных животных в ячейки
Земноводные
Рептилии
Млекопитающие
Проверять
Вопрос: из 3
Распределите этих животных по правильным группам.
Перетащите нужных животных в ячейки
Земноводные
Рептилии
Млекопитающие
Проверять
Вопрос: из 3
Рассортируйте этих животных по правильным группам.
Перетащите нужных животных в ящики
Земноводные
Рептилии
Млекопитающие
Проверять
Вопрос: из 3
Рассортируйте этих животных по правильным группам.
Перетащите нужных животных в ячейки
Земноводные
Рептилии
Млекопитающие
Проверять
Вопрос: из 3
Рассортируйте этих животных по правильным группам.
Перетащите нужных животных в ящики
Земноводные
Рептилии
Млекопитающие
Проверять
Вопрос: из 3
Рассортируйте этих животных по правильным группам.
Перетащите нужных животных в ячейки
Земноводные
Рептилии
Млекопитающие
Проверять
Вопрос: из 3
Рассортируйте этих животных по правильным группам.
Перетащите нужных животных в коробки
Земноводные
Рептилии
Млекопитающие
Проверять
Вопрос: из 3
Рассортируйте этих животных по правильным группам.
Перетащите нужных животных в ячейки
Земноводные
Рептилии
Млекопитающие
Проверять
Вопрос: из 3
Рассортируйте этих животных по правильным группам.
Перетащите нужных животных в ячейки
Земноводные
Рептилии
Млекопитающие
Проверять
Вопрос: из 3
Рассортируйте этих животных по правильным группам.
Перетащите нужных животных в ячейки
Земноводные
Рептилии
Млекопитающие
Проверять
Вопрос: из 3
Рассортируйте этих животных по правильным группам.
Перетащите нужных животных в ячейки
Земноводные
Рептилии
Млекопитающие
Проверять
10 домашних средств от молочницы полости рта
Когда вы смотрите на белые пятна на языке и щеках и имеете дело с хлопком во рту, вы хотите, чтобы это исчезло — сейчас же.
Эти симптомы, вероятно, указывают на молочницу полости рта (также называемую кандидозом полости рта), и хотя обычно это не о чем беспокоиться, они могут вызывать дискомфорт.
То, что вы видите, это разрастание дрожжей кандиды.
Candida albicans — тот же грибок, который вызывает вагинальные дрожжевые инфекции — естественным образом размножается во рту.
Но когда что-то нарушает естественный баланс микробиома полости рта, и вы получаете разрастание грибка Candida, у вас развивается оральный кандидоз.
Наиболее распространенным методом лечения молочницы полости рта являются противогрибковые препараты, отпускаемые по рецепту.
Тем не менее, природные средства могут помочь некоторым людям бороться с молочницей.
Чтобы помочь вам определить наилучший курс действий, в этой статье я объясню научные принципы, лежащие в основе 10 домашних средств от стоматита, а также симптомы стоматита и когда вам следует обратиться к врачу за медицинской консультацией.
Обеспокоены молочницей полости рта? Пообщайтесь с врачом сегодня всего за $35
Chat Now
Домашние средства от молочницы полости рта
Вещи, которые, вероятно, есть у вас дома или которые вы можете легко купить, могут помочь в лечении кандидоза полости рта или, по крайней мере, помочь вам чувствовать себя более комфортно, пока вы не обратитесь к врачу.
Имейте в виду, что, хотя они являются «естественными», домашние методы лечения дрожжевых инфекций все же могут вызывать побочные эффекты.
Поэтому лучше всего проконсультироваться с врачом перед тем, как попробовать какое-либо из этих домашних средств, особенно если у вас есть какие-либо сопутствующие заболевания, которые могут способствовать кандидозной инфекции.
Пробиотики
Пробиотики — это «хорошие» бактерии, которые приносят пользу здоровью при их употреблении.
В случае молочницы ротовой полости эти полезные бактерии могут помочь восстановить баланс флоры во рту, чтобы предотвратить разрастание Candida albicans.
Некоторые исследования показывают, что прием пробиотических добавок защищает от молочницы полости рта, особенно у людей, которые носят зубные протезы.
Добавки, содержащие лактобациллы, могут иметь наибольшую пользу.
Яблочный уксус
Яблочный уксус, представляющий собой перебродивший яблочный сок, обладает природными противогрибковыми свойствами.
А клеточные исследования показывают, что уксус может бороться с ростом кандиды.
Однако неясно, может ли употребление яблочного уксуса предотвратить или вылечить стоматит.
Если вы решите попробовать это домашнее средство, обязательно разбавьте яблочный уксус, так как он кислый и может повредить зубную эмаль.
Сторонники этого метода рекомендуют использовать от 1 чайной до 1 столовой ложки яблочного уксуса на 1 стакан воды и ежедневно использовать его как жидкость для полоскания рта.
Соленая вода
Соль (также известная как хлорид натрия) является противогрибковым средством, поэтому некоторые считают, что полоскание соленой водой в домашних условиях может облегчить симптомы молочницы полости рта и другие проблемы с полостью рта.
Хотя это и не вредно, исследования этого средства также не проводились.
Если вы решите попробовать, растворите 1/2 чайной ложки соли в 1 стакане теплой воды и не глотайте после полоскания — выплюньте соленую воду.
Гигиена полости рта
Хотя неизвестно, может ли хорошая гигиена полости рта предотвратить или вылечить кандидоз полости рта, всегда полезно заботиться о своих зубах и деснах.
Выполните следующие действия:
- Приходите на прием к стоматологу для регулярной чистки и осмотра.
- Щетка и зубная нить ежедневно.
- Выберите зубную щетку с мягкой щетиной, которая не будет больше раздражать рот.
- Меняйте зубную щетку каждые три месяца и используйте мягкую зубную щетку.
- Ежедневно пейте достаточное количество воды, чтобы предотвратить сухость во рту.
Пищевая сода
Пищевая сода является распространенным домашним средством от стоматита, но эффективность этого основного продукта недостаточно изучена.
В одном испытании люди, перенесшие реконструктивную хирургию полости рта и использовавшие солевой раствор для полоскания пищевой соды, предотвратили кандидоз полости рта.
Таким образом, полоскание рта пищевой содой и водой, вероятно, не причинит вам вреда, но может и не помочь в лечении кандидозного стоматита.
Генцианвиолет
Генцианвиолет, также известный как кристаллвиолет или метилвиолет 10b, представляет собой тип антисептического красителя, использовавшегося в 19 веке для борьбы с бактериями, грибками и паразитами.
Исследования показали его эффективность против Candida albicans.
Вы можете найти горечавку фиолетовую, безрецептурное лекарство, в большинстве аптек.
Найдите 1% раствор.
Чтобы использовать его, нанесите немного на ватный тампон или ватный тампон, затем осторожно промокните им белые пятна во рту.
Имейте в виду, что генцианвиолет — это краситель, поэтому он может легко испачкать рот или одежду. Также будьте осторожны, чтобы не проглотить раствор.
Также будьте осторожны, чтобы не проглотить раствор.
Эфирные масла
Некоторые эфирные масла могут быть потенциальным средством от молочницы полости рта.
Полезны, по крайней мере, некоторые из них:
- Гвоздичное масло : Благодаря своим естественным болеутоляющим и противогрибковым свойствам гвоздичное масло обычно используется в качестве домашнего средства для ухода за полостью рта. и стоматологические проблемы. Плюс клеточные исследования показывают, что он может предотвратить или вылечить молочницу полости рта. Вы можете сделать гвоздичную мазь для рта, добавив несколько капель чистого гвоздичного масла в пищевое масло-носитель, например кокосовое масло. Наносите его по мере необходимости на белые пятна во рту, но имейте в виду, что масло может вызвать покалывание или жжение.
- Масло лемонграсса : Это натуральное противомикробное средство борется с бактериями и грибками и, согласно клеточным исследованиям, подавляет рост кандиды и, следовательно, может помочь в лечении стоматита.
 Разбавьте несколько капель масла в стакане воды и при необходимости используйте его для полоскания рта.
Разбавьте несколько капель масла в стакане воды и при необходимости используйте его для полоскания рта. - Масло розмарина : Еще одно эфирное масло с противогрибковыми свойствами, масло розмарина также борется с Candida albicans. Если вы хотите попробовать это, добавьте несколько капель в чашку с водой, прополощите рот, а затем выплюньте.
- Масло чайного дерева : Масло чайного дерева, также известное как масло мелалеуки, является антисептиком, который может бороться с кандидозом и, следовательно, возможно лечить стоматит. Одно небольшое исследование людей, живущих со СПИДом, показало, что использование жидкости для полоскания рта маслом чайного дерева помогло вылечить молочницу полости рта. Исследователи доверяют соединению под названием терпинен-4-ол. Как и в случае с другими эфирными маслами от стоматита, используйте масло чайного дерева для полоскания рта: разведите пару капель в воде, прополощите рот этим раствором, а затем выплюньте.

Кокосовое масло
Кокосовое масло содержит каприловую и лауриновую кислоты, обе из которых подавляют рост кандиды.
Одно исследование также предполагает, что кокосовое масло может быть таким же эффективным, как и лекарство флуконазол, в устранении симптомов молочницы полости рта.
Практика, называемая полосканием рта маслом, может помочь в борьбе с грибком полости рта.
Просто положите в рот столовую ложку сырого кокосового масла первого отжима, прополощите его, пока оно растает, и выплюньте.
Если можете, стремитесь полоскать рот около 20 минут, чтобы получить максимальную пользу.
Однако 5-10 минут тоже могут помочь.
Йогурт
Поскольку йогурт содержит пробиотики — «здоровые» бактерии, которые могут предотвратить чрезмерный рост грибков, — он может быть полезным домашним средством от стоматита.
В одном небольшом исследовании пожилые люди употребляли пробиотический йогурт или обычный сыр.
У тех, кто ел йогурт, заболеваемость кандидозом полости рта снизилась на 32%.
Если вы попробуете йогурт от стоматита, выберите простой йогурт с низким содержанием сахара или без добавления сахара.
Слишком много сахара в вашем рационе может способствовать разрастанию грибка и усугубить ваши симптомы.
Лимонный сок
Лимонный сок считается естественным противогрибковым средством.
Тем не менее, только одно небольшое исследование изучало его влияние на кандиду: люди, живущие с ВИЧ, у которых также была оральная молочница, принимали горечавку фиолетовую, лимонный сок или лимонную траву в течение 11 дней.
Лимонный сок помог вылечить инфекцию.
Необходимы дополнительные исследования, но если вы хотите попробовать это, выжмите половинку лимона в стакан воды и выпейте.
Вы также можете использовать смесь лимонного сока и стакана воды для полоскания рта.
Нанесение лимонного сока непосредственно на очаги молочницы во рту может оказаться бесполезным, поскольку кислотность сока может усилить раздражение.
Обеспокоены молочницей полости рта? Пообщайтесь с врачом сегодня всего за $35
Чат сейчас
Симптомы кандидоза полости рта
Во рту у всех есть Candida albicans, и обычно это не вызывает проблем.
Но когда грибок разрастается, это может привести к молочнице полости рта и неприятным симптомам, таким как: , болезненность или жжение
Когда обратиться к врачу по поводу кандидоза полости рта
В большинстве случаев кандидоз ротовой полости проходит в течение 1–2 недель.
Но в некоторых случаях лучше обратиться к поставщику медицинских услуг для правильной диагностики и лечения.
Обратитесь к врачу, если:
- У вас есть заболевание (например, ВИЧ или рак), которое вызывает слабую иммунную систему.

- У вашего ребенка наблюдаются симптомы стоматита.
- В целом вы здоровы, но болячки не проходят при домашнем лечении.
Чем может помочь K Health
Знаете ли вы, что через K Health можно получить лечение от дрожжевой инфекции через Интернет?
Наши врачи доступны круглосуточно и без выходных, чтобы предоставить вам необходимую помощь или лекарства.
K Все статьи о здоровье написаны и рецензированы докторами медицины, докторами наук, НП или фармацевтами и предназначены только для информационных целей. Эта информация не является профессиональной медицинской консультацией и на нее не следует полагаться. Всегда говорите со своим врачом о рисках и преимуществах любого лечения.
K Health имеет строгие правила выбора поставщиков и полагается на рецензируемые исследования, академические исследовательские институты, и медицинские ассоциации. Мы избегаем использования третичных ссылок.
Антибиопленочная эффективность масла чайного дерева и его основного компонента терпинен-4-ол против Candida Albicans.
 (2020).
(2020).
https://pubmed.ncbi.nlm.nih.gov/32578760/Антикандидозная активность эфирных масел, включая масло лемонграсса (Cymbopogon Citratus) и его компонент, цитраль. (2003).
https://pubmed.ncbi.nlm.nih.gov/14615795/Противогрибковая активность яблочного уксуса в отношении видов Candida, вызывающих стоматологический стоматит.
 (2015).
(2015).
https://pubmed.ncbi.nlm.nih.gov/25219289/Противогрибковая активность эфирных масел хемотипа розмарина против Candida Albicans. (2013).
https://www.scirp.org/journal/paperinformation.aspx?paperid=32053Противогрибковая активность экстракта эфирных масел из Origanum Dloribundum Munby, Rosmarinus Officinalis L.
 и Thymus Ciliatus Desf. Против Candida Albicans, выделенного при клиническом мастите крупного рогатого скота. (2017).
и Thymus Ciliatus Desf. Против Candida Albicans, выделенного при клиническом мастите крупного рогатого скота. (2017).
https://www.sciencedirect.com/science/article/abs/pii/S1156523317300173Антимикробная активность яблочного уксуса в отношении Escherichia Coli, Staphylococcus Aureus и Candida Albicans; Снижение экспрессии цитокинов и микробных белков. (2018).
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5788933/Оценка противогрибковой активности растительных и традиционных зубных паст в отношении клинических изолятов Candida Albicans.
 (2012).
(2012).
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3609312/Нарушения Candida Albicans, вызванные маслами мяты перечной и гвоздики в субингибиторных концентрациях. (2017).
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5486128/Влияние эфирных масел гвоздики и тимьяна на формирование биопленки Candida и распределение масла в клетках дрожжей.
 (2019).
(2019).
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6572016/Влияние пробиотиков на кандидоз полости рта: систематический обзор и метаанализ. (2019).
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6836010/Эффективность перорального раствора Melaleuca на спиртовой и безалкогольной основе для лечения флуконазолрезистентного орофарингеального кандидоза у пациентов со СПИДом.
 (2002).
(2002).
https://pubmed.ncbi.nlm.nih.gov/12407487/Горечавка фиолетовая: A 19Наркотики века вновь появляются в 21 веке. (2013).
https://onlinelibrary.wiley.com/doi/10.1111/exd.12257Как можно предотвратить оральную молочницу? (2012).

https://www.ncbi.nlm.nih.gov/books/NBK367577/Антимикробные свойства кокосового масла in vitro на виды Candida в Ибадане, Нигерия. (2007).
https://pubmed.ncbi.nlm.nih.gov/17651080/Ингибирующее действие масла лемонграсса и его основных компонентов на формирование биопленки Candida и зародышевых трубок.
0713 (2012).
(2012).
https://www.sciencedirect.com/science/article/pii/S0254629Естественное отбеливание зубов: правда против вымысла. (н.д.).
https://www.mouthhealthy.org/en/az-topics/w/natural-teeth-whiteningПолоскание маслом для поддержания гигиены полости рта – обзор.
 (2017).
(2017).
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5198813/Профилактика кандидоза полости рта после операции свободного лоскута: роль 3% солевого раствора бикарбоната натрия в уходе за полостью рта. (2017).
https://pubmed.ncbi.nlm.nih.gov/27669373/Пробиотики снижают распространенность кандидоза полости рта у пожилых людей — рандомизированное контролируемое исследование.
 (2007).
(2007).
https://pubmed.ncbi.nlm.nih.gov/17251510/Хлорид натрия ингибирует рост и инфекционную способность амфибийного хитридиевого грибка и увеличивает выживаемость хозяев. (2012).
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3349647/Подавление воспалительных реакций терпинен-4-ол, основным компонентом масла чайного дерева, в мышиной модели кандидоза полости рта и его подавляющая активность в отношении продукции цитокинов макрофагами in vitro.
 (2013).
(2013).
https://pubmed.ncbi.nlm.nih.gov/23649340/Лечение оральной молочницы у пациентов с ВИЧ/СПИДом с помощью лимонного сока и лимонной травы (Cymbopogon Citratus) и горечавки фиолетовой. (2008).
https://pubmed.ncbi.nlm.nih.gov/101/
| Амфибия | Cryptobranchus alleganiensis | Восточный адский покоритель | Чрезвычайно уязвимый | S2S3 | G3T2 |
| Амфибия | Скафиоп холбрукийский | чесночница | Чрезвычайно уязвимый | S2S3 | G5 |
| Амфибия | Амбистома Джефферсона | Саламандра Джефферсона | Очень уязвимы | S3 | G4 |
| Амфибия | Pseudacris brachyphona | Горная хоровая лягушка | Очень уязвимы | S2 | G5 |
| Птица | Дендроика лазурная | Лазурная славка | Предположительно стабильный | S4 | G4 |
| Птица | Гельмитерос червеобразный | Червеядная славка | Предположительно стабильный | S4 | G5 |
| Птица | Vermivora chrysoptera | Златокрылая славка | Вероятность увеличения | С2Б,С3М | G4 |
| Птица | Аммодрамус Хенслоуи | воробей Хенслоу | Вероятность увеличения | С3Б,С2М | G4 |
| Птица | Лебедь колумбийский | Тундровый лебедь | Вероятность увеличения | С4Н,С3М | G5 |
| Птица | Vermivora pinus | Голубокрылая славка | Вероятность увеличения | S4 | G5 |
| Птица | Hylocichla mustelina | Древесный дрозд | Вероятность увеличения | С4Б,С4М | G4 |
| Птица | Паранга масличная | Алая танагра | Вероятность увеличения | S5 | G5 |
| Птица | Сейурус мотацилла | Луизианский водяной дрозд | Вероятность увеличения | S5 | G5 |
| Беспозвоночные — Пещера | Stygobromus stellmacki | Амфипод пещеры Стеллмака | Предположительно стабильный | S1 | G1G2 |
| Беспозвоночные — Пещера | Цена на Сфаллоплана | Планария из пещеры Рефтон | Предположительно стабильный | S1 | G2G3 |
| Беспозвоночные — Пещера | Цецидотея кенки | изопод | Предположительно стабильный | S1 | G3 |
| Беспозвоночное — Насекомое | Пиерис виргинский | Западная Вирджиния белый | Очень уязвимы | S2S3 | Г3? |
| Беспозвоночное — Насекомое | Ликаена эпиксанте | Болотная медь | Очень уязвимы | S2 | G4G5 |
| Беспозвоночное — Насекомое | Пиргус виандот | Аппалачский седой шкипер | Умеренно уязвимый | S1 | G1G2Q |
| Беспозвоночное — Насекомое | Cicindela marginipennis | Булыжный тигровый жук | Умеренно уязвимый | S1 | G2 |
| Беспозвоночное — Насекомое | Cicindela ancocisconensis | Аппалачский тигровый жук | Умеренно уязвимый | S1 | G3 |
| Беспозвоночное — Насекомое | Гомфус виридифронс | Зеленая косолапость | Умеренно уязвимый | S1 | G3G4 |
| Беспозвоночное — Насекомое | Гомфус четырехцветный | Рапидс косолапый | Умеренно уязвимый | S1S2 | G3G4 |
| Беспозвоночное — Насекомое | Папайпема зр. 1 1 | Мухоморная мотылька | Умеренно уязвимый | S2 | G2G3 |
| Беспозвоночное — Насекомое | Калефелис северный | Северная металлическая марка | Умеренно уязвимый | S2 | G3G4 |
| Беспозвоночное — Насекомое | Шпейерия идалия | Королевский рябчик | Предположительно стабильный | S1 | G3 |
| Беспозвоночное — Насекомое | Зале Курема | Северо-восточный сосновый лес | Предположительно стабильный | S1 | G3G4 |
| Беспозвоночное — Насекомое | Каллофрис ирус | Морозный эльф | Предположительно стабильный | S1S2 | G3 |
| Беспозвоночное — Насекомое | Чисиндела Патруэла | Тигровый жук северных степей | Предположительно стабильный | S2S3 | G3 |
| Беспозвоночное — Насекомое | Леммерия наперстянка | Пальчатая моль леммерия | Предположительно стабильный | S2S4 | G4 |
| Беспозвоночное — Насекомое | Calycopis cecrops | Красная полоса волос | Вероятность увеличения | S4 | G5 |
| Млекопитающее | Myotis leibii | Восточная мелконогая летучая мышь | Умеренно уязвимый | S2 | G4 |
| Млекопитающее | Магистр Неотомы | Аллегейский вудрат | Умеренно уязвимый | S2 | G3G4 |
| Млекопитающее | Sylvilagus obscurus | Аппалачский кролик | Предположительно стабильный | S1S2 | G4 |
| Млекопитающее | Лепус американский | Заяц на снегоступах | Предположительно стабильный | S4 | G5 |
| Моллюск | Маргаритифера Маргаритифера | Восточная жемчужница | Чрезвычайно уязвимый | S1 | G4 |
| Моллюск | Аласмидонта гетердон | Карликовая клиновидная мидия | Очень уязвимы | S1 | G1G2 |
| Моллюск | Плевробема булавовидная | Клубная ракушка | Очень уязвимы | S2 | G1G2 |
| Моллюск | Мохнатые фабалисы | Лучевая фасоль | Очень уязвимы | S1S2 | G2 |
| Моллюск | Epioblasma torulosa rangiana | Северная рифленая ракушка | Очень уязвимы | S2 | G2 |
| Моллюск | Лампсилис кариоза | Желтая мидия | Очень уязвимы | S4 | G3G4 |
| Завод | Platanthera blephariglottis | Белая бахромчатая орхидея | Чрезвычайно уязвимый | S2S3 | G4G5 |
| Завод | Оклемена неморальная | Астра болотная лиственная | Чрезвычайно уязвимый | S1 | G5 |
| Завод | Шейхцерия болотная | Под-трава | Чрезвычайно уязвимый | S1 | G5 |
| Завод | Осинка малосперматозоидная | Осока малосемянная | Чрезвычайно уязвимый | S2 | G5 |
| Завод | Мюленбергия одноцветковая | Осенний дрозд мухли | Чрезвычайно уязвимый | S2 | G5 |
| Завод | Utricularia cornuta | пузырчатка рогатая | Чрезвычайно уязвимый | S2 | G5 |
| Завод | Carex лимоза | Осока грязевая | Чрезвычайно уязвимый | S2 | G5 |
| Завод | Андромеда многолистная | багульник болотный | Чрезвычайно уязвимый | S3 | G5 |
| Завод | Гаультерия шиповидная | Ползучий снежник | Чрезвычайно уязвимый | S3 | G5 |
| Завод | Рододендрон гренландский | Лабрадор-чай | Чрезвычайно уязвимый | S3 | G5 |
| Завод | Абиес бальзамический | бальзамическая пихта | Чрезвычайно уязвимый | S3 | G5 |
| Завод | Picea rubens | Красная ель | Чрезвычайно уязвимый | S4 | G5 |
| Завод | Кальмия полифолия | Болотный лавр | Чрезвычайно уязвимый | С4/С5 | G5 |
| Завод | Далибарда ползучая | Росинка | Чрезвычайно уязвимый | ОСШ | G5 |
| Завод | Vaccinium макрокарпон | Клюква | Очень уязвимы | ОСШ | G4 |
| Завод | обесцвечивание типулярии | Журавлиная орхидея | Очень уязвимы | S3 | G4G5 |
| Завод | Арцеутобиум пузиллум | Карликовая омела | Очень уязвимы | S2 | G5 |
| Завод | Carex paupercula | Осока болотная | Очень уязвимы | S3 | G5 |
| Завод | Майантема трехлистная | Ложная печать Соломона | Очень уязвимы | S4 | G5 |
| Завод | Рододендрон канадский | Родора | Очень уязвимы | ОСШ | G5 |
| Завод | Коптис трехлистный | Золотая нить | Очень уязвимы | ОСШ | G5 |
| Завод | Vaccinium oxycossos | Малая клюква | Очень уязвимы | ОСШ | G5 |
| Завод | Picea mariana | Черная ель | Очень уязвимы | ОСШ | G5 |
| Завод | Виола селькирская | Большая шпорцевая фиалка | Очень уязвимы | S3 | G5? |
| Завод | Ruellia strepens | Дикая известняковая петуния | Умеренно уязвимый | S2 | G4G5 |
| Завод | Schoenoplectus subterminalis | Водяной камыш | Умеренно уязвимый | S3 | G4G5 |
| Завод | Quercus phellos | Ива дуб | Умеренно уязвимый | S2 | G5 |
| Завод | Бартония метельчатая | Винтовой шток | Умеренно уязвимый | S3 | G5 |
| Завод | Juncus нитевидный | Поток спешки | Умеренно уязвимый | S3 | G5 |
| Завод | Эриторний альбидум | Белая форель-лилия | Умеренно уязвимый | S3 | G5 |
| Завод | Chamaedaphne calyculata | Кожаный лист | Умеренно уязвимый | ОСШ | G5 |
| Завод | Корнус канадский | Банчберри | Умеренно уязвимый | ОСШ | G5 |
| Завод | Ринхоспора белая | Белый клюв | Умеренно уязвимый | ОСШ | G5 |
| Завод | Солидаго улигиноза | Золотарник болотный | Предположительно стабильный | S3 | G4G5 |
| Завод | Conoclinum coelestinum | Туманник | Предположительно стабильный | S3 | G5 |
| Завод | Галиум широколистный | Фиолетовая подмаренка | Предположительно стабильный | S3 | G5 |
| Завод | Рамосиор Ротала | Зубочистка | Предположительно стабильный | S3 | G5 |
| Завод | Саликс черешковый | Ива луговая | Предположительно стабильный | S4 | G5 |
| Завод | Эриофорум виргиникум | Пушица рыжеватая | Предположительно стабильный | ОСШ | G5 |
| Завод | Prunus pumila var. депрессия депрессия | Восточная песчаная вишня | Предположительно стабильный | S1 | G5T5 |
| Рептилия | Glyptemys muhlenbergii | Болотная черепаха | Очень уязвимы | S2 | G2G3 |
| Рептилия | Клемми Гуттата | Пятнистая черепаха | Умеренно уязвимый | S3S4 | G5 |
| Рептилия | Crotalus horridus | Древесная гремучая змея | Предположительно стабильный | S3S4 | G4 |
| Рептилия | Глиптемис инскульпта | Деревянная черепаха | Предположительно стабильный | S3S4 | G3 |
Вашингтон Среда обитания, млекопитающие, птицы, земноводные, рептилии
Чтобы просматривать эти ресурсы без рекламы, войдите или подпишитесь (и помогите поддержать наш сайт).

В штате Вашингтон есть большое разнообразие природных сообществ, включая морские воды, приливные бассейны, эстуарии, тропические леса, сухие хвойные леса, субальпийские и альпийские луга и парковые зоны, кустарниковые степи, луга, прерии, песчаные дюны, прибрежные районы и многие виды пресноводное заболоченное место.
Прибрежная среда обитания
Морская среда обитания в Вашингтоне включает глубокие морские воды, заросли взморника, приливные бассейны, скалистые утесы, системы дюн, эстуарии и пляжи. Прибрежные экосистемы обеспечивают среду обитания для мигрирующих куликов, а в приливных бассейнах обитают морские звезды, анемоны, рыбы и крабы. В более глубоких водах водятся косатки, тюлени, дельфины, каланы и даже осьминоги.
Леса
Вечнозеленые леса из ели ситхинской и тсуги западной преобладают, причем самые большие деревья достигают 250 футов в высоту и 60 футов в окружности. Эти деревья могут жить сотни лет. Эти влажные леса также являются идеальной средой обитания для мхов, папоротников и лишайников, поскольку толстый полог помогает удерживать температуру от слишком высоких или низких температур. Здесь вы можете найти самое большое стадо лосей Рузвельта в Соединенных Штатах, а также редкую северную пятнистую сову и мраморного пыжика.
Эти влажные леса также являются идеальной средой обитания для мхов, папоротников и лишайников, поскольку толстый полог помогает удерживать температуру от слишком высоких или низких температур. Здесь вы можете найти самое большое стадо лосей Рузвельта в Соединенных Штатах, а также редкую северную пятнистую сову и мраморного пыжика.
На Олимпийском полуострове есть редкие тропических лесов умеренного пояса , где каждый год может идти дождь до 14 футов!
Горы — Вулканы
Вашингтон является родиной Маунт-Рейнир с его скалистыми альпийскими склонами, хребтами, субальпийскими лугами, озерами, лесами с высокими деревьями, водопадами, ручьями и реками. Вулканические вершины в Вашингтоне также включают гору Бейкер, ледниковый пик, а также гору Адамс и гору Сент-Хеленс.
Водно-болотные угодья
Штат Вашингтон имеет много видов водно-болотных угодий, включая сфагновых болот (торфяные водно-болотные угодья), пресноводные водно-болотные угодья ( болота, болота и болота ), водно-болотные угодья ущелья реки Колумбия (прибрежные водно-болотные угодья с круглогодичным или сезонным затоплением вдоль реки), заливные равнинные водно-болотные угодья (встречающиеся вдоль рек, таких как Колумбия, со старыми руслами, заводями, прудами и островами) и водно-болотные угодья нагонных равнин ( приливных пресноводных водно-болотных угодий , которые встречаются вдоль крупных рек. Уровень воды поднимается и опускается с приливы, но вода почти всегда пресная).
Уровень воды поднимается и опускается с приливы, но вода почти всегда пресная).
Для получения дополнительной информации о природных сообществах штата Вашингтон перейдите по ссылке: ССЫЛКА
Пожалуйста, войдите или подпишитесь, чтобы получить доступ к загружаемому контенту.
Раскрашивание животных этого штата
Маркировка животных этого штата
Пожалуйста, войдите или подпишитесь, чтобы получить доступ к загружаемому контенту.
Список млекопитающих для этого штата
Наземные млекопитающие
барсук
летучая мышь (большая коричневая)
летучая мышь (California myotis)
летучая мышь (бахромчатый миотис)
летучая мышь (седая)
летучая мышь (кина)
летучая мышь (маленький коричневый миотис)
летучая мышь (длинноухий миотис)
летучая мышь (длинноногий коричневый)
летучая мышь (бледный)
летучая мышь (сереброволосый)
летучая мышь (пятнистый)
летучая мышь (западный нетопырь)
летучая мышь (западный ушастый)
летучая мышь (западный малоногий миотис)
летучая мышь (юма)
медведь (черный)
медведь (гризли)
бобр (американский)
бобр (горный)
снежный горн овца
бизон
рысь
карибу (американский лесной массив)
бурундук (минимум)
бурундук (краснохвостый)
бурундук (таунсендский)
бурундук (желто-сосновый)
койот
олень (мул)
олень (белохвостый)
лось
рыбак
лисица (рыжая)
суслик (калифорнийский) наземная белка (каскадная)
суслик (колумбийский)
суслик (золотошейный)
суслик (вашингтонский)
заяц (чернохвостый)
заяц (снегоступый)
заяц (белохвостый)
прыгающая мышь (тихоокеанская)
прыгающая мышь (вестерн)v
кенгуровая крыса (Орда)
лемминг (североболотный)
рысь (канадская)
сурок (седой)
сурок (олимпийский)
сурок (желтобрюхий)
куница (американская)
норка
крот (береговой)
крот (крот Гиббса)
-крот)
лось
горный козел
горный лев
мышь (олень)
мышь (лесной олень)
мышь (домовая)
мышь (северный кузнечик)
мышь (западный урожай)
ондатра
нутрия
опоссум (Вирджиния1) выдра 91 (речная)
выдра (морская)
пищуха (американская)
карманный суслик (северный)
карманный суслик (западный)
карманная мышь (Большой бассейн)
дикобраз
кролик (щетка)
кролик (восточный кролик)
кролик (европейский)
кролик (хлопчатобумажный хвост Наттолла)
кролик (пигмей)
енот
крыса (черная)
крыса (Норвегия)
бурозубка (цинереус)
бурозубка (темная)
бурозубка (маркированная)
бурозубка (Мерриамс)
бурозубка (горная)
бурозубка (тихоокеанская вода) Preble’s)
землеройка (пигмей)
землеройка (троубриджская)
землеройка (бродячая)
землеройка (водяная)
скунс (полосатый)
скунс (западная пятнистая)
белка (дуглас)
белка (восточная серая)
белка (лисица)
белка-летяга белка (рыжая)
белка (западная серая)
полевка (калифорнийская красноспинная)
полевка (ползающая)
полевка (серохвостая)
полевка (вересковая)
полевка (длиннохвостая)
полевка (луговая)
полевка ( Montane)
полевка (степная)
полевка (полынная)
полевка (южная красноспинная)
полевка (таунсендовская)
ласка (длиннохвостая)
ласка (короткохвостая) или горностай
волк (серый)
росомаха
сурок
вудрат (кустохвостый)
дельфин (обыкновенный)
дельфин (северный кит)
дельфин (тихоокеанский полосатый)
дельфин (тихоокеанский белобокий)
дельфин (риссо)
морская свинья (Далла)
тюлень (гавань)19 (северный слон)
нерпа (северный мех)
морской лев (калифорнийский)
морской лев (северный)
кит (дугоклювый)
кит (береговоклювый)
кит (беринговоморский клювоклюв)
кит (синий)
кит (ложная косатка)
кит (плавниковый)
кит ( гусиный клюв)
кит (серый)
кит (горбатый)
кит (малый полосатик)
кит (тихоокеанский косатка)
кит (тихоокеанский правый)
кит (короткоперый пилот)
кит (сей)
млекопитающие (включая латинские названия) нажмите на отдельные ссылки животных или на другой ресурс: ССЫЛКА
Чтобы просматривать эти ресурсы без рекламы, войдите или подпишитесь (и помогите поддержать наш сайт).

Окраска млекопитающих этого штата
Маркировка млекопитающих этого штата
Пожалуйста, войдите или подпишитесь, чтобы получить доступ к загружаемому контенту.
Список амфибий и рептилий для этого штата
Земноводные
лягушка-бык (американская)
Ensatina
лягушка (каскады)
лягушка (прибрежнохвостая)
лягушка (колумбийская пятнистая)
лягушка (зеленая)
лягушка (леопард)
лягушка (северная красноногая)
лягушка (орегонская пятнистая)
тритон (грубокожий)
саламандра (каскадный поток)
саламандра (колумбийский поток)
саламандра (прибрежный гигант)
саламандра (гигант Коупа)
саламандра (данновская)
саламандра (лиственничная горная)
саламандра (длиннопалая)
саламандра (северо-западная)
саламандра (олимпийский поток)
саламандра (тигр)
саламандра (Ван Дайк)
саламандра (западная красная -поддерживаемый)
квакша (тихоокеанская)
жаба (черноногая)
жаба (западная)
жаба (вудхаус)
рептилии
ящерица (северный аллигатор)
ящерица (полынная)
ящерица четырехсторонняя пятнистая)
ящерица (южный аллигатор)
ящерица (западная изгородь)
гремучая змея (западная)
сцинк (западная)
змея (калифорнийская горная королевская змея)
змея (обыкновенная подвязка)
змея (суслик)
змея (северо-западная подвязка) змея
(Подвязки Пьюджет-Саунд)
змея (скакун)
змея (красно-пятнистая подвязка)
змея (правая)
змея (ожерелье)
змея (резиновый удав)
змея (острохвостая)
змея (долинная подвязка)
змея (западная наземная подвязка)
черепаха (окрашенная)
черепаха (щелкающая)
черепаха (западный пруд)
змея (полосатая)
океанские рептилии:
морская черепаха (зеленая)
морская черепаха (кожаная спина)
морская черепаха (болван) морская черепаха (тихоокеанская черепаха) 900 риддл Для получения дополнительной информации об амфибиях и рептилиях Вашингтона (включая латинские названия) нажмите на отдельные ссылки на животных или на другой ресурс: LINK
Окраска земноводных и рептилий этого штата
Маркировка амфибий и рептилий этого штата
Пожалуйста, войдите или подпишитесь, чтобы получить доступ к загружаемому контенту.

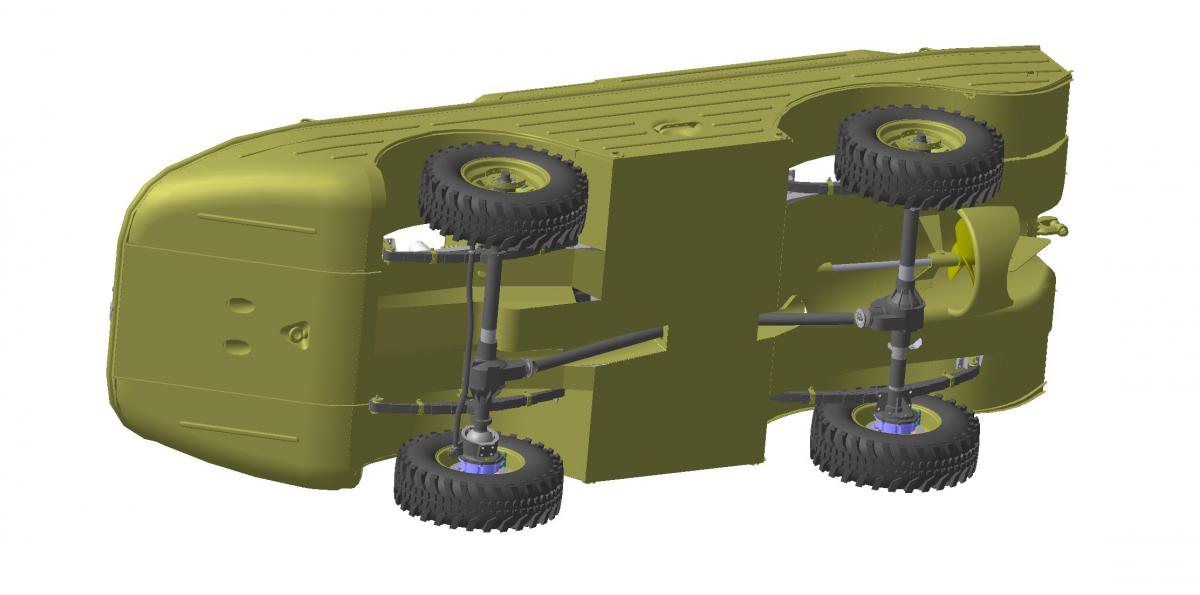 Корпус выполнен из карбона, для термоизоляции имеет ячеистые соты.
Корпус выполнен из карбона, для термоизоляции имеет ячеистые соты.

 Число колёс – 5 (1 – запасное). Запасное колесо размещено в носовой части палубы, применяется в качестве носового ударного транца.
Число колёс – 5 (1 – запасное). Запасное колесо размещено в носовой части палубы, применяется в качестве носового ударного транца.
