Оксид серы (VI) so3 (серный ангидрид)
Получение:
Окисление сернистого газа
2SO2 + О2 = 2SO3 (t0, kat)
Физические свойства
Бесцветная жидкость, при температуре ниже 170С превращается в белую кристаллическую массу. Термически неустойчивое соединение, полностью разлагается при 7000С. Хорошо растворим в воде, в безводной серной кислоте и реагирует с ней с образованием олеума
SO3+ H2SO4 = H2S2O7
Химические свойства
Кислотно-основные свойства
Типичный кислотный оксид.
1.со щелочами, образуя два типа солей: сульфаты и гидросульфаты
2KOH+SO3 = K2SO4+H2O
KOH+SO3
2. с
основными оксидами
с
основными оксидами
СаО+SO2 = СаSO4
3. с водой
H2O+SO3 = H2SO4
Окислительно-восстановительные свойства
Оксид серы (VI) – сильный окислитель, обычно восстанавливается до SO2
3SO3 + H2S = 4SО2 + H2O
Получение серной кислоты
В промышленности кислоту получают контактным способом:
1. обжиг пирита
4FeS2 +11O2 = 2Fe2O3 + 8SO2↑
2. окисление SO2 в SO3
2SO2 + О2 = 2SO3 (t0, kat
)3. растворение SO3 в серной кислоте
nSO3 + H2SO4 = H2SO4 ∙ nSO3 (олеум)
H2SO4 ∙ nSO3 + Н2О = H2SO4
Физические свойства
H2SO4 — тяжелая маслянистая жидкость, без
запаха и цвета, гигроскопична.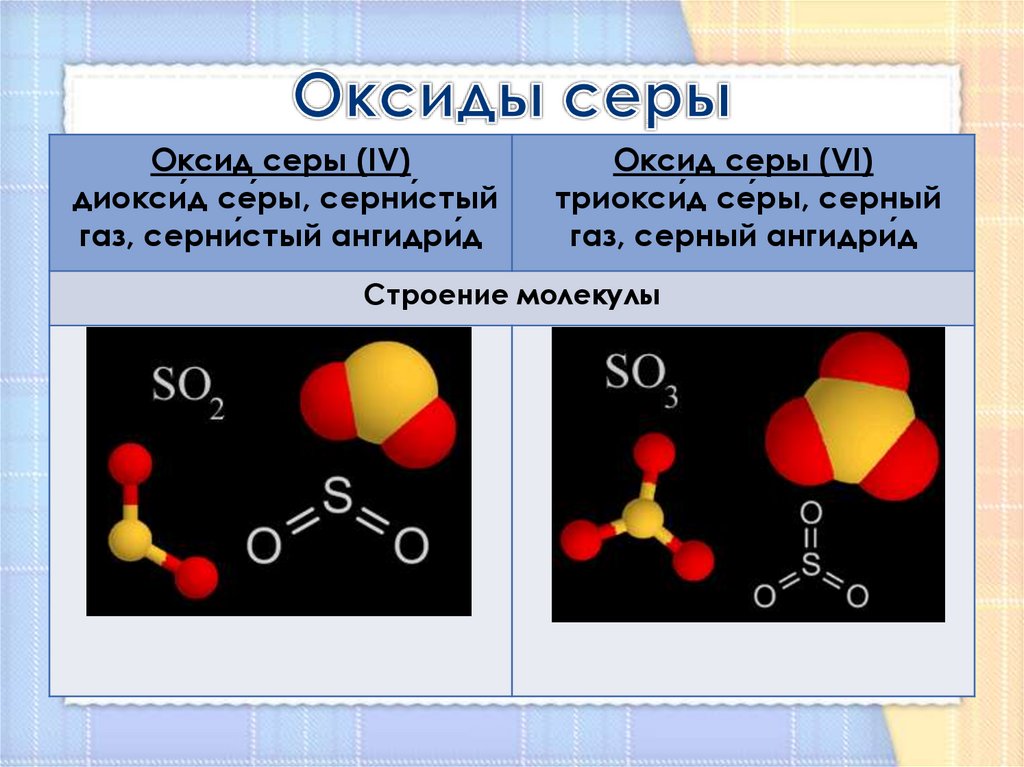 Смешивается
с водой в любых отношениях, при растворении
концентрированной серной кислоты в
воде выделяется большое количество
теплоты, поэтому её надо осторожно
приливать в воду, а не наоборот (сначала
вода, потом кислота, иначе случится
большая беда)
Смешивается
с водой в любых отношениях, при растворении
концентрированной серной кислоты в
воде выделяется большое количество
теплоты, поэтому её надо осторожно
приливать в воду, а не наоборот (сначала
вода, потом кислота, иначе случится
большая беда)
Раствор серной кислоты в воде с содержанием H2SO4 менее 70% обычно называют разбавленной серной кислотой, более 70% — концентрированной.
Химические свойства
Кислотно-основные
Разбавленная серная кислота проявляет все характерные свойства сильных кислот. В водном растворе диссоциирует:
H2SO4 ↔ 2H++ SO42-
1. с основными оксидами
MgO + H2SO4 = MgSO4 + H2O
2. с основаниями
2NaOH +H2SO4 = Na2SO4 + 2H2O
3. с солями
с солями
BaCl2 + H2SO4 = BaSO4↓ + 2HCl
Ba2+ + SO42- = BaSO4↓ (белый осадок)
Качественная реакция на сульфат-ион SO 42-
Благодаря более высокой температуры кипения, по сравнению с другими кислотами серная кислота при нагревании вытесняет их из солей:
NaCl + H2SO4 = HCl↑+ NaHSO4
Окислительно-восстановительные свойства
В разбавленной H2SO4 окислителями являются ионы Н+, а в концентрированной – сульфат –ионы SO42
В разбавленной серной кислоте растворяются металлы, находящиеся в ряду активности до водорода, при этом образуются сульфаты и выделяется водород
Zn + H2SO4 = ZnSO4+ H2↑
Концентрированная
серная кислота – энергичный окислитель
особенно при нагревании. Она окисляет
многие металлы, неметаллы, неорганические
и органические вещества.
Она окисляет
многие металлы, неметаллы, неорганические
и органические вещества.
H2SO4 (к) окислитель S+6
Активные | Средней активности | малоактивные | |
реагирует | реагирует пассивирует Al, Fe, Cr из-за пленки оксидов | реагирует Cu, Hg | не реагирует Ag,Au,Pt |
Кислота восстанавливается в основном до следующих продуктов | |||
H2S | Н2S S | SO2 | — |
С более активными металлами серная кислота в зависимости от концентрации может восстанавливаться до разнообразных продуктов
Zn + 2H2SO4 = ZnSO4 + SO2 + 2H2O
3Zn + 4H2SO4 = 3ZnSO4 + S + 4H2O
4Zn + 5H2SO4 = 4ZnSO4 + H2S + 4H2O
Концентрированная
серная кислота окисляет некоторые
неметаллы (серу, углерод, фосфор и др. ),
восстанавливаясь до оксида серы (IV)
),
восстанавливаясь до оксида серы (IV)
S
+ 2H2SO
C + 2H2SO4 = 2SO2↑ + CO2↑ + 2H2O
Взаимодействие с некоторыми сложными веществами
H2SO4+ 8HI = 4I2 + H2S + 4 H2O
H2SO4 + 2HBr = Br2 + SO2 + 2H2O
Соли серной кислоты
2 типа солей: сульфаты и гидросульфаты
Соли серной кислоты имеют все общие свойства солей. Особенным является их отношение к нагреванию. Сульфаты активных металлов (Na, K, Ba) не разлагаются даже при нагревании свыше 10000С, соли менее активных металлов (Al, Fe, Cu) разлагаются даже при небольшом нагревании
CuSO4 = CuO + SO3
Серный ангидрид и серная кислота презентация, доклад
Презентация на тему Презентация на тему Серный ангидрид и серная кислота, предмет презентации: Химия.
Серный ангидрид и серная кислота
Из всех, прошедших этот трудный путь, Вернулся ли назад хоть кто-нибудь? В дороге ничего не оставляйте – Обратно не удастся повернуть
О. Хайям
Серный ангидрид и серная кислота
1. Что такое ангидрид?
Ангидриды в неорганической химии – солеобразующие оксиды, проявляющие кислотные свойства.
При взаимодействии с водой (гидратации) ангидриды образуют соответствующие кислоты. Некоторые ангидриды реагируют с водой столь энергично, что используются как осушающие средства (например, фосфорный ангидрид P2O5).
2. Установите соответствие:
Серный ангидрид и серная кислота
3. Что такое правило Полинга?
В гидроксидах ЭОm(ОН)n с ↑m и ↓n усиливаются кислотные свойства. Это объясняется наличием в полярных молекулах кислот индукционного эффекта: смещение электронной плотности со связи О−Н на атомы кислорода облегчает отрыв протона (диссоциацию), и, как следствие, силу кислоты.
4. Сравните с помощью правила Полинга силу кислот h3SO3 и h3SO4.
Серный ангидрид и серная кислота
Серный ангидрид SO3 (ангидрид серной кислоты, оксид серы (VI), триоксид серы)
В обычных условиях легколетучая бесцветная жидкость с удушающим запахом. При температурах ниже 16,9°C застывает с образованием смеси различных кристаллических модификаций твёрдого SO3.
Серный ангидрид и серная кислота
В жидкой фазе мономерные частицы находятся в равновесии с тримерными S3O9.
В твердой фазе серный ангидрид имеет несколько кристаллических модификаций с разными TПЛ.
Сульфур(VI) оксид і сульфатна кислота
Серный ангидрид и серная кислота
Оксид серы (VI) лед
Оксид серы (VI) асбест
Серный ангидрид и серная кислота
Химические свойства
1. Кислотно-основные: SO3 – типичный кислотный оксид, ангидрид серной кислоты.
Химическая активность очень велика.
При взаимодействии с водой образует серную кислоту:
SO3 + h3O → h3SO4.
Взаимодействует с основаниями:
2KOH + SO3 → K2SO4 + h3O,
основными оксидами:
CaO + SO3 → CaSO4,
c амфотерными оксидами:
3SO3 + Al2O3 → Al2(SO4)3.
SO3 растворяется в 100%-й серной кислоте, образуя олеум:
h3SO4 (100%) + SO3 → h3S2O7 + SO3 → h3SO4·хSO3
Серный ангидрид и серная кислота
Химические свойства
2. Окислительные:
Окислительные:
Серный ангидрид – одно из самых реакционноспособных соединений.
Он проявляет окислительные свойства, например превращает уголь в углекислый газ:
2SO3 + С = 2SO2 + СO2
5SO3 + 2P → P2O5 + 5SO2
3SO3 + h3S → 4SO2 + h3O
2SO3 + 2KI → SO2 + I2 + K2SO4.
Особенности взаимодействия SO3 с галогенводородами связаны с ростом восстановительных свойств в ряду НСl – HBr – HI. Окислительные свойства SO3 усиливаются с ростом температуры. При слабом нагревании SO3 реагирует с газообразным НСl, образуя хлорсульфоновую кислоту HSO3Cl:
SO3 + НСl = HO(Cl)SO2
При повышении температуры НСl восстанавливает SO3 до SO2 с одновременным образованием Сl2.
При действии на НВr триоксида серы при 0°С выделяются SO2 и свободный бром:
2SO3 + 2НВr = SO2↑ + Br2 + h3SO4
Иодоводородом SO3 восстанавливается до h3S даже при охлаждении ниже 0°С:
SO3 + 8HI = h3S↑ + 4I2 + 3Н2O
Серный ангидрид и серная кислота
Химические свойства
Серный ангидрид термически неустойчив.
Его термическая диссоциация на SO2 и O2 начинается при 450°С, а при 1200°С в газовой фазе полностью отсутствуют молекулы SO3.
Серный ангидрид и серная кислота
Получение:
Промышленное получение
Окисление оксида серы(IV) кислородом воздуха при нагревании, в присутствии катализатора (V2O5, Pt или Na2VO3):
2SO2 + O2 ⇄ 2SO3 + Q
Реакция получения серного ангидрида экзотермическая (97 кДж/моль), поэтому она должна идти самопроизвольно, без дополнительного подогрева. Нагревание будет смещать равновесие влево, уменьшая выход нужного продукта.
Действительно, при стехиометрическом соотношении объемов SO2 и О2 = 2:1 с ростом температуры (400, 600, 700°С) выход SO3 падает: 98,1; 76,3 и 16,0% соответственно.
Таким образом, высокая температура для синтеза SO3 (в равновесных условиях) нежелательна.
Для увеличения выхода можно повысить долю О2, например, вдвое (принцип Ле Шателье, закон действующих масс).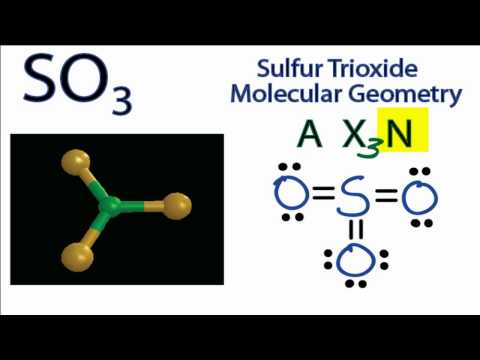 Тогда при тех же значениях температуры выход SO3 повышается, но не слишком сильно: 99,7; 88,5 и 22,0% соответственно, т.е. повышение концентрации кислорода в смеси реагентов слабо смещает равновесие в нужную сторону.
Тогда при тех же значениях температуры выход SO3 повышается, но не слишком сильно: 99,7; 88,5 и 22,0% соответственно, т.е. повышение концентрации кислорода в смеси реагентов слабо смещает равновесие в нужную сторону.
Серный ангидрид и серная кислота
Получение:
Промышленное получение
Поэтому выгоднее вести синтез SO3 при низкой температуре (в равновесных условиях).
Но понижение температуры ведет к резкому снижению скорости реакции, что влечет за собой и понижение выхода SO3.
Чтобы при относительно низкой температуре синтеза равновесие устанавливалось быстрее, необходимо использовать катализатор («контактный» метод синтеза SO3).
Кроме наиболее активного, но дорогого катализатора – мелкораздробленной платины, применяют и соединения ванадия – ванадат кальция Ca(VO2)2, оксид ванадия V2O5, а также самый дешевый катализатор – оксид железа (III).
Все катализаторы позволяют получить SO3 при 500–550°С с прекрасным выходом (~99%). При этом быстро достигается равновесие.
При этом быстро достигается равновесие.
В обычных технологических условиях только 1% SO2 остается не переведенным в SO3.
Серный ангидрид и серная кислота
Лабораторные способы получения
1. 2SO2 + О2 ⇄ 2SO3
В лабораторных условиях контактное окисление SO2 до SO3 проводят, используя в качестве катализатора платинированным асбест.
2. Термическое разложение сульфатов:
Fe2(SO4)3 → Fe2O3 + 3SO3.
3. Взаимодействие SO2 с озоном:
SO2 + O3 → SO3 + O2.
Серный ангидрид и серная кислота
Лабораторные способы получения
4. Окисление SO2 оксидом азота (IV) NO2:
SO2 + NO2 → SO3 + NO.
Транспортируя жидкий SO3, его полимеризацию предотвращают введением Р2О5, В2О3 и др.
Перевозят SO3 в цистернах из малоуглеродистой стали.
SO3 – промежуточный продукт в производстве серной кислоты и олеума. Его используют также для получения HSO3Cl, SeO3, SO2Cl2 и др. , как сульфирующий агент, для дегидратации при получении безводной азотной кислоты.
, как сульфирующий агент, для дегидратации при получении безводной азотной кислоты.
SO3 токсичен, поражает слизистые оболочки и дыхательные пути, вызывает тяжелые ожоги кожи, ПДК в воздухе рабочей зоны 1 мг/м3.
Серный ангидрид и серная кислота
Серная кислота h3SO4 – сильная двухосновная кислота, отвечающая высшей степени окисления серы (+6).
При обычных условиях концентрированная серная кислота – тяжёлая маслянистая жидкость без цвета и запаха. В технике серной кислотой называют её смеси как с водой, так и с серным ангидридом SO3. Если молярное отношение SO3:h3O 1, – раствор SO3 в серной кислоте (олеум).
Серный ангидрид и серная кислота
При обычных условиях 100%-я h3SO4 – довольно тяжелая жидкость (плотность 1,84 г/см3), поэтому серная кислота не сразу смешивается с водой. Постепенно взаимодействуя с Н2О, серная кислота может закипеть, раствор разбрызгаться и, попав на кожу экспериментатора, вызвать ожоги.
Поэтому приливать нужно только h3SO4 к воде, а не наоборот: Н2О легче, чем h3SO4, и при неправильном порядке смешения будет верхним слоем. От разогревания вследствие гидратации h3SO4 вода будет вскипать на поверхности слоя серной кислоты, и раствор h3SO4 будет разбрызгиваться.
Безводная h3SO4 при охлаждении легко затвердевает, так как имеет ТПЛ = 10,4°С.
Чтобы при транспортировке зимой h3SO4 не затвердела, в цистернах устраивают змеевики, по которым пропускают горячий водяной пар для обогревания h3SO4.
Бесцветные, похожие на лед кристаллы h3SO4 имеют слоистую структуру, ТПЛ = 10,4°С, ТКИП = 300°С с разложением.
В условиях атмосферного давления h3SO4 кипит при ~338°С, разлагаясь при этом на SO3, h3О, SO2 и О2.
Серный ангидрид и серная кислота
Получение
Промышленный синтез h3SO4
Сырье. Сырьем в производстве серной кислоты могут быть элементарная сера и различные серосодержащие соединения, из которых может быть получена сера или оксид серы (IV).
Природные залежи самородной серы невелики. Чаще всего сера находится в природе в форме сульфидов металлов и сульфатов металлов, а также входит в состав нефти, каменного угля, природного и попутного газов.
Значительные количества серы содержатся в виде оксида серы в топочных газах и газах цветной металлургии и в виде сероводорода, выделяющегося при очистке горючих газов.
Таким образом, сырьевые источники производства серной кислоты достаточно многообразны, хотя до сих пор в качестве сырья используют преимущественно элементарную серу и железный колчедан.
Ограниченное использование таких видов сырья, как топочные газы тепловых электростанций и газы медеплавильного производства, объясняется низкой концентрацией в них оксида серы (IV).
При этом доля колчедана в балансе сырья уменьшается, а доля серы возрастает.
Серный ангидрид и серная кислота
Серный ангидрид и серная кислота
Получение
Промышленный синтез h3SO4
В общей схеме сернокислотного производства существенное значение имеют две первые стадии – подготовка сырья и его сжигание или обжиг. Их содержание и аппаратурное оформление существенно зависят от природы сырья, которая в значительной степени, определяет сложность технологического производства серной кислоты.
Их содержание и аппаратурное оформление существенно зависят от природы сырья, которая в значительной степени, определяет сложность технологического производства серной кислоты.
Сырье: пирит, FeS2.
Обжиг пирита. Пирит подвергают обжигу. Специальные печи – печи кипящего слоя обладают высокой производительностью. В печь непрерывно ленточным транспортером подается измельченный пирит, а компрессорами вдувается воздух. Образующийся диоксид серы автоматически отводится для дальнейшей переработки. Заданный технологический режим (температура, подача воздуха и пирита) регулируется автоматически. Получающаяся газовая смесь содержит 1–15% SO2, остальное – воздух.
Побочный продукт, который образуется при обжиге пирита, Fe2O3 – так называемый огарок, оксид железа (III), поставляется на металлургический завод, а там из него путем восстановления получают железо (принцип комплексного использования сырья, безотходного интегрированного производства)
Серный ангидрид и серная кислота
Получение
Обжиг пирита
Уравнение реакции первой стадии:
4FeS2 + 11O2 → 2Fe2O3 + 8SO2 + Q
Измельчённый очищенный влажный (после флотации) пирит сверху засыпают в печь для обжига в «кипящем слое». Снизу (принцип противотока) пропускают воздух, обогащённый кислородом, для более полного обжига пирита. Температура в печи для обжига достигает 800°С. Пирит раскаляется до красна и находится в «подвешенном состоянии» из-за продуваемого снизу воздуха. Похоже это всё на кипящую жидкость раскалённо-красного цвета.
Снизу (принцип противотока) пропускают воздух, обогащённый кислородом, для более полного обжига пирита. Температура в печи для обжига достигает 800°С. Пирит раскаляется до красна и находится в «подвешенном состоянии» из-за продуваемого снизу воздуха. Похоже это всё на кипящую жидкость раскалённо-красного цвета.
За счёт выделяющейся теплоты в результате реакции поддерживается температура в печи.
Избыточное количество теплоты отводят: по периметру печи проходят трубы с водой, которая нагревается.
Горячую воду используют дальше для центрального отопления рядом стоящих помещений.
Серный ангидрид и серная кислота
Получение
Очистка сернистого газа. Для очистки SO2 пропускают через специальные башни, где его промывают 24%-й h3SO4 (так называемое орошение). На орошение газ поступает горячим (~300°С), поэтому разбавленная h3SO4 концентрируется (вследствие испарения воды), хотя и загрязняется примесями, содержащимися в SO2.
Сернистый газ, промытый разбавленной h3SO4, поступает на электрофильтры для освобождения от капелек воды и смоченных твердых примесей. После этого происходит осушение газовой смеси SO2 и О2 в башнях, здесь же идет и дополнительная очистка.
Контактное окисление сернистого газа. После того, как газ прошел все эти устройства, из 200–300 г пыли на 1 м3 газа в нем остается всего 10–20 г. Сухой очищенный газ (SO2 + О2) пропускают через раствор чистой h3SO4 и только после этого подают в контактный аппарат. Тщательная очистка газов необходима, чтобы не отравлять катализатор. В целях экономии электроэнергии смесь SO2 и О2 пропускают через теплообменник, где газ, идущий в контактный аппарат, проходит по внутренней трубе, а газ, выходящий из него и разогретый за счет экзоэффекта реакции окисления SO2 до SO3 – по внешней. Таким образом, смесь SO2 и О2, поступающая на катализ, предварительно нагревается отходящими газами, а на катализаторе за счет экзоэффекта газы окончательно разогреваются до 550°С.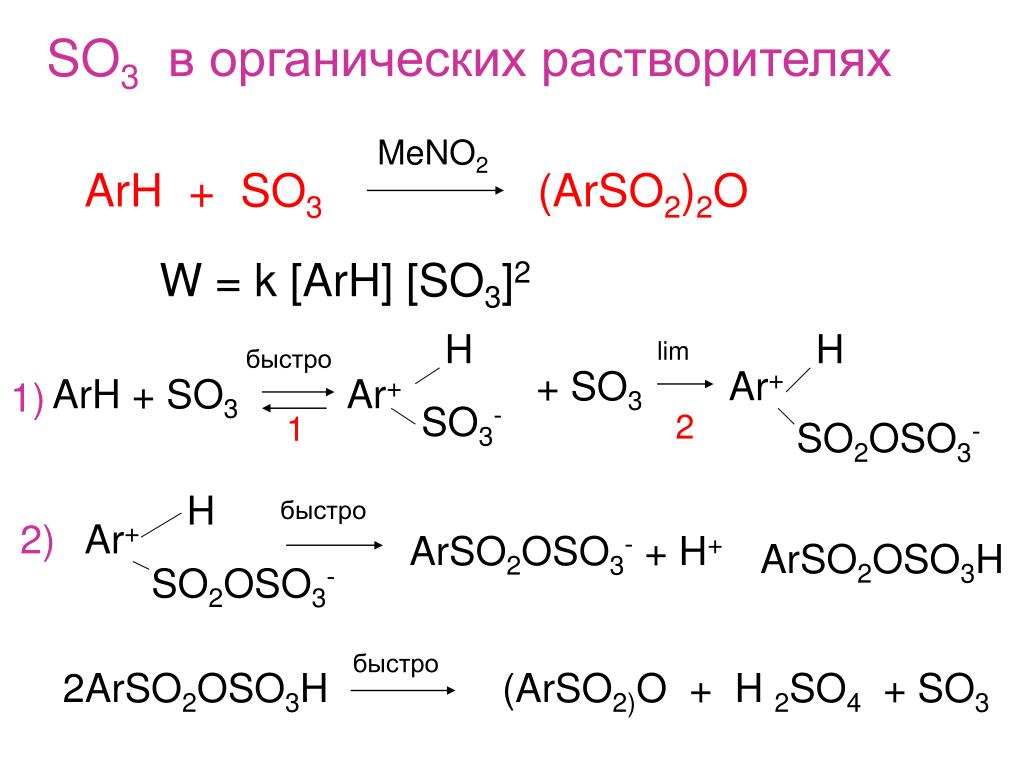
Серный ангидрид и серная кислота
Получение
Промышленный синтез h3SO4 включает стадию растворения серного ангидрида, полученного контактным способом, не в воде, а в серной кислоте: при этом образуется олеум.
Получившийся в контактном аппарате SO3 растворяют в h3SO4, а не в Н2О потому, что при растворении в воде из-за выделения очень большого количества энергии образуются устойчивые дымы – аэрозоли, т.е. теряется (в виде дыма h3SO4) много SO3.
При мольном соотношении h3SO4:SO3 = 1:1 образуются бесцветные кристаллы пиросерной кислоты, строение которой передает формула НО−SO2−О−SO2−ОН.
При взаимодействии с водой h3S2O7 дает 2 моль h3SO4.
Название «пиросерная» кислота объясняется просто: пиросульфаты – соли пиросерной кислоты можно получить пиролизом гидросульфатов («пирос» по-гречески «огонь»), например:
2NaHSO4 = Na2S2O7 + Н2О.
Соответствующая кислота и называется пиросерной, хотя сама она получается вовсе не при нагревании, а наоборот, при повышенной температуре она разлагается с выделением SO3.
Серный ангидрид и серная кислота
h3S2O7
Серный ангидрид и серная кислота
Серный ангидрид и серная кислота
Сульфур(VI) оксид і сульфатна кислота
Серный ангидрид и серная кислота
Серный ангидрид и серная кислота
Концентрированная h3SO4 проявляет свойства окислителя, восстанавливаясь обычно до сернистого газа. Примером может быть реакция
h3SO4 + h3S (ГAЗ) = S↓ + SO2 + 2Н2О.
Сера в этой реакции выделяется на поверхности пузырьков газа, если h3S барботируют через слой h3SO4 (реакция идет преимущественно в пленке). Образующаяся при этом пена – белая от содержащейся в ней серы, а жидкость – почти прозрачная.
Образующаяся при этом пена – белая от содержащейся в ней серы, а жидкость – почти прозрачная.
Концентрированная h3SO4 при комнатной температуре не взаимодействует с некоторыми металлами. Это позволяет перевозить кислоту (≥ 75%) в стальных цистернах.
При нагревании h3SO4 (КОНЦ) действует почти на все металлы до Ag включительно (кроме Pt, Au и некоторых других). В этом случае водород не выделяется, а образуются продукты восстановления S+6: SO2, h3S, S, а также соль и вода. Продукты зависят от активности металла и условий реакции (температура, концентрация h3SO4)
Серный ангидрид и серная кислота
Серный ангидрид и серная кислота
h3SO4 (конц., хол.) + NaOH = NaHSO4 + h3O.
h3SO4 (конц., хол.) + Nh4·h3O = Nh5HSO4 + h3O.
h3SO4 (конц.) + NaCl (т) = NaHSO4 + HCl↑ (30–50°C).
h3SO4 (конц.) + 2NaCl (т) = Na2SO4 + 2HCl↑ (кип. ).
).
h3SO4 (конц.) + Na2SO4 = 2NaHSO4 (40°C).
5h3SO4 (конц.) + 4Zn = 4ZnSO4 + h3S↑ + 4h3O (примеси S, SO2).
2h3SO4 (конц.) + Cu = CuSO4 + SO2↑ + 2h3O,
2h3SO4 (конц.) + 2Ag = Ag2SO4↓ + SO2↑ + 2h3O.
2h3SO4 (конц.) + 2Hg = Hg2SO4↓ + SO2↑ + 2h3O.
2h3SO4 (конц) + S = 3SO2↑ + 2h3O (кип).
2h3SO4 (конц.) + С (графит) = 2SO2↑ + CO2↑ + 2h3O.
3h3SO4 (конц.) + 2KВr (т) = SO2↑ + Br2 + 2h3O + 2KHSO4 (40–60°С, примесь S).
5h3SO4 (конц.) + 8KI (т) = h3S↑ + 4I2↓ + 4h3O + 4K2SO4 (кип., примеси S, SO2).
Серный ангидрид и серная кислота
Серный ангидрид и серная кислота
Разбавленная серная кислота не является окислителем за счет атома S+6, ведет себя как типичная кислота-неокислитель.
h3SO4 (разб.) + 2NaOH = Na2SO4 + 2h3O.
h3SO4 (разб., гор.) + 2(Nh4·h3O) = (Nh5)2SO4 + 2h3O.
h3SO4 (разб.) + CaO = CaSO4↓ + h3O,
h3SO4 (разб. ) + Ca(OH)2 = CaSO4↓ + 2h3O,
) + Ca(OH)2 = CaSO4↓ + 2h3O,
h3SO4 + Ba(NO2)2 = 2HNO2 + BaSO4↓.
h3SO4 (разб.) + Na2CO3 = Na2SO4 + CO2↑ + h3O,
h3SO4 (разб.) + CaCO3 = CaSO4↓ + CO2↑ + h3O.
h3SO4 (разб.) + Zn = ZnSO4 + h3↑.
Сульфур(VI) оксид і сульфатна кислота
Применение. Серную кислоту применяют в производстве минеральных удобрений, как электролит в свинцовых аккумуляторах, для получения различных минеральных кислот и солей, химических волокон, красителей, дымообразующих веществ и ВВ, в нефтяной, металлообрабатывающей, текстильной, кожевенной и др. отраслях промышленности. Ее используют в промышленном органическом синтезе в реакциях дегидратации (получение диэтилового эфира, сложных эфиров), гидратации (этанол из этилена), сульфирования (синтетические моющие средства и промежуточные продукты в производстве красителей), алкилирования (получение изооктана, полиэтиленгликоля, капролактама) и др.
Серная кислота – наиболее крупнотоннажный неорганический продукт, широко используемый в производстве. Объем производства и потребления серной кислоты в каждой стране определяет уровень развития как химической отрасли, так и всей промышленности в целом.
Объем производства и потребления серной кислоты в каждой стране определяет уровень развития как химической отрасли, так и всей промышленности в целом.
Самый крупный потребитель серной кислоты – производство минеральных удобрений. Поэтому сернокислотные заводы стремятся строить в комплексе с заводами по производству минеральных удобрений.
Серный ангидрид и серная кислота
Серная кислота и олеум – чрезвычайно агрессивные вещества, поражают дыхательные пути, кожу, слизистые оболочки, вызывают затруднение дыхания, кашель, нередко – ларингит, трахеит, бронхит и т.д. ПДК аэрозоля серной кислоты в воздухе рабочей зоны 1,0 мг/м3, в атм. воздухе 0,3 мг/м3 (макс. разовая) и 0,1 мг/м3 (среднесуточная).
Поражающая концентрация паров серной кислоты 0,008 мг/л (экспозиция 60 мин), смертельная 0,18 мг/л (60 мин).
Аэрозоль серной кислоты может образовываться в атмосфере в результате выбросов химических и металлургических производств, содержащих оксиды S, и выпадать в виде кислотных дождей.
Серный ангидрид и серная кислота
Дегидратирующие свойства – характерная черта h3SO4. Присоединение воды атомами серы серной кислоты происходит за счет неподеленных электронных пар атома кислорода Н2О и сопровождается большим выделением энергии.
Смешиваясь с водой в любых соотношениях, серная кислота образует многочисленные гидраты h3SO4·nh3O (n = 1÷6).
Твердые гидраты h3SO4·Н2O и h3SO4·2Н2O имеют ионное строение h4O+HSO4⎺ и (h4O+)2SO42− соответственно.
Сродство серной кислоты к воде так велико, что h3SO4 КОНЦ. может не только связывать «свободную» воду, но и отнимать се от сложных соединений, например, от углеводов. Так, если в концентрированную h3SO4 опустить лучинку клетчатка (С10Н22О5), то она почернеет: выделяется «свободный» углерод из-за обезвоживания древесины.
Аналогично протекает взаимодействие с h3SO4(КОНЦ) другого углевода – сахарозы (С12Н22О11).
С12Н22О11 + h3SO4 → С + h3SO4·nh3O
Серный ангидрид и серная кислота
Серный ангидрид и серная кислота
Серная кислота в природе
Мельчайшие капельки серной кислоты могут образовываться в средних и верхних слоях атмосферы в результате реакции водяного пара и вулканического пепла, содержащего большие количества серы. Получившаяся взвесь, из-за высокого альбедо облаков серной кислоты, затрудняет доступ солнечных лучей к поверхности планеты. Поэтому (а также в результате большого количества мельчайших частиц вулканического пепла в верхних слоях атмосферы, также затрудняющих доступ солнечному свету к планете) после особо сильных вулканических извержений могут произойти значительные изменения климата.
Получившаяся взвесь, из-за высокого альбедо облаков серной кислоты, затрудняет доступ солнечных лучей к поверхности планеты. Поэтому (а также в результате большого количества мельчайших частиц вулканического пепла в верхних слоях атмосферы, также затрудняющих доступ солнечному свету к планете) после особо сильных вулканических извержений могут произойти значительные изменения климата.
Например, в результате извержения вулкана Ксудач (п-ов Камчатка, 1907 г.) повышенная концентрация пыли в атмосфере держалась около 2 лет, а характерные серебристые облака серной кислоты наблюдались даже в Париже.
Взрыв вулкана Пинатубо в 1991 году, отправивший в атмосферу 3·107 тонн серы, привёл к тому, что 1992 и 1993 года были значительно холоднее, чем 1991 и 1994.
Облака серной кислоты, предположительно, составляют значительную часть облачного покрова Венеры.
Серный ангидрид и серная кислота
Скачать презентацию
Оксид серы( VI ).
 Серная кислота презентация, доклад, проект
Серная кислота презентация, доклад, проектОксид серы(VI). Серная кислота
Оксид серы (VI)(Серный ангидрид)
молекулярная формула SО3
степень окисления серы (+6).
Ковалентная полярная связь
Молекулярная кристаллическая решетка
Оксид серы (VI) SО3 — ангидрид серной кислоты
бесцветная жидкость
На воздухе «дымит», сильно поглощает влагу
Tпл = 16,8 °С;
Tкип = 45°С
SО3 получают окислением SО2 только в присутствии катализатора (Рt или V2О5) и высоком давлении
р
2SO2 + O2 → 2SO3+ Q
Химические свойства кислотных оксидов
ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТНЫХ ОКСИДОВ
1. Кислотный оксид +Вода= Кислота
2. Кислотный оксид + Основание = Соль + Н2О
3. Основной оксид + Кислотный оксид = Соль
Основной оксид + Кислотный оксид = Соль
Химические свойства оксида серы (VI)
1)При растворении в воде дает сильную двухосновную серную кислоту:
Кислотный оксид +Вода= Кислота
SO3 + h3O = h3SO4
Диссоциация протекает ступенчато:
2) Взаимодействие со щелочами
Кислотный оксид + Щелочь = Соль + Н2О
2NaOH + SO3 → Na2SO4 + h3O
NaOH + SO3 (избыток) → NaHSO4
SO3 + 2KOH = K2SO4 + h3O
SO3 + 2OH — = SO42- + h3O
3) Взаимодействие с основными оксидами
Основной оксид + Кислотный оксид = Соль
Na2O + SO3 → Na2SO4
СaO + SO3 = CaSO4
SO3 — сильный окислитель.
СЕРНАЯ КИСЛОТА — h3SO4
Тяжелая маслянистая жидкость
хорошо растворима в воде – с сильным нагревом;
t°пл. = 10,3°C,
t°кип. = 296°С,
Кислоту вливать малыми порциями в воду, а не наоборот!
Помните!
Химические свойства разбавленной серной кислоты
h3SO4 — сильная двухосновная кислота, водный раствор изменяет окраску индикаторов (лакмус и универсальный индикатор краснеют)
1) Диссоциация протекает ступенчато:
2)Взаимодействие с металлами:
Разбавленная серная кислота растворяет только металлы, стоящие в ряду напряжений левее водорода:
Мg0 + h3+1SO4(разб) → Mg+2SO4 + h30↑
Mg0 + 2H+ → Mg2+ + h30↑
3) Взаимодействие с основными и амфотерными оксидами:
ZnO + h3SO4 → ZnSO4 + h3O
ZnO + 2H+ → Zn2+ + h3O
4) Взаимодействие с основаниями:
h3SO4 + 2NaOH → Na2SO4 + 2h3O (реакция нейтрализации)
H+ + OH- → h3O
Если кислота в избытке, то образуется кислая соль:
h3SO4 + NaOH → NaНSO4 + h3O
h3SO4 + Cu(OH)2 → CuSO4 + 2h3O
2H+ + Cu(OH)2 → Cu2+ + 2h3O
5) Обменные реакции с солями:
образование газа — как сильная нелетучая кислота серная вытесняет из солей другие менее сильные кислоты, например, угольную
K2CO3 + h3SO4 → K2SO4 + h3O + CO2↑
CO32- + 2H+ → h3O + CO2↑
образование осадка
BaCl2 + h3SO4 → BaSO4↓ + 2HCl
Ba2+ + SO42- → BaSO4↓
Качественная реакция на сульфат-ион:
Образование белого осадка BaSO4 (нерастворимого в кислотах) используется для идентификации серной кислоты и растворимых сульфатов.
Ва2+ + SO42- = ВаSО4↓.
Значение серной кислоты.
Серная кислота является важнейшим продуктом основной химической промышленности, занимающейся производством неорганических кислот, щелочей, солей минеральных удобрений и хлора.
По разнообразию применения серная кислота занимает первое место среди кислот. Наибольшее количество ее расходуется для получения фосфорных и азотных удобрений. Будучи нелетучей кислотой, серная кислота используется для получения других кислот — соляной, плавиковой, фосфорной, уксусной и т. д. Много ее идет для очистки нефтепродуктов — бензина, керосина и смазочных масел — от вредных примесей. В машиностроении серной кислотой очищают поверхность металла от оксидов перед покрытием (никелированием, хромированием и др.). Серная кислота применяется в производстве взрывчатых веществ, искусственного волокна, красителей, пластмасс и многих других. Ее употребляют для заливки аккумуляторов. В сельском хозяйстве она используется для борьбы с сорняками (гербицид).
В сельском хозяйстве она используется для борьбы с сорняками (гербицид).
Соли серной кислоты.
Железный купорос FеSО4•7Н2O применяли раньше для лечения чесотки, гельминтоза и опухолей желез, в настоящее время используют для борьбы с сельскохозяйственными вредителями.
Медный купорос CuSO4•5Н2O широко используют в сельском хозяйстве для борьбы с вредителями растений.
«Глауберова соль» (мирабилит) Nа2SO4•10Н2O была получена немецким химиком И. Р. Глаубером при действии серной кислоты на хлорид натрия, в медицине ее используют как слабительное средство.
Гипс СаSO4•2Н2O находит широкое применение в строительном деле, в медицинской практике для накладывания гипсовых повязок, для изготовления гипсовых скульптур.
Токсическое действие
Серная кислота и олеум — очень едкие вещества. Они поражают кожу, слизистые оболочки, дыхательные пути (вызывают химические ожоги). При вдыхании паров этих веществ они вызывают затруднение дыхания, кашель, нередко — ларингит, трахеит, бронхит и т. д.
При вдыхании паров этих веществ они вызывают затруднение дыхания, кашель, нередко — ларингит, трахеит, бронхит и т. д.
Аэрозоль серной кислоты может образовываться в атмосфере в результате выбросов химических и металлургических производств, содержащих оксиды серы, и выпадать в виде кислотных дождей.
При наличии в атмосфере аэрозоля h3SO4, при выпадении кислотных дождей листовые пластинки растений, произрастающих в 1—2 км от предприятия, обычно бывают густо усеяны мелкими некротическими пятнами, образовавшимися в местах оседания капель.
Охрана окружающей среды. Охране окружающей среды в нашей стране уделяется большое внимание. На сернокислотных заводах предотвратить загрязнение окружающей среды удается путем герметизации аппаратуры, применением газоочистительных установок.
Если произошло отравление газами, пострадавшего следует вынести на свежий воздух или использовать воздух, обогащенный кислородом, и дать для приема внутрь разбавленный раствор питьевой соды NaНСО3.
Если все же серная кислота попадет на тело, то места кожных поражений следует немедленно обмыть большим количеством воды, продолжительность обмывания 10—15 мин.
Избегать применения щелочных растворов, которые при реакции с h3SO4 выделяют тепло и могут усугубить тяжесть поражения.
Осуществите превращения по схеме:
S—SO2—SO3—h3SO4— Na2SO4
Zn – ZnSO4– Zn(OH) 2—ZnSO4—BaSO4
Скачать презентацию
Разница между SO2 и SO3
Основное отличие — SO
2 против SO 3 SO 2 и SO 3 представляют собой неорганические химические соединения, образованные комбинацией атомов серы и атомов кислорода. SO 2 означает диоксид серы , а SO 3 означает триоксид серы . Это газообразные соединения. Они имеют разные химические и физические свойства. Эти соединения называются оксидами серы, так как они образуются в результате реакции между серой и O 2 молекул.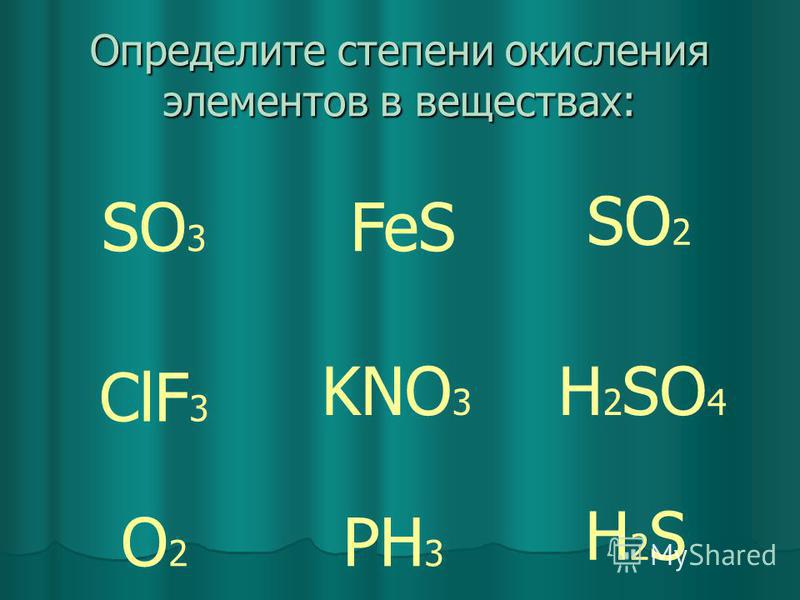 Основное различие между SO 2 и SO 3 заключается в том, что SO 2 имеет два атома кислорода, связанных с атомом серы, тогда как SO 3 имеет три атома кислорода, связанные с атомом серы.
Основное различие между SO 2 и SO 3 заключается в том, что SO 2 имеет два атома кислорода, связанных с атомом серы, тогда как SO 3 имеет три атома кислорода, связанные с атомом серы.
Ключевые области, охватываемые
1. Что такое SO2
— Определение, химическая структура и свойства, Состояние окисления
2. Что является SO3
— Определение, Химическая структура и свойства, Sulfuric Aisk Aciduic Product0041
3. В чем разница между SO2 и SO3
– Сравнение основных различий
Ключевые термины: кислотный дождь, неподеленная электронная пара, кислород, степень окисления, сера, диоксид серы, триоксид серы, триоксид серы
Что такое SO
2 SO 2 означает двуокись серы . Диоксид серы представляет собой газообразное соединение, состоящее из атомов серы и кислорода. Химическая формула диоксида серы: SO 2 . Следовательно, он состоит из атома серы, связанного с двумя атомами кислорода через ковалентные связи. Один атом кислорода может образовывать двойную связь с атомом серы. Следовательно, атом серы является центральным атомом соединения. Поскольку элемент серы имеет 6 электронов на своей внешней орбитали после образования двух двойных связей с атомами кислорода, остается еще 2 электрона; они могут действовать как неподеленная электронная пара. Это определяет геометрию молекулы SO 2 как угловую геометрию. ТАК 2 является полярным из-за своей геометрии (угловой) и наличия неподеленной электронной пары.
Химическая формула диоксида серы: SO 2 . Следовательно, он состоит из атома серы, связанного с двумя атомами кислорода через ковалентные связи. Один атом кислорода может образовывать двойную связь с атомом серы. Следовательно, атом серы является центральным атомом соединения. Поскольку элемент серы имеет 6 электронов на своей внешней орбитали после образования двух двойных связей с атомами кислорода, остается еще 2 электрона; они могут действовать как неподеленная электронная пара. Это определяет геометрию молекулы SO 2 как угловую геометрию. ТАК 2 является полярным из-за своей геометрии (угловой) и наличия неподеленной электронной пары.
Рисунок 1: Химическая структура SO2
Диоксид серы считается токсичным газом. Следовательно, наличие в атмосфере SO 2 будет свидетельствовать о загрязнении воздуха. Этот газ имеет очень раздражающий запах. Молекулярная масса диоксида серы составляет 64 г/моль. Это бесцветный газ при комнатной температуре. Температура плавления составляет около -71 o C, тогда как температура кипения составляет -10 o C.
Температура плавления составляет около -71 o C, тогда как температура кипения составляет -10 o C.
Степень окисления серы в диоксиде серы +4. Следовательно, двуокись серы также может быть получена восстановлением соединений, состоящих из атомов серы, находящихся в более высокой степени окисления. Одним из таких примеров является реакция между медью и серной кислотой. Здесь сера в серной кислоте находится в степени окисления +6. Следовательно, его можно восстановить до +4 степени окисления диоксида серы.
Диоксид серы может использоваться в производстве серной кислоты, которая имеет ряд применений в промышленных и лабораторных масштабах. Двуокись серы также является хорошим восстановителем. Поскольку степень окисления серы составляет +4 в диоксиде серы, ее можно легко окислить до степени окисления +6, что позволяет восстановить другое соединение.
Что такое SO
3 SO 3 означает трехокись серы. Триоксид серы представляет собой твердое соединение, состоящее из одного атома серы, связанного с тремя атомами кислорода. Химическая формула диоксида серы: SO 3 . Каждый кислород образовал двойную связь с атомом серы. Атом серы находится в центре молекулы. Поскольку сера имеет 6 электронов на своей внешней орбитали, после образования трех двойных связей с атомами кислорода на атоме серы больше не остается электронов. Это определяет геометрию SO 3 молекула в виде тригональной плоской геометрии. SO 3 неполярен из-за своей геометрии (тригонально-плоской) и отсутствия неподеленной электронной пары.
Химическая формула диоксида серы: SO 3 . Каждый кислород образовал двойную связь с атомом серы. Атом серы находится в центре молекулы. Поскольку сера имеет 6 электронов на своей внешней орбитали, после образования трех двойных связей с атомами кислорода на атоме серы больше не остается электронов. Это определяет геометрию SO 3 молекула в виде тригональной плоской геометрии. SO 3 неполярен из-за своей геометрии (тригонально-плоской) и отсутствия неподеленной электронной пары.
Рисунок 2: Химическая структура SO3
Молекулярная масса триоксида серы составляет 80,057 г/моль. Температура плавления SO 3 составляет около 16,9°C, тогда как температура кипения составляет 45 o °C. При комнатной температуре и давлении триоксид серы представляет собой белое кристаллическое твердое соединение, которое будет дымиться на воздухе. Имеет резкий запах. Степень окисления серы в триоксиде серы +6.
В газообразной форме триоксид серы загрязняет воздух и является основным компонентом кислотных дождей. Однако триоксид серы очень важен для производства серной кислоты в промышленных масштабах. Это связано с тем, что триоксид серы представляет собой ангидридную форму серной кислоты.
Однако триоксид серы очень важен для производства серной кислоты в промышленных масштабах. Это связано с тем, что триоксид серы представляет собой ангидридную форму серной кислоты.
SO 3(л) + H 2 O (л) → H 2 SO 4(л) 90 Поэтому при использовании триоксида серы для промышленного производства серной кислоты следует использовать методы контроля. Кроме того, триоксид серы является важным реагентом в процессе сульфирования.
Разница между SO
2 и SO 3Определение
SO 2 : SO 2 обозначает двуокись серы.
SO 3 : SO 3 означает трехокись серы.
Природа
SO 2 : SO 2 представляет собой газообразное соединение, состоящее из атомов серы и кислорода.
SO 3 : SO 3 представляет собой твердое соединение, состоящее из одного атома серы, связанного с тремя атомами кислорода.
Молярная масса
SO 2 : Молярная масса SO 2 составляет 64 г/моль.
SO 3 : Молярная масса SO 3 составляет 80,057 г/моль.
Температура плавления и кипения
SO 2 : Температура плавления SO 2 составляет примерно -71°C, тогда как температура кипения составляет -10°C.
SO 3 : Температура плавления SO 3 составляет около 16,9 °C, тогда как температура кипения составляет 45 °C.
Степень окисления
SO 2 : Степень окисления серы в SO 2 равна +4.
SO 3 : Степень окисления серы в SO 3 равна +6.
Окисление
SO 2 : SO 2 может подвергаться дальнейшему окислению.
SO 3 : SO 3 не подвергается дальнейшему окислению.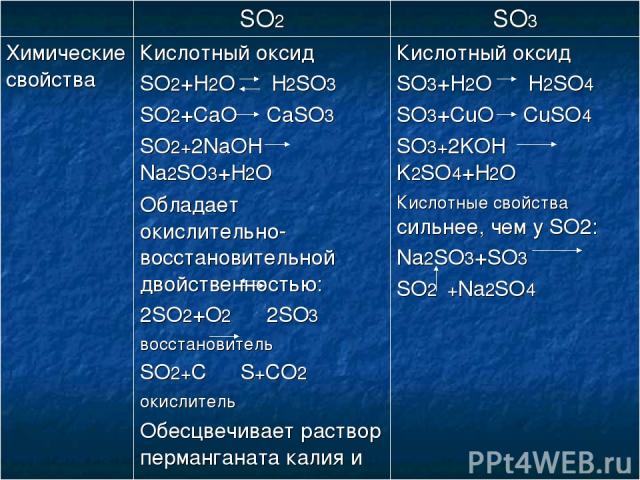
Полярность
SO 2 : SO 2 является полярным из-за своей геометрии (угловой) и наличия неподеленной электронной пары.
SO 3 : SO 3 является неполярным из-за своей геометрии (тригонально-плоской) и отсутствия неподеленной электронной пары.
Заключение
SO 2 и SO 3 представляют собой неорганические соединения, называемые оксидами серы. SO 2 представляет собой газообразное соединение при комнатной температуре. SO 3 представляет собой твердое (кристаллическое) соединение при комнатной температуре. Основное отличие SO 2 и SO 3 заключается в том, что SO 2 имеет два атома кислорода, связанных с атомом серы, тогда как SO 3 имеет три атома кислорода, связанные с атомом серы.
Ссылка:
1. «Сернистый газ». Википедия, Фонд Викимедиа, 3 января 2018 г.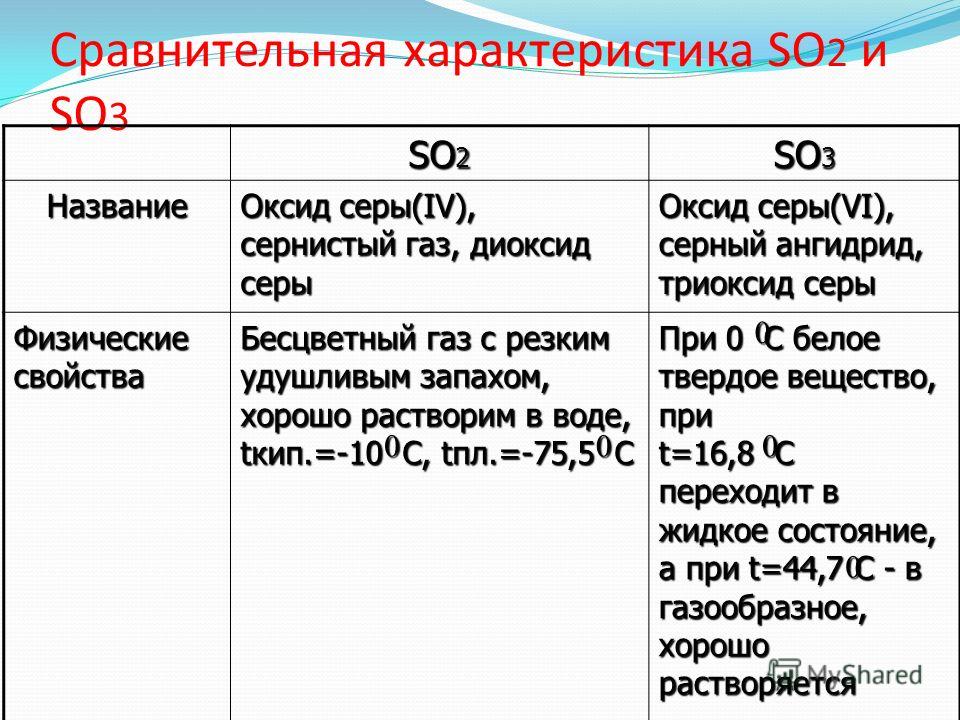 , доступно здесь.
, доступно здесь.
2. «ТРИОКСИД СЕРЫ». Национальный центр биотехнологической информации. База данных соединений PubChem, Национальная медицинская библиотека США, доступна здесь.
3. «Объяснение молекулярной геометрии SO3, структуры Льюиса и полярности». Геометрия молекул, 21 июля 2017 г., доступно здесь.
Изображение предоставлено:
1. «Диоксид серы-ve-B-2D» Бена Миллса — собственная работа (общественное достояние) через Commons Wikimedia
2. «Триоксид серы SO3» Икразуул — собственная работа (общественное достояние) через Commons Wikimedia
SO3 Молекулярная геометрия, структура Льюиса и объяснение полярности
SO3 означает триоксид серы. Это одно из самых загрязняющих химических соединений в газообразной форме. Он также является основным агентом кислотных дождей. Основным применением этого компонента является производство серной кислоты для промышленных целей.
SO3, который также иногда называют триоксидом серы, представляет собой тригональную плоскую молекулу, которая не воспламеняется. В этой статье я предоставлю вам некоторую информацию о молекулярной геометрии SO3 с объяснениями структуры Льюиса, полярности и гибридизации.
В этой статье я предоставлю вам некоторую информацию о молекулярной геометрии SO3 с объяснениями структуры Льюиса, полярности и гибридизации.
Содержание
Триоксид серы Молекулярная геометрияБудучи умным и опытным человеком, вы должны знать, что такое молекулярная геометрия , но позвольте мне пересмотреть ее для всех молодых студентов. Молекулярная геометрия — это трехмерная структура атомов, которая помогает в строении молекулы. Он может определять реактивность, полярность, цвет, притяжение, биологическую активность и т. д.
SO3 состоит в основном из двух компонентов – серы и кислорода. Есть один атом серы и три атома кислорода, которые разбросаны так далеко, как только могут! Атомы кислорода окружены электронами. Эти электроны отрицательны и отталкивают друг друга.
Вы также можете запомнить его по AXN. Где;
- A обозначает серу, которая является центральным атомом
- X обозначает число атомов, связанных с центральным атомом серы
- N обозначает любые несвязывающих электронных пар
В этой формуле SO3 у нас нет ни одного несвязывающего электрона, и поэтому мы не беспокоимся о N. Более того, поскольку кислорода три, это будет X3.
Более того, поскольку кислорода три, это будет X3.
Это означает, что у нас есть AX3 для молекулы SO3. (Кстати, именно поэтому SO3 имеет форму тригональной плоскости.) Валентный угол SO3 составляет 120 градусов.
Структура Льюиса SO 3Валентность: здесь сера в центре из-за ее самой низкой электронной емкости и три кислорода вокруг нее. Сера приносит 6, а кислород приносит 3 каждый. Это означает; SO3 имеет 24 валентных электрона. 6 + (3 х 6) = 24,
Теперь еще раз взгляните на структуру Льюиса;
Когда мы его рисуем, сначала мы получаем три структуры вверху. Сера в центре и кислород вокруг него соединяются (каждый) с центральным атомом. Сначала должны быть одинарные связи.
В построенной нами структуре 6 электронов, а всего их 24. Итак, нам нужно положить 18 электронов вниз. Теперь заполните внешние атомы так, чтобы они удовлетворяли правилу октетов.
Выглядит так;
Подсказка: Когда их поставите, начните считать от 7 до 24.
Затем примите решение относительно формального обвинения. Формальный заряд поможет вам выяснить, каким атомам не нужны электроны.
Это нет. электронов, которые принес атом (например, кислород приносит 6) минус нет. электронов, которые являются одинокими, то есть неподеленными парами вокруг атома минус половина числа электронов в связях.
Если вы хотите узнать, используйте эту формулу, чтобы сделать ее простой;
Формула: Валентные электроны – Точки – Количество линий = ‘?’
Если мы говорим о Сере, то будет 6 – 0 – 3 = +3.
Вот в данном случае для кислорода имеем 6 (кислород) – 6 (точки) – 1 (связи) = –1.
Итак, –1 из двух других кислорода, потому что все одинаковые!
Сера может обрабатывать 12 электронов на атом. Теперь выньте по 2 точки из каждого кислорода и поставьте на каждую еще по одной связи связи.
Теперь это будет выглядеть так;
Итак, как вы видите, теперь вокруг него 10 электронов. Сера нарушает правило октета. И причина в том, что все формальные заряды становятся равными 0. Итак, если вы, наконец, пересчитаете вещи, это будет похоже на 6 — 0 — 6 = 0. Я надеюсь, что вы, ребята, ясно представляете себе структуру Льюиса SO3. Теперь поговорим о полярности.
Сера нарушает правило октета. И причина в том, что все формальные заряды становятся равными 0. Итак, если вы, наконец, пересчитаете вещи, это будет похоже на 6 — 0 — 6 = 0. Я надеюсь, что вы, ребята, ясно представляете себе структуру Льюиса SO3. Теперь поговорим о полярности.
У многих студентов возникает вопрос – SO3 полярен или неполярен? У некоторых профессионалов такая же путаница. Вот ответ в самом простом объяснении…
SO3 НЕПОЛЯРНЫЙ.
В этой формуле все атомы кислорода симметричны. Все они имеют одинаковое количество связей и неподеленных пар электронов . Теперь, если мы воспользуемся моделью, называемой VSEPR (отталкивание электронных пар валентной оболочки — модель, основанная на отталкивающем поведении электронных пар), мы обнаружим, что, поскольку весь кислород рассредоточен, они отталкивают друг друга, что, как ожидается, SO3 как неполярный.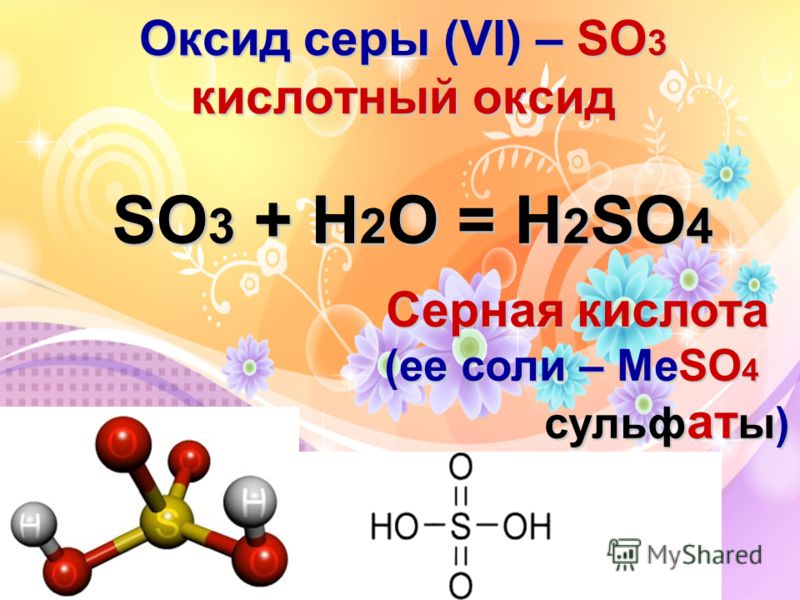
Итак, с этого момента, когда кто-то будет задавать вам вопрос, например, является ли SO3 полярным? Вы должны уверенно ответить, НЕТ, это не так, потому что они не имеют ни отрицательных, ни положительных признаков. Он тригонально-плоский с симметричным распределением заряда на центральном атоме.
SO 3 ГибридизацияКак видно из структуры; между каждым атомом у нас есть двойные связи. Одна из них представляет собой сигма-связь (σ), а другая — пи-связь (π). Чтобы узнать гибридизацию SO3, мы должны найти стерическое число. Формула стерического числа представляет собой сложение числа связанных атомов и неподеленных пар электронов.
Есть 3 сигма-связи, что означает, что у нас есть три области. Одна сигма-связь и две пары несвязанных электронов. Это означает, что у нас есть S- и две P-орбитали, которые нужно гибридизовать. В этом случае стерическое число равно 3, поэтому гибридизация SO3 равна 9.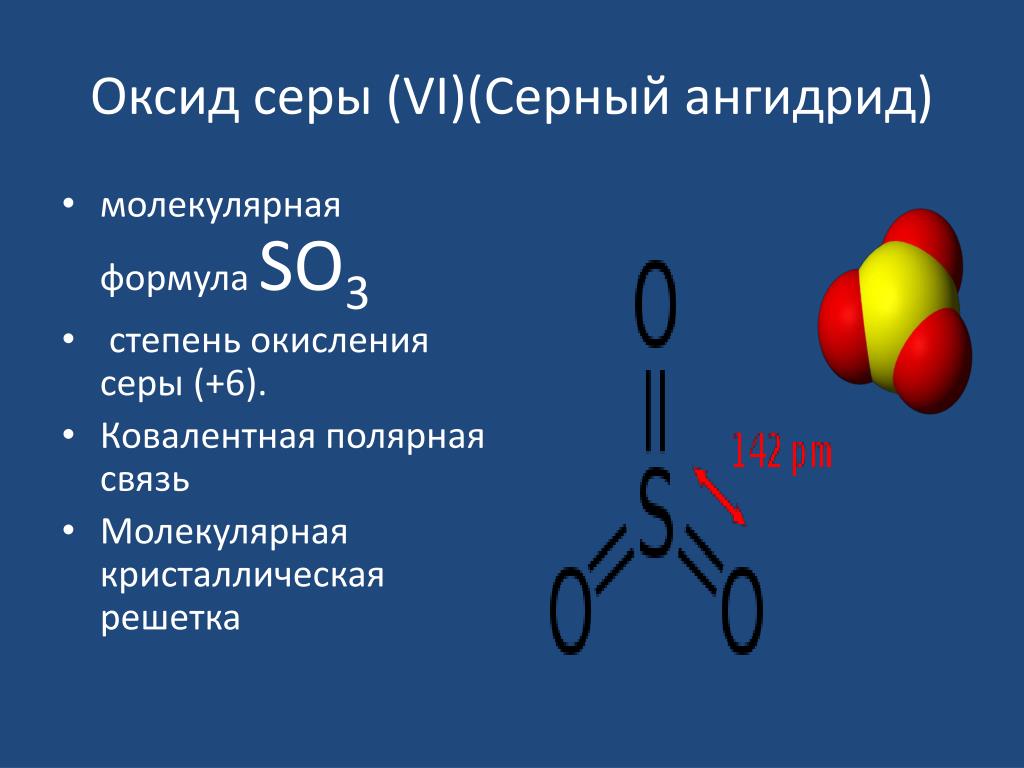 0307 СП 2 .
0307 СП 2 .
Всё!!! Это самое простое объяснение электронной геометрии SO3. Я надеюсь, что эта статья будет полезна для вас всякий раз, когда вам понадобится какое-либо руководство или помощь в разрешении путаницы в отношении молекулярной геометрии SO3. Напоследок я просто хочу сказать — никогда не переставайте учиться, потому что любознательность — ключ к успеху. Все самое лучшее!
Разница между SO2 и SO3
Основное различие между SO2 и SO3 заключается в том, что SO 2 представляет собой бесцветный газ при комнатной температуре, тогда как SO 3 представляет собой бесцветное или белое кристаллическое твердое вещество .
SO 2 представляет собой диоксид серы, а SO 3 представляет собой триоксид серы. Оба являются оксидами серы.
СОДЕРЖАНИЕ
1. Обзор и ключевые отличия
2. Что такое SO2
3. Что такое SO3
4. Прямые сравнения — SO2 и SO3 в табличной форме
5. Резюме
Резюме
Что такое SO2?
SO 2 – диоксид серы. Это бесцветное газообразное соединение, содержащее атомы серы и кислорода. ТАК 2 — химическая формула этого соединения. Следовательно, он содержит атом серы, связанный с двумя атомами кислорода ковалентными связями. Один атом кислорода может образовывать двойную связь с атомом серы. Следовательно, атом серы является центральным атомом соединения. Атом серы имеет 6 электронов на внешней орбитали. Следовательно, после образования двух двойных связей с атомами кислорода остается еще два электрона; эти электроны существуют как неподеленная электронная пара.
Отсюда мы можем определить геометрию SO 2 молекула; это угловая геометрия. SO 2 является полярным из-за своей геометрии (угловой) и наличия неподеленной электронной пары.
Рисунок 01: Структура диоксида серы
Диоксид серы считается токсичным газом. Следовательно, если в атмосфере есть SO2, это будет свидетельствовать о загрязнении воздуха.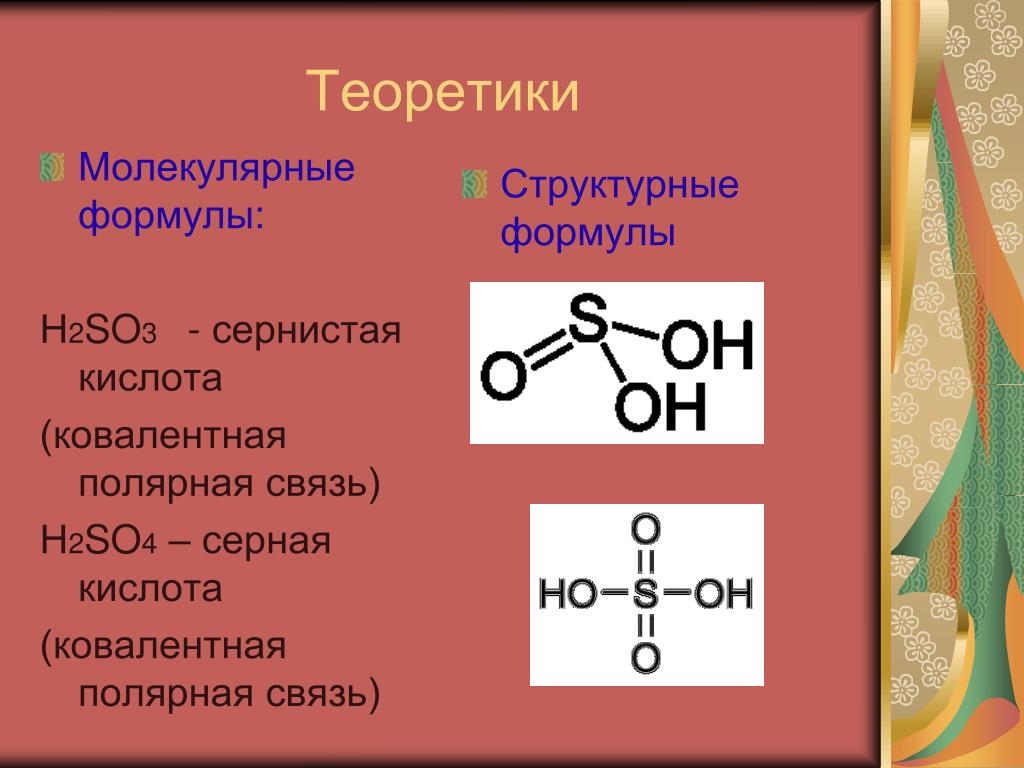 Кроме того, этот газ имеет очень раздражающий запах. Молекулярная масса диоксида серы составляет 64 г/моль. Это бесцветный газ при комнатной температуре. Температура плавления составляет около -71°C, тогда как температура кипения составляет -10°C.
Кроме того, этот газ имеет очень раздражающий запах. Молекулярная масса диоксида серы составляет 64 г/моль. Это бесцветный газ при комнатной температуре. Температура плавления составляет около -71°C, тогда как температура кипения составляет -10°C.
Степень окисления серы в диоксиде серы составляет +4. Следовательно, двуокись серы также может быть получена восстановлением соединений, состоящих из атомов серы, находящихся в более высокой степени окисления. Одним из таких примеров является реакция между медью и серной кислотой. Здесь сера в серной кислоте находится в степени окисления +6. Следовательно, его можно восстановить до степени окисления +4 диоксида серы.
Диоксид серы может использоваться в производстве серной кислоты, которая имеет ряд применений в промышленных и лабораторных масштабах. Диоксид серы также является хорошим восстановителем. Поскольку степень окисления серы составляет +4 в диоксиде серы, ее можно легко окислить до степени окисления +6, что позволяет восстановить другое соединение.
Что такое SO3?
SO 3 представляет собой триоксид серы. Это твердое соединение, содержащее один атом серы, который связывается с тремя атомами кислорода. SO 3 — это химическая формула этого соединения. Здесь каждый атом кислорода имеет двойную связь с атомом серы. Атом серы находится в центре молекулы. Атом серы имеет 6 электронов на внешней орбитали. Следовательно, после образования трех двойных связей с атомами кислорода на атоме серы больше не остается электронов, как в диоксиде серы. Таким образом, это определяет геометрию SO 3 молекула; он имеет тригональную плоскую геометрию. SO 3 является неполярным из-за своей геометрии (тригонально-плоской) и отсутствия неподеленной электронной пары.
Рисунок 02: Геометрия триоксида серы
Молекулярная масса триоксида серы составляет 80,057 г/моль. Температура плавления SO 3 составляет около 16,9 °C, тогда как температура кипения составляет 45°C. При комнатной температуре и давлении триоксид серы представляет собой белое кристаллическое твердое соединение, которое будет дымить на воздухе. Имеет резкий запах. Степень окисления серы в триоксиде серы +6.
При комнатной температуре и давлении триоксид серы представляет собой белое кристаллическое твердое соединение, которое будет дымить на воздухе. Имеет резкий запах. Степень окисления серы в триоксиде серы +6.
В газообразной форме триоксид серы загрязняет воздух и является основным компонентом кислотных дождей. Однако триоксид серы очень важен при производстве серной кислоты в промышленных масштабах. Это связано с тем, что триоксид серы представляет собой ангидридную форму серной кислоты.
SO 3(l) + H 2 O (l) → H 2 SO 4(l) Поэтому при использовании триоксида серы для промышленного производства серной кислоты следует использовать методы контроля. Кроме того, триоксид серы является важным реагентом в процессе сульфирования.
В чем разница между SO2 и SO3?
SO 2 представляет собой диоксид серы, а SO 3 представляет собой триоксид серы. Оба являются оксидами серы. Основное различие между SO2 и SO3 заключается в том, что SO 2 представляет собой бесцветный газ при комнатной температуре, тогда как SO 3 представляет собой кристаллическое твердое вещество от бесцветного до белого цвета. Кроме того, степень окисления серы в диоксиде серы +4, а в триоксиде серы +6. Из-за наличия неподеленной электронной пары и их геометрии диоксид серы является полярным соединением, а триоксид серы — неполярным соединением. Следующая инфографика суммирует разницу между SO2 и SO3.
Основное различие между SO2 и SO3 заключается в том, что SO 2 представляет собой бесцветный газ при комнатной температуре, тогда как SO 3 представляет собой кристаллическое твердое вещество от бесцветного до белого цвета. Кроме того, степень окисления серы в диоксиде серы +4, а в триоксиде серы +6. Из-за наличия неподеленной электронной пары и их геометрии диоксид серы является полярным соединением, а триоксид серы — неполярным соединением. Следующая инфографика суммирует разницу между SO2 и SO3.
Резюме — SO2 по сравнению с SO3
SO 2 — диоксид серы, а SO 3 — триоксид серы. Оба являются оксидами серы. Основное различие между SO2 и SO3 заключается в том, что SO 2 представляет собой бесцветный газ при комнатной температуре, тогда как SO 3 представляет собой кристаллическое твердое вещество от бесцветного до белого цвета.
Ссылка:
1. Brandt, Malcolm J., et al. «Хранение, дозирование и контроль химических веществ».
