Амины — что это? | Химтраст
-
О компании
- О компании
- Дилерская политика
- Вакансии
- Новости
- Отзывы
- Сертификаты
- Благотворительность
- Специальная оценка условий труда
- Каталог
- Скидки
-
Покупателям
- Калькулятор
- Правила оплаты
- Контакты дилеров
-
Услуги
- Теплоизоляция
- Гидроизоляция
- Огнезащита
- Укладка резиновой крошки
- Заливка наливных полов
- Фотоотчеты
-
База знаний
- Статьи
- Альбом решений
- Видео
- Вопросы и ответы
- Энциклопедия
-
Обучение
- Курс напыленщиков
- Курс по работе с оборудованием PROTON
- Контакты
Каталог
Калькулятор напылёнщика
Рассчитайте толщину напыления и объем компонентов ППУ
перейти к калькулятору
Аминами называются органические производные аммиака, в котором один, два или все три атома водорода замещены на углеводородные радикалы (предельные, непредельные, ароматические). Название аминов производят от названия углеводородного радикала с добавлением окончания –амин или от названия соответствующего углеводорода с приставкой амино-.
Название аминов производят от названия углеводородного радикала с добавлением окончания –амин или от названия соответствующего углеводорода с приставкой амино-.
Примеры:
- Ch4 – Nh3 — метиламин;
- Ch4 – NH – C2H5 — метилэтиламин.
фениламин (анилин)
В зависимости от числа атомов водорода, замещенных в аммиаке на углеводородные радикалы, различают первичные, вторичные и третичные амины:
- первичный амин: R – Nh3
- вторичный амин: R – NH – R’
- третичный амин: R – N – R”
Где R, R’, R’’ – углеводородные радикалы.
Первичные, вторичные и третичные амины можно получить, проводя алкилирование (введение алкильного радикала) аммиака. При этом происходит постепенное замещение атомов водорода аммиака на радикалы, и образуется смесь аминов:
- Nh4 + Ch4I — Ch4Nh3 + HI
- Ch4Nh3 + Ch4I — (Ch4)2NH + HI
- (Ch4)2NH + Ch4I — (Ch4)2N + HI
Обычно в смеси аминов преобладает один из них в зависимости от соотношения исходных веществ.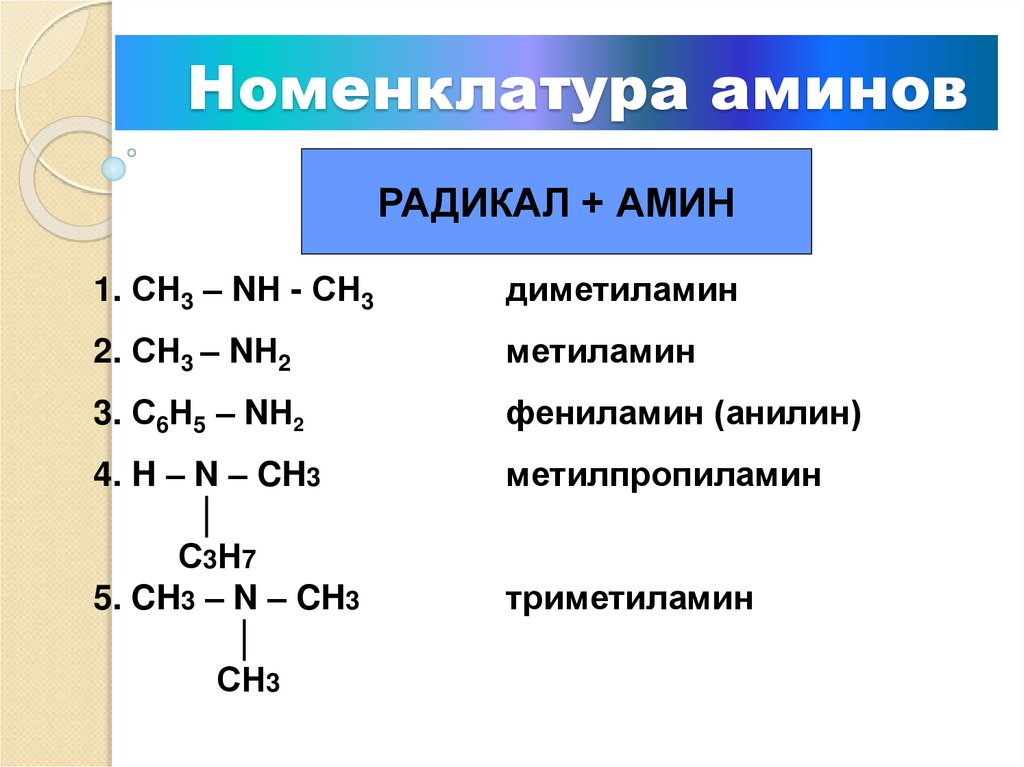
Для получения вторичных и третичных аминов можно использовать реакцию аминов с галогеналкилами:
(Ch4)2NH + C2H5Br — (Ch4)2NC2H5 + HBr
Амины можно получить восстановлением нитросоединений. Обычно нитросоединения подвергают каталитическому гидрированию водородом:
C2H5NO2 + 3h3 — C2H5Nh3 + 2h3O
Этот метод используется в промышленности для получения ароматических аминов.
Предельные амины. При обычных условиях метил амин Ch4Nh3, диметиламин (Ch4)2NH, триметиламин (Ch4)3N и этиламин C2H5Nh3 – газы с запахом, напоминающим запах аммиака. Эти амины хорошо растворимы в воде. Более сложные амины – жидкости, высшие амины – твердые вещества.
Для аминов характерны реакции присоединения, в результате которых образуются алкиламиновые соли. Например, амины присоединяют галогеноводороды:
(Ch4)2Nh3 +HCl — [(Ch4)2Nh4]Cl
хлорид этиламмония
(Ch4)2NH + HBr — [(Ch4)2Nh3]Br
бромид диметиламмония
(Ch4)3N + HI — [(Ch4)3NH]I
иодид триметиламмония
Тритичные амины присоединяют галогенопроизводные углеводорода с образованием тетраалкиламмониевых солей, например:
(C2H5)3N + C2H5I — [(C2H5)4N]I
Алкиламониевые соли растворимы в воде и в некоторых органических растворителях. При этом они диссоциируют на ионы:
При этом они диссоциируют на ионы:
[(C2H5)4N]I === [(C2H5)4N]+ + I-
В результате водные и неводные растворы этих солей проводят электрический ток. Химическая связь в алкиламмониевых соединениях ковалентная, образованная по донорно-акцепторному механизму:
Ион метиламмония
Амины — формула, способы получения, номенклатура
Поможем понять и полюбить химию
Начать учиться
Амины и их особенности — одна из самых интересных тем в школьном курсе химии за 10‑й класс. И если раньше вам было трудно ее понять, то сегодня мы это исправим. В этом статье мы расскажем, что такое амины и на какие виды они делятся, научим правильно называть их и разберем свойства этих веществ. Без примеров тоже не обойдется — к концу статьи вы узнаете, с чем амины могут вступать в реакцию и какими методами их можно получить.
Что такое амины
Аминами называют органические производные аммиака (Nh4), в молекулах которых один, два или все три атома водорода замещены на углеводородные радикалы.
Примем во внимание, что амины — производные аммиака, значит, они должны либо быть очень схожи по строению, либо повторять его полностью. Ниже на картинке можно рассмотреть строение аммиака и первичного амина:
Обратим внимание на то, что в строении обеих молекул есть азот с неподеленной электронной парой, из-за чего амины обладают осно́вными свойствами. Теперь обратимся к пространственной формуле аммиака и представителя первичных аминов — метиламина.
На основе пространственной формулы можно сделать вывод, что обе эти молекулы имеют форму тетраэдра, что подтверждает нам sp3-гибридизацию атома азота.
Полезные подарки для родителей
В колесе фортуны — гарантированные призы, которые помогут наладить учебный процесс и выстроить отношения с ребёнком!
Классификация аминов
Амины разделяют по двум основным категориям:
число углеводородных групп у атома азота;
природа углеводородных заместителей.

Рассмотрим каждую более подробно.
По числу углеводородных групп
По числу углеводородных групп, которые заместили водород в молекуле аммиака, амины делятся на первичные, вторичные и третичные. Тут возникает аналогия с классификацией одноатомных спиртов. Она четко дает понять, что в других классах органических веществ такая классификация означает положение функциональной группы у атомов углерода. Но в случае аминов все иначе. Если на какой-либо радикал замещен один водород, то это первичный амин. При замещении двух водородов амин становится вторичным. Если в молекуле аммиака вообще не остается водородов, только один азот, то такие амины называют третичными.
Сравним две молекулы:
 Спирт будет третичным, так как функциональная группа находится у третичного атома углерода. В то же время амин будет первичным, так как у него замещен один атом водорода на довольно разветвленный углеводородный радикал.
Спирт будет третичным, так как функциональная группа находится у третичного атома углерода. В то же время амин будет первичным, так как у него замещен один атом водорода на довольно разветвленный углеводородный радикал.По природе углеводородных заместителей
По природе углеводородных заместителей амины бывают алифатическими, ароматическими, смешанными, алициклическими и гетероциклическими. В последних двух пока что будет сложно разобраться. Давайте пропустим их и рассмотрим в другой раз.
Теперь разберемся, чем первые три отличаются друг от друга. У алифатических аминов в составе есть заместитель, атомы углерода которого соединены между собой в прямые или разветвленные цепи. Ароматический амин содержит ароматическую систему связей. Смешанный амин представляет собой комбинацию из нескольких видов углеводородных заместителей.
Природа углеводородных заместителей | Структурная формула | Название |
|---|---|---|
Алифатические | Этиламин | |
Ароматические | Анилин | |
Смешанные | N, N-диметиланилин |
Ниже в таблице мы собрали все, что можем сказать о классификации аминов.
Амины | Первичные | Вторичные | Третичные |
|---|---|---|---|
Алифатические (жиры) | CH3NH2 Метиламин | (CH3)2NH Диметиламин | (CH3)3N Триметиламин |
Ароматические | C6H5NH2 | (C6H5)2NH Дифениламин | (C6H5)3N Трифениламин |
Смешанные | — | C6H5–NH–CH3 Метилфениламин | C6H5–N(CH3)2 Диметилфениламин |
Номенклатура аминов
Различать амины мы уже умеем, но называть — еще нет. Давайте это исправим! Так как видов аминов несколько, то и называют их по-разному.
Давайте это исправим! Так как видов аминов несколько, то и называют их по-разному.
Номенклатура первичных аминов
Чтобы назвать амин по номенклатуре ИЮПАК, нужно следовать такому алгоритму:
Укажите название углеводородного радикала, исходя из его количества углерода в цепи.
Добавьте к вышеназванному корню суффикс, который укажет на наличие или отсутствие кратных связей.
Обозначьте наличие аминогруппы, добавив к уже имеющемуся названию корень «амин».
После указанного названия поставьте дефис и укажите порядковый атом углерода, который связан с аминогруппой.
Как следовать всем этим пунктам, мы показали на рисунке ниже.
Но первичные амины можно назвать проще с помощью радикально-функциональной номенклатуры. Здесь за основу берут аминогруппу, а углеводородные радикалы являются заместителями: название радикала + «амин». Бутанамин-2 по радикально-функциональной номенклатуре будет называться бутиламином.
Здесь за основу берут аминогруппу, а углеводородные радикалы являются заместителями: название радикала + «амин». Бутанамин-2 по радикально-функциональной номенклатуре будет называться бутиламином.
Номенклатура вторичных и третичных аминов
Эта номенклатура отличается только в радикально-функциональной номенклатуре. В основе лежит атом азота, углеводородные заместители указываются как радикалы в алфавитном порядке, либо с греческой приставкой при условии, что заместители одинаковы. Прилагаем пример на картинке ниже.
Важно
Для ароматических аминов используют тривиальные названия. Например, анилин.
Изомерия аминов
Для аминов характерна:
- изомерия углеродного скелета;
- изомерия положения функциональной группы;
- изомерия между типами аминов.
Важно
Общая формула предельных аминов: CnH2n+3N или CnH2n+1NH2.
Физические свойства аминов
У аминов можно выделить такие физические свойства:
Первичные и вторичные амины образуют слабые межмолекулярные водородные связи, что объясняет более высокие температуры кипения аминов относительно неполярных соединений с похожей молярной массой.
Амины способны образовывать межмолекулярные связи с водой, из-за чего низшие амины хорошо растворяются в воде При увеличении количества радикалов и их разветвленности растворимость в воде заметно снижается. Что касается ароматических аминов, то они в воде практически не растворяются.
Низшие алифатические амины (метиламин, диметиламин и триметиламин) — это газы с характерным запахом аммиака.
 Средние гомологи — это жидкости с резким рыбным запахом, а высшие амины — твердые вещества, у которых запаха нет.
Средние гомологи — это жидкости с резким рыбным запахом, а высшие амины — твердые вещества, у которых запаха нет.Ароматические амины — это бесцветные жидкости с высокими температурами кипения или же твердые вещества.
Химические свойства аминов
Наличие у атома азота неподеленной электронной пары в значительной степени определяет химические свойства аминов. Алифатические амины — это более сильные основания, чем аммиак, из-за влияния алкильных групп. В свою очередь ароматические амины имеют более низкую основность, чем у аммиака, из-за своей стабильности.
1. Взаимодействие с водой.
При растворении аминов в воде образуется катион аммония и гидроксид-анион аналогично растворению аммиака в воде.
NH3 + H2O ⇌ NH4+ + OH–.
C3H7 – NH2 + H2O ⇌ (C3H7 – NH3)+ + OH–.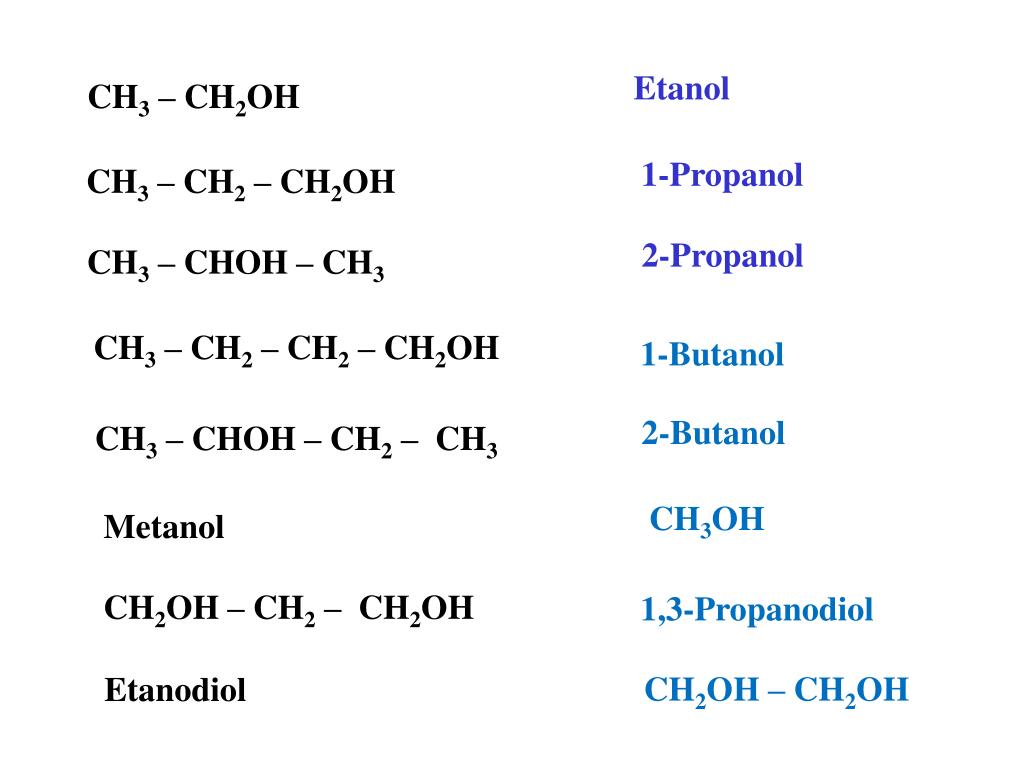
2. Взаимодействие аминов с кислотами.
Так как амины обладают оснóвными свойствами, то способны вступать в реакцию с кислотами с образованием солей.
H3C – CH2 – NH2 + HBr → [H3N+ – CH2 – CH3] Br –.
При взаимодействии аминов с многоосновными кислотами возможно образование кислых солей.
CH3 – NH – CH3 + H2SO4 → [H3C – N+H2 – CH3] HSO4–.
3. Алкилирование аминов.
Из первичного амина можно получить вторичный, а затем и третичный амин. Эта реакция проходит в две стадии:
Амины алкилируют галогеналканом с образованием соли:
CH3 – NH2 + CH3 – CL → [H3C – N+H2 – CH3] CL– .
Затем высвобождаем новый амин с помощью более сильного основания (щелочи):
[H3C – N+H2 – CH3] Cl– + NaOH → CH3 – NH – CH3 + NaCl + H2O.
4. Взаимодействие с азотистой кислотой.
Качественная реакция на первичные амины:
H3C – CH2 – NH2 + NaNO2 + HCl → H3C – CH2 – OH + N2 + NaCl + H2O.
5. Горение аминов.
Все амины горят с образованием углекислого газа, газообразного азота и воды, независимо от состава и структуры амина.
4C2H5 – NH2 + 15O2 → 8CO2 + 2N2 + 14H2O.
Способы получения аминов
Существует несколько способов получить амины в ходе химических реакций. Сегодня мы рассмотрим два из них. Остальные вы подробно разберете в 11-м классе.
Сегодня мы рассмотрим два из них. Остальные вы подробно разберете в 11-м классе.
- Гидрирование нитросоединений.
Общий вид протекания реакции:
Частный случай гидрирования нитросоединения — промышленное получение анилина:
- Получение из галогеналканов.
Реакция идет в две стадии: сначала получение соли алкиламмония, а затем вытеснение амина более сильным основанием:
Если вы хотите еще глубже изучить свойства аминов и закрепить знания на практике, подумайте о дополнительных занятиях. На уроках онлайн-курсов химии в Skysmart вы сможете разобрать любую тему — даже ту, что, казалось бы, никогда не получится осилить. Например, свойства анилина и другие. Наши преподаватели объяснят ее простым языком, а интерактивные задания и опыты расскажут, как работает химия на самом деле. Начните с бесплатного вводного занятия — там мы познакомим вас с онлайн-платформой и поможем определить уровень знаний.
Начните с бесплатного вводного занятия — там мы познакомим вас с онлайн-платформой и поможем определить уровень знаний.
Ксения Боброва
К предыдущей статье
Химическое равновесие
К следующей статье
Как подготовиться к ОГЭ по химии
Получите план обучения, который поможет понять и полюбить химию
На вводном уроке с методистом
Выявим пробелы в знаниях и дадим советы по обучению
Расскажем, как проходят занятия
Подберём курс
[Решено] Как называется соединение Ch4 – Ch4?
Как называется соединение CH 3 – CH 3 ?
This question was previously asked in
RRC Group D Previous Paper 38 (Held On: 10 Oct 2018 Shift 2)
View all RRB Group D Papers >
- Butane
- Ethane
- Methane
- Propane
Вариант 2: Этан
Бесплатно
Ячейка
7 тысяч пользователей
10 вопросов
10 баллов
7 минут
Правильный ответ: Этан .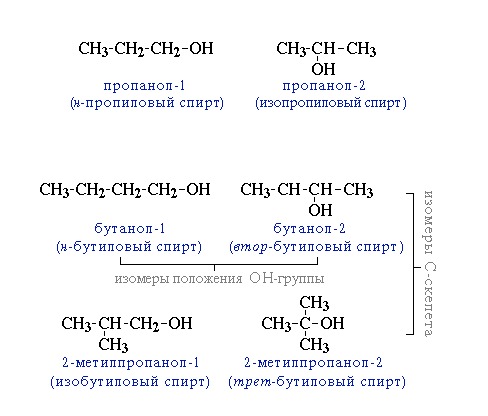
- Этан (C 2 H 6 ) представляет собой простой углеводород , состоящий из цепей атомов углерода , где запасных валентностей заняты атомами водорода .
- При стандартной температуре и давлении этан представляет собой бесцветный газ без запаха .
- Этан в основном используется для производства этилен , который используется в нефтехимической промышленности .
- Общепринятое название этана — биметил .
Дополнительная информация
- Бутан (C 4 H 10 ) считается углеводородом. При стандартной температуре и давлении бутан представляет собой легковоспламеняющийся, бесцветный, легко сжижающийся газ, который быстро испаряется.
- Используется в качестве топлива, аэрозольного пропеллента , в зажигалках , и для производства других химикатов.

- Используется в качестве топлива, аэрозольного пропеллента , в зажигалках , и для производства других химикатов.
- Метан (CH 4 ) представляет собой газ при комнатной температуре с одним атомом углерода и четырьмя плечами атомов водорода.
- Метан — один из парниковых газов , поглощающих энергию, отраженную от поверхности Земли, не давая ей уйти в космос.
- Алессандро Вольта обнаруживает Метан.
- Метан используется в качестве топлива для печей, домов, водонагревателей, печей, автомобилей, турбин и прочего.
- Активированный уголь используется для хранения метана.
- Пропан (C 3 H 8 ) представляет собой трехуглеродный алкан, представляет собой газ без запаха, по этой причине для обнаружения утечек был добавлен одорант .
- При полном сгорании пропана образуется чистый водяной пар и двуокись углерода .
Поделиться в WhatsApp
Последние обновления группы D RRB
Последнее обновление: 28 марта 2023 г.
Результаты ПЭТ группы D RRB были опубликованы для RRB Bhubaneswar и RRB Prayagraj 23 января 2023 года. Допускная карточка RRB Group D PET была выпущена для регионов NFR, NWR, CR, SECR, WCR, NCR, SER, NR, SR. 10 января 2023 года. 4 января 2023 года была выпущена пропускная карта RRB Group D PET для ECoR, WR и SR. Расписание ПЭТ группы D RRB опубликовано для RRB Ajmer. Ссылка на систему показателей группы D RRB активна. Теперь кандидаты могут проверить свои индивидуальные баллы. 26 декабря 2022 года было опубликовано расписание ПЭТ группы D RRB для различных зон. Результаты и отсечки группы D RRB были объявлены 22 и 23 декабря 2022 года! Экзамен проводился с 17 августа по 11 октября 2022 года. RRB (Железнодорожная комиссия по набору персонала) проводит экзамен группы D RRB для найма на различные должности ремонтника пути и помощника/ассистента в различных технических отделах, таких как электрический, механический, научно-технический и т. д. Процесс отбора на эти должности включает в себя 4 этапа: компьютерный тест, тест на физическую работоспособность, проверку документов и медицинский тест.
д. Процесс отбора на эти должности включает в себя 4 этапа: компьютерный тест, тест на физическую работоспособность, проверку документов и медицинский тест.
Углеводороды
УглеводородыУглеводороды
Органические молекулы:
Органическая химия изучает свойства соединений углерода. Все соединения углерода, за исключением нескольких неорганических соединений углерода, являются органическими. Неорганические соединения углерода включают оксиды углерода, бикарбонаты и карбонаты ионов металлов, цианиды металлов и некоторые другие.
Углеводороды
Простейшие органические соединения состоят только из атомов углерода и водорода. Соединения только углерода и водорода называются Углеводороды .
Алканы
Простейший углеводород – метан, CH 4 . Это простейший член ряда углеводородов. Каждый последующий член ряда имеет на один атом углерода больше, чем предыдущий член.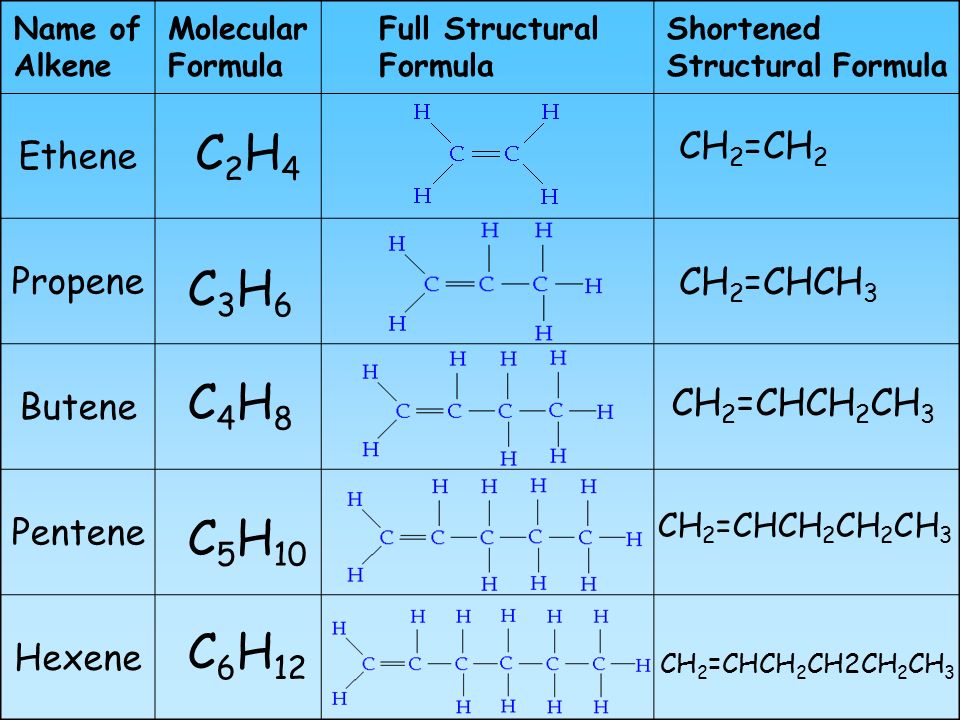 Этот ряд соединений называется алканы ( C n H 2n+2 ) . Более легкие газы и используются в качестве топлива. Средние (от 7 углеродов до 12 углеродов) — это жидкости, используемые в бензине (бензине). Высшие представляют собой воскообразные твердые вещества. Свечной воск представляет собой смесь алканов. Алканы являются насыщенными, что означает, что они содержат максимальное количество атомов водорода на углерод и не содержат двойных или тройных связей.
Этот ряд соединений называется алканы ( C n H 2n+2 ) . Более легкие газы и используются в качестве топлива. Средние (от 7 углеродов до 12 углеродов) — это жидкости, используемые в бензине (бензине). Высшие представляют собой воскообразные твердые вещества. Свечной воск представляет собой смесь алканов. Алканы являются насыщенными, что означает, что они содержат максимальное количество атомов водорода на углерод и не содержат двойных или тройных связей.
Название органических соединений относится к органической номенклатуре . Существует множество правил именования органических соединений, которые были систематизированы Международным союзом теоретической и прикладной химии
.Правила ИЮПАК для номенклатуры алканов
1. Найдите и назовите самую длинную непрерывную углеродную цепь.
2. Определите и назовите группы, присоединенные к этой цепочке.
3. Последовательно пронумеруйте цепь, начиная с конца, ближайшего к группе заместителей.
4. Обозначьте расположение каждой группы заместителей соответствующим номером и названием.
5. Соберите название, перечислив группы в алфавитном порядке.
Приставки ди, три, тетра и т. д., используемые для обозначения нескольких однородных групп, при алфавитном алфавите не учитываются.
Количество атомов углерода | Префикс | Структура |
1 | Мет ан | Ч 4 |
2 | Эт ан | CH 3 CH 3 |
3 | Опора ан | CH 3 CH 2 CH 3 |
4 | Бут ане | CH 3 (CH 2 ) 2 CH 3 |
5 | Пент ан | CH 3 (CH 2 ) 3 CH 3 |
6 | Шестигранник Ан | CH 3 (CH 2 ) 4 CH 3 |
7 | Гепт ане | CH 3 (CH 2 ) 5 CH 3 |
8 | октябрь ан | CH 3 (CH 2 ) 6 CH 3 |
9 | Не ан | CH 3 (CH 2 ) 7 CH 3 |
10 | декабрь ан | СН 3 (СН 2 ) 8 СН 3 |
11 | Ундек ан | CH 3 (CH 2 ) 9 CH 3 |
12 | Додек ане | CH 3 (CH 2 ) 10 CH 3 |
Изомерия
Все алканы с 4 и более атомами углерода проявляют структурную изомерию . Это означает, что для каждой молекулярной формулы можно нарисовать две или более различных структурных формул.
Это означает, что для каждой молекулярной формулы можно нарисовать две или более различных структурных формул.
Например, C 4 H 10 может быть любой из этих двух разных молекул:
Они называются соответственно бутан и 2-метилпропан .
Наименование структурных изомеров алканов
Номенклатура усложняется, если алкан разветвляется. В таком случае есть несколько правил, которым вы должны следовать, чтобы дать алкану правильное название.
- Найдите самую длинную углеродную цепь в молекуле. Число атомов углерода в самой длинной цепи становится родительским именем (см. таблицу выше)
- Найдя исходную цепь, вы нумеруете исходную цепь, начиная с конца, ближайшего к первому заместителю (заместителем является любой фрагмент, выступающий за пределы основной цепи).
- Далее определите названия всех заместителей . Заместители называются так, как если бы часть была отдельной молекулой, за исключением того, что используется суффикс yl, а не ane. Таким образом, двухуглеродный заместитель будет этильным заместителем (а не этановым заместителем).
- Поместите заместители в алфавитном порядке (т.е. этил перед метилом) перед названием родителя.
- Затем определите положение всех заместителей в названии, поместив перед ним число атомов углерода, в котором заместитель присоединяется к исходной цепи. Например, 2-метилгептан указывает на то, что метильный заместитель присоединен к углероду номер 2.
Применение правил
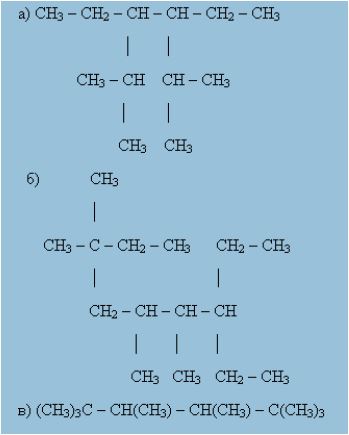
Теперь попробуйте применить эти правила, чтобы назвать следующую молекулу (это не так сложно, как может показаться).
Делайте это шаг за шагом, как описано выше.
1) Найдите самую длинную углеродную цепь в молекуле. Во-первых, найдите исходную цепь в молекуле, то есть максимально длинную цепочку соединяющих атомов углерода. Обратите внимание, что родительская цепочка не обязательно является цепочкой, которая просто следует слева направо. Например, если бы вы посчитали количество атомов углерода в этой молекуле слева направо, вы бы получили 7 атомов углерода. Однако это не родительская цепочка! Если вы начнете слева, а затем подсчитаете, где молекула разветвляется, вы обнаружите, что в ней 8 атомов углерода. Это самая длинная цепь (не дайте себя обмануть профессорам, прячущим атомы углерода в ответвлениях), и, таким образом, исходной цепью является октан (см. таблицу выше).
2) Номер родительской цепи. На втором этапе необходимо пронумеровать атомы углерода в исходной цепи, начиная с конца, ближайшего к первому заместителю. Важно нумеровать молекулу с правильного конца (другими словами, в этом примере вы нумеруете алкан справа налево или слева направо). Следуя этому правилу, на этой молекуле вы нумеруете справа налево, так как 2-углеродный заместитель находится ближе к этому концу.
Следуя этому правилу, на этой молекуле вы нумеруете справа налево, так как 2-углеродный заместитель находится ближе к этому концу.
| | |
| Правильная нумерация | Неправильная нумерация |
3. Назовите все заместители. Затем вы определяете имена заместителей. В этом случае единственным заместителем является 2-углеродная группа у 4-го атома углерода. Это этильная группа.
4. Расположите заместители в алфавитном порядке. Следующим шагом является расположение заместителей в алфавитном порядке (т.е. этил перед метилом), но так как есть только один заместитель, в этом нет необходимости.
5. Найдите заместитель в родительском изменении, присвоив ему номер . Таким образом, правильная номенклатура этого алкана — 4-этилоктан. Обратите внимание, что тире используется для отделения числа от заместителя.
Таким образом, правильная номенклатура этого алкана — 4-этилоктан. Обратите внимание, что тире используется для отделения числа от заместителя.
Циклоалканы снова содержат только углерод-водородные связи и углерод-углеродные одинарные связи, но на этот раз атомы углерода соединены в кольцо. Наименьшим циклоалканом является циклопропан.
Если вы посчитаете атомы углерода и водорода, вы увидите, что они больше не соответствуют общей формуле C n H 2n+2 . Соединяя атомы углерода в кольцо, вы должны были потерять два атома водорода.
Вряд ли он вам когда-нибудь понадобится, но общая формула циклоалкана C п Н 2п .
Не думайте, что это все плоские молекулы. Все циклоалканы от циклопентана и выше существуют в виде «сморщенных колец».
Циклогексан, например, имеет кольцевую структуру, которая выглядит следующим образом:
Эта форма циклогексана известна как «кресло» из-за его формы, отдаленно напоминающей стул.
Правила ИЮПАК для номенклатуры циклоалканов
1. Для монозамещенного циклоалкана кольцо дает название корня, а группа-заместитель называется, как обычно. Номер места необязателен.
2. Если алкильный заместитель большой и/или сложный, кольцо может быть названо замещающей группой алкана.
3. Если в кольце присутствуют два разных заместителя, они перечислены в алфавитном порядке, и первый указанный заместитель соответствует углероду №1. Затем нумерация атомов углерода в кольце продолжается в направлении (по часовой стрелке или против часовой стрелки), которое дает второму заместителю меньший возможный номер положения.
4. Если в кольце присутствует несколько заместителей, они перечислены в алфавитном порядке. Номера положений присваиваются заместителям таким образом, что один из них находится у углерода № 1, а другие положения имеют наименьшие возможные номера, считая либо по часовой стрелке, либо против часовой стрелки.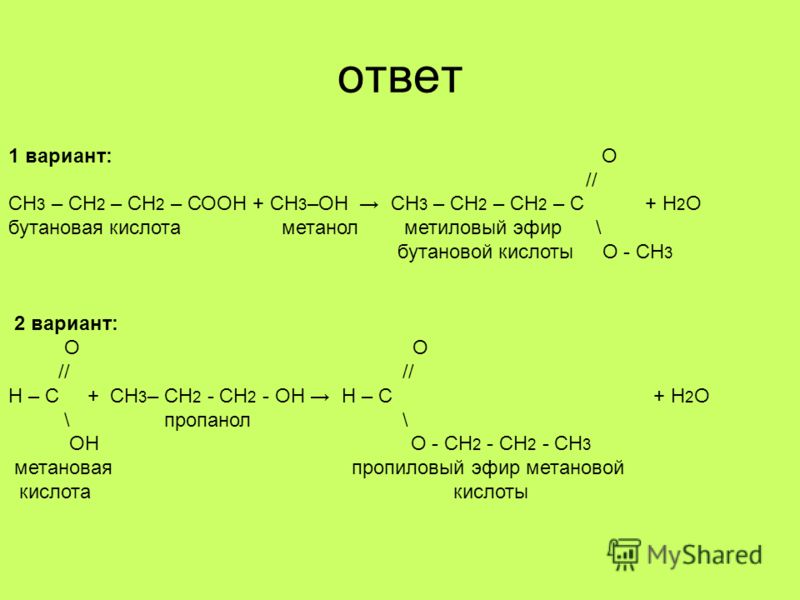
5. Название собирается, перечисляя группы в алфавитном порядке и присваивая каждой группе (если их две или более) номер местоположения. Приставки ди, три, тетра и т. д., используемые для обозначения нескольких однородных групп, при алфавитном алфавите не учитываются.
Алкены
Другая серия соединений называется алкенов . Они имеют общую формулу: C n H 2n . Алкены содержат меньше атомов водорода, чем алканы. Оставшиеся дополнительные валентности возникают в виде двойных связей между парой атомов углерода. Двойные связи более реакционноспособны, чем одинарные связи, что делает алкены химически более реакционноспособными.
Правила ИЮПАК для номенклатуры алкенов и циклоалкенов
1. Суффикс ен (окончание) указывает на алкен или циклоалкен.
2. Самая длинная цепь, выбранная для корневого названия, должна включать обоих атомов углерода двойной связи .
Самая длинная цепь, выбранная для корневого названия, должна включать обоих атомов углерода двойной связи .
3. Корневая цепь должна быть пронумерована с конца, ближайшего к атому углерода двойной связи . Если двойная связь находится в центре цепи, для определения конца, с которого начинается нумерация, используется правило ближайшего заместителя.
4. Меньшее из двух чисел, обозначающих атомы углерода двойной связи, используется в качестве локатора двойной связи. Если присутствует более одной двойной связи, соединение называется диеновым, триеновым или эквивалентным префиксом, указывающим количество двойных связей, и каждой двойной связи присваивается локаторный номер.
5. В циклоалкенах атомам углерода двойной связи отведены кольцевые позиции №1 и №2. Какой из двух является номером 1, можно определить по правилу ближайшего заместителя.
6. Группы заместителей, содержащие двойные связи: 90 198
H 2 C=CH– Винильная группа
H 2 C=CH–CH 2 – Аллильная группа
Алкины
Третьей серией являются алкины . Они имеют следующую формулу: C n H 2n-2 .
Они имеют следующую формулу: C n H 2n-2 .
Алкины имеют два атома углерода, соединенных тройной связью. Это очень реакционноспособно, что делает эти соединения нестабильными.
Правила ИЮПАК для номенклатуры алкинов
1. Суффикс yne (окончание) указывает на алкин или циклоалкин.
2. Самая длинная цепь, выбранная для названия корня, должна включать обоих атомов углерода тройной связи .
3. Корневая цепь должна быть пронумерована с конца, ближайшего к атому углерода тройной связи . Если тройная связь находится в центре цепи, для определения конца, с которого начинается нумерация, используется правило ближайшего заместителя.
4. Меньшее из двух чисел, обозначающих атомы углерода тройной связи, используется в качестве локатора тройной связи.
5. Если присутствует несколько множественных связей, каждой из них должен быть присвоен номер локатора.