T-терапия — Медицинский центр Шиба
Терапия CAR-T-клетками – это инновационный метод лечения определенных типов рака крови, при котором собственные лейкоциты пациента генетически программируются на уничтожение раковых клеток. При помощи высокотехнологичного оборудования осуществляется отделение лейкоцитов (белых кровяных клеток, которые являются важным компонентом иммунной системы) от остальной массы крови. В специализированной лаборатории полученные лейкоциты претерпевают генетическую модификацию с целью экспрессии химерных антигенных рецепторов (CAR). На следующем этапе их размножают в лабораторных условиях до достижения миллионов модифицированных клеток и возвращают в организм пациента.
Возвращение CAR-T-клеток в кровоток пациента осуществляется путем инфузии. Теперь химерные антигенные рецепторы будут помогать генетически модифицированным клеткам связываться с соответствующими антигенами раковых клеток, эффективно выслеживая и уничтожая их.
Когда другие методы лечения рака крови оказываются неэффективными, терапия CAR-T-клетками позволяет достичь желаемых результатов и в некоторых случаях приводит к ремиссии заболевания. Значительное преимущество данного вида терапии заключается в том, что CAR-модификация не только заставляет Т-клетки убивать рак, но также инициирует их деление и рост. Таким образом, после одной лишь процедуры CAR-T-клетки остаются в Вашем теле и продолжают атаковать опухоль в течение месяцев или даже лет.
Значительное преимущество данного вида терапии заключается в том, что CAR-модификация не только заставляет Т-клетки убивать рак, но также инициирует их деление и рост. Таким образом, после одной лишь процедуры CAR-T-клетки остаются в Вашем теле и продолжают атаковать опухоль в течение месяцев или даже лет.
Терапия CAR-T-клетками является высокоспециализированным и персонализированным методом лечения, который доступен не в каждом онкологическом центре по всему миру. Онкологи клиники Шиба в Израиле прошли подготовку в ведущих медицинских учреждениях, и мы рады предложить Вам этот инновационный вид терапии. Наши врачи практикуют всесторонний, комплексный подход с учетом индивидуальных потребностей и общего состояния здоровья каждого пациента.
В Шибе мы предлагаем лечение следующих видов рака:
- Острый лимфобластный лейкоз (ОЛЛ) у взрослых
- Неходжкинская лимфома (НХЛ) у взрослых и детей
- Лейкоз у детей
- Множественная миелома
- Острый миелоидный лейкоз (ОМЛ)
Как правило, большинство пациентов, проходящих терапию CAR-T-клетками, не испытывают типичные для химиотерапии побочные эффекты, такие как тошнота, рвота и выпадение волос. Тем не менее, существует риск развития других серьезных нежелательных реакций. Поскольку лечение заключается в одноразовой инфузии (а не в нескольких процедурах, как при химиотерапии), большая часть возможных осложнений возникает в течение последующих одной или двух недель. Они, как правило, носят временный характер и могут быть устранены при помощи лекарственных препаратов. Крайне важно сообщать Вашим врачам в Шибе всю информацию о побочных явлениях для того, чтобы они смогли принять своевременные меры и облегчить их проявление.
Тем не менее, существует риск развития других серьезных нежелательных реакций. Поскольку лечение заключается в одноразовой инфузии (а не в нескольких процедурах, как при химиотерапии), большая часть возможных осложнений возникает в течение последующих одной или двух недель. Они, как правило, носят временный характер и могут быть устранены при помощи лекарственных препаратов. Крайне важно сообщать Вашим врачам в Шибе всю информацию о побочных явлениях для того, чтобы они смогли принять своевременные меры и облегчить их проявление.
- Синдром высвобождения цитокинов, который включает в себя симптомы, соответствующие гриппу: высокая температура, озноб, низкое кровяное давление, боль в мышцах или суставах, одышка и учащенное сердцебиение. Степень тяжести данных симптомов варьируется от легкой до тяжелой.
- Неврологические расстройства, такие как спутанность сознания, усталость, судороги, возбужденное состояние, афазия (нарушение речи или понимания речи), энцефалопатия (нарушение работы мозга, болезни, травмы) и нарушение равновесия.

- Анемия (пониженное содержание эритроцитов в крови).
- Нейтропения (пониженное содержание лейкоцитов в крови).
В рамках CAR-T-терапии врачи Медицинского центра Шиба создадут специальную противораковую вакцину из Ваших собственных лейкоцитов. Мы будем информировать Вас обо всех подробностях процесса на протяжении всего периода лечения.
Ниже следует пошаговое объяснение процесса терапии CAR-T-клетками:
Мы проведем разнообразные тесты и проверки для того чтобы определить, подойдет ли Вам данный вид терапии.
При помощи специального аппарата для афереза осуществляется отделение Т-клеток от остальной массы крови.
В специализированной лаборатории полученные Т-клетки генетически модифицируются для экспрессии химерных антигенных рецепторов (CAR). Химерные антигенные рецепторы – это белки, которые позволяют Т-клеткам распознавать определенные антигены на поверхности опухолевых клеток.
Генетически измененные Т-клетки размножают в лаборатории, которая находится на территории Шибы, пока их количество достигнет нескольких миллионов. Данный процесс может занять несколько недель.
Данный процесс может занять несколько недель.
Перед инфузией CAR-T-клеток в некоторых случаях назначается курс химиотерапии для сокращения количества раковых клеток. Таким образом, мы освобождаем место для размножения CAR-T-клеток в Вашем организме.
Вскоре после курса химиотерапии в условиях стационара будет выполнен возврат CAR-модифицированных Т-клеток в организм. Данный процесс аналогичен переливанию крови.
Несмотря на то, что лечение заключается лишь в одноразовой инфузии, возможно, Вам потребуется оставаться в условиях стационара в течение нескольких недель для того, чтобы наши врачи могли внимательно следить за Вашим состоянием и при необходимости устранять какие-либо побочные эффекты. Как правило, процесс выздоровления занимает около двух-трех месяцев.
Врачи Шибы проинформируют Вас о частоте контрольных осмотров в период наблюдения в течение последующих нескольких месяцев. Мы осуществим тщательную оценку состояния Вашего здоровья и проверим реакцию организма на терапию. В течение последующих нескольких лет Вам потребуется возвращаться в Шибу для контрольных обследований, включающих в себя анализы крови, физикальные осмотры, биопсии костного мозга, а также ПЭТ или КТ.
В течение последующих нескольких лет Вам потребуется возвращаться в Шибу для контрольных обследований, включающих в себя анализы крови, физикальные осмотры, биопсии костного мозга, а также ПЭТ или КТ.
Знакомьтесь с Сэмом: терапия CAR-T-клетками спасла ему жизнь
“Как гром среди ясного неба” – такая реакция была у Сэма Турела, когда он получил диагноз хроническое лимфопролиферативное заболевание в 2004 году. В тот период Сэм жил активной полноценной жизнью, ходил на работу, занимался семьей и находил время для спорта. А в 2009 году у него был диагностирован хронический лимфоцитарный лейкоз (ХЛЛ). Узнайте, чем закончилась история Сэма и какую роль в этом сыграла CAR-T терапия.
В НМИЦ гематологии впервые в России проведена CAR-T-клеточная терапия в качестве первой линии
Три месяца назад, 23 ноября 2021 года, в НМИЦ гематологии в рамках ученого совета были представлены теоретические данные, посвященные новым технологиям CAR-T-клеточной терапии (см. видеозапись). Сообщалось о свойствах Т-лимфоцитов, которые делают их уникальным лекарственным препаратом, и о современных возможностях CAR-T-терапии лимфатических опухолей. Заведующий отделением интенсивной высокодозной химиотерапии лимфом Е. Е. Звонков рассказал, что новая прорывная технология изменила прогноз не только самых распространенных В-крупноклеточных лимфом, но и всех видов лимфом.
Сообщалось о свойствах Т-лимфоцитов, которые делают их уникальным лекарственным препаратом, и о современных возможностях CAR-T-терапии лимфатических опухолей. Заведующий отделением интенсивной высокодозной химиотерапии лимфом Е. Е. Звонков рассказал, что новая прорывная технология изменила прогноз не только самых распространенных В-крупноклеточных лимфом, но и всех видов лимфом.
Доказательством успешности применения CAR-T-терапии стал результат, полученный у 68-летнего пациента. Василия Захаровича из города Ковров Владимирской области врачи теперь в шутку называют «дедушка на миллион». Глядя на него, сложно предположить, что еще несколько месяцев назад диагноз мог стать приговором.
— Стал очень сильно уставать, в последнее время даже спать не мог, с каждым днем все было хуже и хуже, похудел, а вот живот, наоборот, вырос. Жена и дети привезли меня в гемцентр, я сдал анализы и через два оказался в реанимации,— рассказывает Василий Захарович.
В НМИЦ гематологии пациент поступил с так называемой коморбидностью, когда протекают одновременно несколько заболеваний, лечение которых может быть затруднено. Однако врачей насторожил анализ крови.
Однако врачей насторожил анализ крови.
— Мы обнаружили 1,5 миллиона лейкоцитов при нормальных значениях от 5 до 8 тыс. в мкл. Так как это жизнеугрожающая ситуация, пациента сразу госпитализировали, очень быстро выполнили обследование, диагностировали лимфому из клеток мантийной зоны, так называемый бластоидный вариант, это крайне агрессивное течение. В дальнейшем нашли генетические поломки, связанные с абсолютной резистентностью к стандартной химиотерапии. Все курсы, которые раньше мы использовали в этой ситуации, не работают, поэтому мы были вынуждены применить уже в первой линии таргетное воздействие, которое позволяет обойти сигнальный путь, связанный с мутацией в гене ТР53 — препараты ибрутиниб и венетоклакс. Они обладают минимальной токсичностью, но, как оказалось, крайне эффективны. Практически через неделю от опухоли практически ничего не осталось, вместо 1,5 миллионов лейкоцитов стало 700, а селезенка, размер которой был 30 см, стала нормальной, восстановились тромбоциты и гемоглобин. Перед нами был фактически здоровый человек! Раньше такого не видели! И это без использования агрессивной химиотерапии, при которой выпадают волосы, а только с использованием таргетной терапии. Увидев такой феномен, мы решили обратиться в центр Рогачева и применить CAR-T-клеточную терапию в качестве консолидации — закрепления эффекта,— рассказывает заведующий отделением интенсивной высокодозной химиотерапии лимфом Евгений Евгеньевич Звонков.
Перед нами был фактически здоровый человек! Раньше такого не видели! И это без использования агрессивной химиотерапии, при которой выпадают волосы, а только с использованием таргетной терапии. Увидев такой феномен, мы решили обратиться в центр Рогачева и применить CAR-T-клеточную терапию в качестве консолидации — закрепления эффекта,— рассказывает заведующий отделением интенсивной высокодозной химиотерапии лимфом Евгений Евгеньевич Звонков.
CAR-T -клеточная терапия заключается в извлечении T-лимфоцитов из организма пациента посредством афереза — технологии, которая позволяет разделить кровь на компоненты и получить определенное количество лимфоцитов. Затем проводится их модификация, чтобы они могли распознавать и атаковать опухолевые клетки, и они вводятся обратно в организм пациента. Этот путь прошли клетки и Василия Захаровича.
— Все прошло без специфических осложнений, мы и тогда, и сейчас контролируем уровень этих CAR-T-клеток, они остаются, а вот В-клеток и опухоли вообще не осталось. Это называется МОБ-негативность (МОБ — минимальная остаточная болезнь), когда мы самыми чувствительными методами не обнаруживаем опухолевые клетки,— рассказал Евгений Евгеньевич.
Это называется МОБ-негативность (МОБ — минимальная остаточная болезнь), когда мы самыми чувствительными методами не обнаруживаем опухолевые клетки,— рассказал Евгений Евгеньевич.
Раньше врачам пришлось бы проводить химиотерапию, без гарантии на какой-либо эффект. Следующий этап — аллогенная трансплантация. Учитывая пожилой возраст и наличие коморбидности, использовать такой метод рискованно.
— Сегодня сочетание таких невероятных, космических технологий дает нам возможность из абсолютно некурабельного состояния привести человека в полный порядок буквально за месяц, за два, и это не фантастика. Это конечно не наши препараты, не российские, CAR-T-технология тоже исходно не наша технология, но это случилось в России, это действительно чудо, и я думаю это будет развиваться однозначно, скорей всего мы начинаем находить ту нишу, где CAR-T-терапия будет работать максимально эффективно. Если раньше эта была 3-я—4-я линия, двадцати-тридцати, ну, максимум пятидесятипроцентная эффективность, то наверно в первой линии, когда Т-клетки, не подверженные химиотерапии, они скажем так наиболее сильные, из них можно делать наиболее сильные CAR и вводить пациенту. Это однозначно революция в гематологии, мы такого раньше не видели, о чем я сегодня жалею, что не могу показать эти результаты и этот уникальный случай Валерию Григорьевичу Савченко,— отметил Евгений Евгеньевич.
Это однозначно революция в гематологии, мы такого раньше не видели, о чем я сегодня жалею, что не могу показать эти результаты и этот уникальный случай Валерию Григорьевичу Савченко,— отметил Евгений Евгеньевич.
Несмотря на появление зарегистрированного CAR-T-препарата в мире еще в 2017 году, CAR-T-терапия по-прежнему практически недоступна для граждан Российской Федерации.
— Есть два вида производства CAR-T-клеток: коммерческое и академическое. В коммерческом — права на изготовление имеют четыре фармацевтических компании. Да, конечно, они оснащены высокотехнологичными лабораториями, но стоимость такого лекарства — 300—500 тысяч долларов — конечно для обычного человека эта сумма неподъёмная, и огромная нагрузка на Минздрав. Второй вид — это академический — когда сами институты через свои базы выполняют производство этих клеток. Я считаю, что академические CAR-T-клетки — это то направление, где и эффективность, минимальная стоимость, и самое главное, здесь клиницисты будут работать с лабораторией и с генетиками. А не так, что поступает пациент, приходит представитель компании, мы отдаем Т-клетки, их увозят, мы отдаем 500 тысяч долларов, но мы не видим производства, и у нас нет обратной связи,— отметил Евгений Евгеньевич.
А не так, что поступает пациент, приходит представитель компании, мы отдаем Т-клетки, их увозят, мы отдаем 500 тысяч долларов, но мы не видим производства, и у нас нет обратной связи,— отметил Евгений Евгеньевич.
Успешный пример лечения в НМИЦ гематологии пожилого пациента с лимфомой без химиотерапии и в результате использования модифицированных клеток в рамках пилотного протокола, инициированного в НМИЦ гематологии, требует быстрейшего внедрения технологии с применением Т-клеточного рецептор-химеры в клинику и скорейший доступ к ней пациентов.
О необходимости объединения усилий по преодолению регуляторных сложностей в использовании CAR-T-терапии на том самом ученом совете говорила и генеральный директор ФГБУ «НМИЦ гематологии Е. Н. Паровичникова.
— Существуют юридические и правовые ограничения. Нам нужно продумывать стратегические моменты. Все согласны с тем, что крупные академические центры могут работать и производить CAR-T-препараты, но нам нужны регуляторные разрешения,— отметила Елена Николаевна.
Справка: CAR-T-терапия — это метод лечения, основанный на использовании собственных клеток пациента. Искусственно созданный Т-клеточный рецептор-химера интегрируется в Т-клетку, в результате чего появляется возможность уничтожить любую опухолевую клетку.
CAR Т-клетки: разработка иммунных клеток для лечения рака
Увеличить
Костимулирующие сигнальные домены были добавлены к новым поколениям CAR Т-клеток, чтобы улучшить их способность продуцировать больше Т-клеток после инфузии и дольше выживать в кровотоке.
Авторы и права: Brentjens R, et al. «Движение CAR Т-клеток вперед». Nat Rev Clin Oncol. 2016 13, 370–383.
В течение десятилетий основой лечения рака были хирургия, химиотерапия и лучевая терапия. Они по-прежнему являются важнейшей опорой лечения, но недавно новые категории лечения помогли изменить картину лечения людей, больных раком.
В 2000-е годы появились таргетные препараты, такие как иматиниб (Гливек) и трастузумаб (Герцептин) — препараты, которые находят и убивают раковые клетки, ориентируясь на специфические молекулярные изменения, наблюдаемые в первую очередь в этих клетках.
И за последнее десятилетие иммунотерапия – методы лечения, которые задействуют и укрепляют способность иммунной системы пациента атаковать опухоли – быстро стала тем, что многие называют «пятым столпом» лечения рака. Это связано с тем, что препараты, стимулирующие иммунную систему, продемонстрировали способность уменьшать и даже уничтожать опухоли у некоторых людей с запущенным раком. У небольшого процента пациентов эти ответы на лечение могут длиться годами.
Например, препараты, называемые ингибиторами иммунных контрольных точек, уже широко используются для лечения людей со многими видами рака, включая меланому, рак легких, почек, мочевого пузыря и лимфому.
Но другая форма иммунотерапии, называемая CAR T-клеточной терапией, также вызвала значительный интерес у исследователей и онкологов. Хотя CAR Т-клеточная терапия не так широко используется, как ингибиторы иммунных контрольных точек, они продемонстрировали такую же способность искоренять очень запущенные лейкозы и лимфомы и сдерживать рак в течение многих лет.
С 2017 года Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) одобрило шесть CAR Т-клеточных терапий. Все они одобрены для лечения рака крови, включая лимфомы, некоторые формы лейкемии и, совсем недавно, множественную миелому.
Несмотря на ажиотаж вокруг этих методов лечения, они обеспечивают долгосрочную выживаемость менее чем у половины пролеченных пациентов. Они также подверглись критике за их стоимость, которая в случае недавно одобренной терапии CAR Т-клетками составляет более 450 000 долларов.
Тем не менее, после многих лет кропотливых исследований, терапия Т-клетками CAR стала основным методом лечения рака, сказал Стивен Розенберг, доктор медицинских наук, руководитель хирургического отделения Центра исследований рака NCI (CCR), пионер иммунотерапии и CAR T-клеточной терапии.
«Т-клетки [CAR] в настоящее время широко доступны в Соединенных Штатах и других странах и стали стандартным методом лечения пациентов с агрессивными лимфомами, — сказал д-р Розенберг. — Они стали частью современной медицины».
— Они стали частью современной медицины».
CAR Т-клеточная терапия: «живое лекарство»
CAR Т-клетки эквивалентны «предоставлению пациентам живого лекарства», объяснил Ренье Дж. Брентдженс, доктор медицинских наук, Мемориальный онкологический центр имени Слоана Кеттеринга в Нью-Йорке. York, еще один ранний лидер в области Т-клеток CAR.
Как следует из их названия, Т-клетки, которые помогают организовать иммунный ответ и непосредственно уничтожают клетки, инфицированные патогенами, являются основой CAR-Т-клеточной терапии.
Доступные в настоящее время CAR Т-клеточные терапии подбираются индивидуально для каждого пациента. Они производятся путем сбора Т-клеток у пациента и их реинжиниринга в лаборатории для производства белков на их поверхности, называемых химерными антигенными рецепторами или CAR. CAR распознают и связываются со специфическими белками или антигенами на поверхности раковых клеток. Эти рецепторы являются «синтетическими молекулами, они не существуют в природе», — объяснил Карл Джун, доктор медицины, из Онкологического центра Абрамсона Пенсильванского университета, еще одного лидера в области клеточной терапии.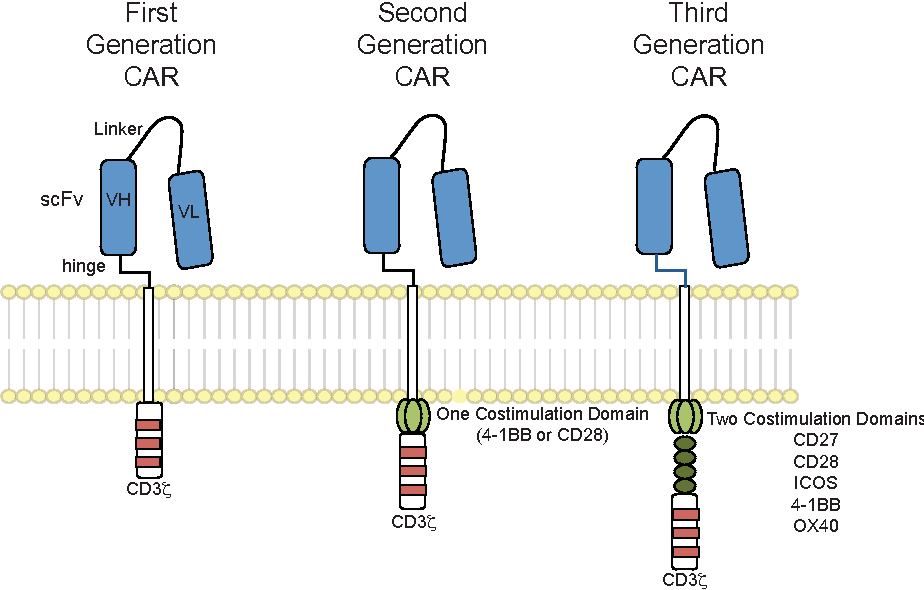
После того, как обновленные Т-клетки «размножаются» до миллионов в лаборатории, их снова вводят пациенту. Если все пойдет по плану, CAR Т-клетки будут продолжать размножаться в организме пациента и под руководством созданного ими рецептора распознавать и убивать любые раковые клетки, на поверхности которых находится антиген-мишень.
Терапия CAR T-клетками, одобренная FDA на сегодняшний день, нацелена на один из двух антигенов на B-клетках, CD19 или BCMA.
Изготовление Т-клетки CAR
В настоящее время разрабатывается и тестируется в клинических исследованиях все больше CAR Т-клеточных препаратов. Хотя между каждой конкретной терапией есть важные различия, которые могут повлиять на то, как они действуют у пациентов, все они имеют схожие компоненты. Каждый CAR соединяет клеточную мембрану. Часть рецептора расположена вне клетки, а часть внутри клетки. Часть CAR, выступающая за поверхность клетки, обычно состоит из фрагментов или доменов антител, полученных в лаборатории. Какие домены используются, влияет на то, насколько хорошо рецептор распознает или связывается с антигеном на опухолевых клетках. Внутренняя часть каждого CAR имеет сигнальный и костимулирующий домены. Они передают сигналы в клетку после взаимодействия рецептора с антигеном. Различные используемые домены могут влиять на общую функцию клеток.
Какие домены используются, влияет на то, насколько хорошо рецептор распознает или связывается с антигеном на опухолевых клетках. Внутренняя часть каждого CAR имеет сигнальный и костимулирующий домены. Они передают сигналы в клетку после взаимодействия рецептора с антигеном. Различные используемые домены могут влиять на общую функцию клеток.
Новые варианты лечения там, где их было немного
Первоначальная разработка CAR Т-клеточной терапии была сосредоточена в основном на наиболее распространенном раке у детей, остром лимфобластном лейкозе (ОЛЛ).
Более 80% детей с диагнозом ОЛЛ, возникающим в В-клетках, преобладающим типом ОЛЛ у детей, излечиваются с помощью интенсивной химиотерапии. Но эффективные методы лечения были ограничены для пациентов, у которых рак вернулся или рецидивировал после химиотерапии или трансплантации стволовых клеток.
Вторая Т-клеточная терапия CAR одобрена для лечения лимфомы
Tisagenlecleucel — новый вариант для некоторых пациентов с распространенной лимфомой.
Однако в 2017 году появился новый вариант: FDA одобрило тисагенлеклеуцел (Kymriah), первую CAR-Т-клеточную терапию, одобренную агентством, на основании клинических испытаний, демонстрирующих, что она может искоренить рак у детей с рецидивом ОЛЛ.
В некоторых случаях терапия CAR Т-клетками изучается уже достаточно давно, и начинают появляться подробности об отдаленных результатах у детей.
Исследовательская группа под руководством NCI, например, недавно сообщила о долгосрочном наблюдении за детьми с рецидивом ОЛЛ, которых лечили CAR Т-клетками в рамках клинического испытания. Они обнаружили, что более половины детей получили потенциально излечивающую трансплантацию стволовых клеток, и примерно 60% этих детей были все еще живы 5 лет спустя, и их рак не вернулся или дети не столкнулись с какими-либо проблемами, связанными с болезнью.
Прогресс, достигнутый с помощью CAR-T-клеточной терапии у детей с ОЛЛ, «был фантастическим», — сказал Терри Фрай, доктор медицинских наук, который руководил несколькими клиническими испытаниями CAR-T-клеточной терапии в NCI, а совсем недавно — в Детской больнице Колорадо.
Т-клетки CAR, нацеленные на CD19, также дают надежду взрослым и детям с прогрессирующими агрессивными лимфомами. До разработки CAR Т-клеток многие из этих пациентов «были практически не поддающимися лечению», — сказал Джеймс Кохендерфер, доктор медицинских наук из Центра исследований рака NCI, который руководил несколькими испытаниями терапии CAR Т-клетками у пациентов с диффузной крупной В-клеткой.
Результаты лечения лимфомы на сегодняшний день «были невероятно успешными», сказал д-р Кохендерфер, «и CAR Т-клетки стали часто используемой терапией для нескольких типов лимфомы».0003
Понимание и управление побочными эффектами CAR T-клеточной терапии
Как и все методы лечения рака, CAR T-клеточная терапия может вызывать серьезные побочные эффекты, включая массовое отмирание В-клеток, продуцирующих антитела, и инфекции. Одним из наиболее частых и серьезных побочных эффектов является синдром высвобождения цитокинов (СВЦ).
В рамках своих функций, связанных с иммунной системой, Т-клетки выделяют цитокины, химические мессенджеры, которые помогают стимулировать и направлять иммунный ответ. В случае CRS введенные Т-клетки наполняют кровоток цитокинами, вызывая серьезные побочные эффекты, включая опасно высокую температуру и резкое падение артериального давления. В некоторых случаях тяжелая форма СВК может привести к летальному исходу.
По иронии судьбы, CRS считается «целевым» эффектом CAR T-клеточной терапии, то есть его присутствие демонстрирует, что T-клетки работают в организме. Как правило, пациенты с наиболее обширным раком в организме с большей вероятностью испытывают тяжелый CRS из-за CAR T-клеток, объяснил доктор Кохендерфер.
У многих пациентов, как детей, так и взрослых, легкие формы СВК можно лечить стандартной поддерживающей терапией, включая стероиды. И по мере того, как исследователи приобретали больше опыта в терапии CAR Т-клетками, они обнаружили способы лучше лечить более серьезные случаи CRS.
Большую часть этого лечения составляет препарат тоцилизумаб (Актемра). Этот препарат, первоначально использовавшийся для лечения воспалительных состояний, таких как ювенильный артрит, блокирует активность ИЛ-6, цитокина, который часто в больших количествах секретируется Т-клетками и макрофагами.
Другим побочным эффектом, вызывающим особую озабоченность при терапии CAR T-клетками, являются неврологические эффекты, в том числе сильная спутанность сознания, судорожная активность и нарушение речи. Точная причина этих неврологических побочных эффектов (также называемых синдромом нейротоксичности, связанной с иммунными эффекторными клетками, или ICANS) до сих пор неясна.
Хотя тоцилизумаб эффективен при лечении CRS, похоже, он не помогает при ICANS. Стероиды в настоящее время являются лучшим вариантом лечения тяжелой ICANS, особенно дексаметазон, который лучше проникает в центральную нервную систему, чем другие стероиды, объяснила Дженнифер Брудно, доктор медицинских наук, которая участвует в нескольких испытаниях CAR T-клеточной терапии в Центре рака NCI. Исследовательская работа.
Исследовательская работа.
Модернизированная Т-клеточная терапия CAR вызывает меньше побочных эффектов
Для людей с лимфомой лечение безопаснее и эффективнее оригинальной конструкции CAR T-клеток.
Различные способы предотвращения CRS и ICANS в настоящее время интенсивно изучаются, сказал д-р Брудно. Одним из подходов является профилактическое использование тоцилизумаба и низких доз стероидов. Хотя необходимы дальнейшие исследования, «данные на данный момент обнадеживают», — сказала она.
Другие методы лечения ICANS изучаются. Небольшие исследования, например, показали, что анакинра (кинерет), которая используется для лечения ревматоидного артрита, может помочь предотвратить тяжелые ICANS у пациентов, получающих терапию CAR Т-клетками.
Еще одна идея для защиты от серьезных CRS и ICANS заключается в модификации самих CAR, пояснил д-р Брудно.
В небольшом клиническом исследовании с участием взрослых с лимфомой, например, у пациентов, получавших лечение «реконструированными» CD-19-мишенями CAR T-клетками, разработанными в NCI, было гораздо меньше тяжелых неврологических побочных эффектов, чем при использовании оригинальной формы того же препарата. АВТОМОБИЛЬ.
АВТОМОБИЛЬ.
Дополнительные антигены-мишени, в том числе для солидных опухолей
Исследования CAR Т-клеток продолжаются быстрыми темпами, включая сотни текущих клинических испытаний. Часть этого расширения является результатом того, что исследователи определили дополнительные антигены на опухолевых клетках, которые могут быть хорошими мишенями для Т-клеток CAR.
Хотя CD19 и BCMA являются единственными антигенами, для которых существуют одобренные FDA методы лечения CAR T-клеток, были разработаны методы лечения CAR T-клеток, нацеленные на другие антигены, обычно встречающиеся при раке крови, включая методы лечения, нацеленные на несколько антигенов одновременно .
А как насчет использования CAR Т-клеток для лечения солидных опухолей, таких как рак головного мозга, молочной железы или почки? Там трудно было добиться прогресса. По словам доктора Розенберга, попытки идентифицировать антигены, которые находятся на поверхности солидных опухолей, но не на здоровых клетках, «по большей части не увенчались успехом».
Преодоление истощения Т-клеток в иммунотерапии
Нацеливание на белки, участвующие в истощении Т-клеток, может усилить иммунотерапию.
Другим препятствием для солидных опухолей является окружающая среда. Физические барьеры, например, могут предотвратить попадание введенных CAR Т-клеток в опухолевые клетки. Другие компоненты микроокружения, такие как иммуносупрессивные молекулы, продуцируемые опухолевыми клетками или другими иммунными клетками, могут вызывать сбои в работе CAR Т-клеток, в результате чего они не могут выполнять свои функции по уничтожению клеток.
Возможно, самым большим препятствием является «давняя проблема: гетерогенность опухоли», — сказала Кристал Макколл, доктор медицинских наук, директор Института иммунотерапии рака Паркера в Стэнфордском университете.
Другими словами, солидные опухоли одного и того же типа рака могут сильно отличаться на молекулярном уровне от пациента к пациенту и даже в пределах конкретного пациента. Например, на некоторых опухолевых клетках могут отсутствовать целевые антигены, а может быть, они есть, но их недостаточно для того, чтобы CAR Т-клетки функционировали должным образом.
Несмотря на эти препятствия, исследователи продолжают искать способы использования CAR Т-клеток для лечения солидных опухолей.
Один из подходов заключается в попытке перехитрить подавляющую иммунитет среду многих запущенных солидных опухолей. Несколько исследовательских групп, например, разработали так называемые «бронированные» Т-клетки CAR, которые могут перемещаться в этой сложной микросреде, секретируя специфические цитокины и другие молекулы.
Другие исследователи применяют более традиционные подходы, полагаясь на стандартные технологии CAR-инженерии и нацеливаясь на единственный поверхностный антиген на раковых клетках.
Исследование Т-клеток CAR дает надежду на лечение рака у детей
В моделях распространенных онкологических заболеваний у детей на мышах лечение привело к уменьшению или уничтожению опухолей.
После многообещающих результатов лабораторных исследований и исследований на животных, например, группа доктора Макколла в Стэнфорде начала при поддержке NCI клинические испытания CAR T-клеточной терапии, нацеленной на белок солидных опухолей под названием B7-h4. В другом испытании ее группа исследует терапию Т-клетками CAR, которая нацелена на молекулу на раковых клетках, называемую GD2, у некоторых детей и молодых людей с неизменно смертельным раком головного мозга, называемым DIPG.
В другом испытании ее группа исследует терапию Т-клетками CAR, которая нацелена на молекулу на раковых клетках, называемую GD2, у некоторых детей и молодых людей с неизменно смертельным раком головного мозга, называемым DIPG.
Что касается исследования Т-клеток GD2 CAR, то, как оно первоначально предполагалось и как оно проводилось, совершенно разные, объяснил доктор Макколл на ежегодном собрании Общества иммунотерапии рака в 2021 году.
Первоначально пациентов собирались лечить только начальной внутривенной инфузией CAR Т-клеток. Но результаты исследований аналогичной терапии CAR Т-клетками на животных привели к тому, что исследователи изменили исследование: пациентам, которые реагировали на первоначальное внутривенное вливание, вводили дополнительные меньшие дозы непосредственно в мозг.
Возможность давать пациентам несколько доз, как она сообщила, привела к улучшению ответа опухоли (например, уменьшению размера опухоли) и их симптомов, связанных с раком.
Исследовательская группа также смогла быстро внести изменения в Т-клетки GD2 CAR, использованные в исследовании, и способ их производства, чтобы повысить их потенциальную эффективность и безопасность. По словам доктора Макколла, способность вносить такие быстрые изменения подчеркивает исключительную важность постоянных инноваций в области клеточной терапии.
По словам доктора Макколла, способность вносить такие быстрые изменения подчеркивает исключительную важность постоянных инноваций в области клеточной терапии.
«Я думаю, что все мы в этой области знаем, что мы только царапаем верхушку айсберга о том, что мы можем сделать в отношении создания этих CAR Т-клеток», — сказала она. «Существует множество подходов следующего поколения к проблемам, которые ограничивают [их эффективность] при солидных опухолях».
NCI стремится ускорить клинические испытания CAR Т-клеточной терапии
Инициативабудет производить методы лечения, которые будут тестироваться на нескольких испытательных площадках.
Готовые CAR Т-клеточные терапии: CRISPR, натуральные киллеры и мРНК
Исследователи также начали переосмысливать источник иммунных клеток для CAR Т-клеточной терапии, используя Т-клетки, взятые не у пациентов, а у здоровых доноров. Цель: «готовые» CAR T-клеточные терапии, которые будут немедленно доступны для использования, а не будут производиться для каждого пациента.
Все одобренные Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) методы лечения Т-клеток CAR основаны на обезоруженном вирусе для доставки генетического материала в Т-клетки для производства CAR. Но для готовых Т-клеток CAR, которые в настоящее время тестируются в небольших клинических испытаниях, используются технологии редактирования генов, такие как TALON и CRISPR, чтобы побудить донорские Т-клетки производить CAR.
Другие готовые CAR также используют другой тип иммунных клеток, называемых естественными клетками-киллерами (NK). Большая часть этих исследований все еще находится на ранней стадии, но некоторые методы лечения CAR NK-клетками уже проходят небольшие клинические испытания.
Пересматривается не только источник Т-клеток и тип иммунных клеток, но и место, где фактически производится лечение. Например, несколько исследовательских групп используют нанотехнологии и подходы на основе мРНК, которые позволяют создавать Т-клетки CAR внутри организма.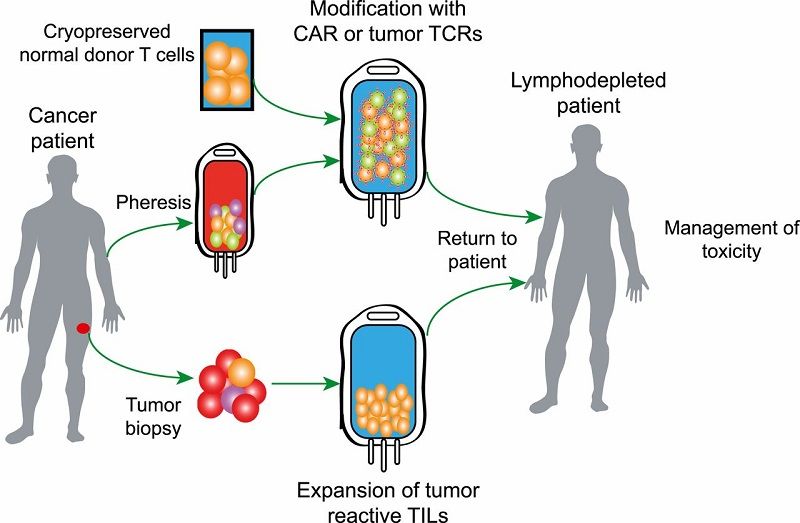
Не просто последнее средство от рака?
CAR Т-клетки: вариант лечения второй линии для НХЛ?
Клинические испытания показывают, что Т-клетки CAR могут быть более эффективными, чем стандартное лечение.
По большей части терапия CAR Т-клетками не рассматривается до тех пор, пока рак человека не ухудшится после нескольких других видов лечения. Но это начинает меняться.
Недавно в ходе двух крупных клинических испытаний терапия CAR Т-клетками оказалась более эффективной, чем стандартное лечение пациентов с неходжкинской лимфомой, у которых рак вернулся после первоначальной химиотерапии или химиотерапии первой линии.
Это открытие привело некоторых экспертов к выводу, что для этих пациентов терапия CAR Т-клетками может вскоре заменить химиотерапию в качестве стандартного лечения второй линии.
Для некоторых детей с ОЛЛ, по словам доктора Фрая, использование CAR Т-клеток таким образом было бы особенно привлекательным. В частности, он указал на детей, которые подвержены высокому риску возвращения болезни после первоначальной химиотерапии, которая обычно проводится в течение примерно 2,5 лет. На самом деле уже проводятся небольшие клинические испытания CAR Т-клеток у детей с ОЛЛ, у которых нет оптимального ответа на первоначальное химиотерапевтическое лечение.
На самом деле уже проводятся небольшие клинические испытания CAR Т-клеток у детей с ОЛЛ, у которых нет оптимального ответа на первоначальное химиотерапевтическое лечение.
Для пациентов, которые хорошо реагируют, «они могут быть избавлены от химиотерапии еще на 2 года», — сказал доктор Фрай. «Удивительно думать об этом».
Больше, чем просто CAR Т-клетки: TIL и TCR
Т-клеткиCAR привлекли львиную долю внимания, когда речь идет о клеточной терапии. Но другие типы клеточной терапии также продемонстрировали многообещающие результаты в небольших клинических испытаниях, в том числе у пациентов с солидными опухолями.
Один тип, известный как инфильтрирующие опухоль лимфоциты (TIL), использует иммунные клетки, проникшие в окружающую среду внутри опухоли и вокруг нее. Исследователи из NCI были первыми, кто использовал TIL для успешного лечения пациентов с распространенным раком — сначала при меланоме, а затем при некоторых других видах рака, включая рак шейки матки. Совсем недавно исследователи NCI разработали метод выявления TIL, которые распознают раковые клетки с мутациями, специфичными для этого рака, и выявления людей, раковые заболевания которых с большей вероятностью реагируют на терапию TIL.
Совсем недавно исследователи NCI разработали метод выявления TIL, которые распознают раковые клетки с мутациями, специфичными для этого рака, и выявления людей, раковые заболевания которых с большей вероятностью реагируют на терапию TIL.
Другой тип клеточной терапии включает конструирование Т-клеток пациентов для экспрессии специфического Т-клеточного рецептора (TCR). В отличие от CAR, которые используют части синтетических антител, которые могут распознавать специфические антигены только на поверхности клеток, TCR используют встречающиеся в природе рецепторы, которые также могут распознавать антигены, находящиеся внутри опухолевых клеток.
На сегодняшний день Т-клетки TCR были протестированы на пациентах с различными солидными опухолями, показывая многообещающие результаты при меланоме и саркоме.
Реконструированная Т-клеточная терапия CAR вызывает меньше побочных эффектов
, Персонал НЦИ
Исследователи NCI реконструировали исходный CAR CD19, заменив шарнирный и трансмембранный домены и заменив домен, связывающий CD19, с белкового фрагмента, обнаруженного у мышей, на аналогичный фрагмент, обнаруженный у людей.
Кредит: адаптировано из J Hematol Oncol. Январь 2017 г. doi: 10.1186/s13045-017-0405-3. СС BY 4.0.
В течение нескольких десятилетий ученые NCI заложили обширную основу для нового лечения, которое в конечном итоге превратилось в axicabtagene ciloleucel (Yescarta), CAR T-клеточную терапию для взрослых с лимфомой.
Хотя терапия может привести к длительной ремиссии у некоторых пациентов с раком на очень поздних стадиях, она также может вызывать неврологические побочные эффекты, такие как проблемы с речью, тремор, делирий и судороги. Некоторые побочные эффекты могут быть серьезными или смертельными.
Итак, в 2017 году исследователи NCI изменили свой первоначальный дизайн Т-клеток CAR с целью создания более безопасной и эффективной терапии. Теперь результаты первого клинического испытания реконструированных CAR Т-клеток позволяют предположить, что они, возможно, достигли части своей цели.
Новая терапия вызывала гораздо меньше неврологических побочных эффектов, чем исходная терапия в более ранних испытаниях, но при этом она была столь же эффективной. О результатах было сообщено 20 января в Nature Medicine .
О результатах было сообщено 20 января в Nature Medicine .
«Примечательно, что из 20 пациентов, участвовавших в этом исследовании, только у одного были серьезные неврологические побочные эффекты», — сказала младший исследователь Дженнифер Брудно, доктор медицинских наук, из Центра исследований рака NCI.
«Похоже, это значительный прогресс в нашем нынешнем понимании того, как работают CAR T-клетки и как сделать CAR T [-клеточную терапию] более безопасной», — сказал Дэвид Мэлони, доктор медицинских наук, медицинский директор клеточного иммунотерапии для Центра исследования рака Фреда Хатчинсона, который не участвовал в исследовании.
Однако исследование ограничено небольшим числом пациентов и относительно коротким периодом времени, в течение которого отслеживались результаты лечения пациентов, добавил он.
Т-клетки получают новый CAR
CAR Т-клеточная терапия включает в себя оснащение собственных Т-клеток пациента (разновидность лейкоцитов) специальным белком, называемым CAR, или химерным антигенным рецептором. Этот рецептор помогает Т-клеткам находить и уничтожать рак человека.
Этот рецептор помогает Т-клеткам находить и уничтожать рак человека.
Модернизированный CAR команды NCI отличается от оригинала несколькими способами. Например, две секции (называемые шарнирным и трансмембранным доменами) исходного CAR были заменены. А другой участок, который изначально состоял из белкового фрагмента, обнаруженного у мышей, был заменен аналогичным фрагментом, обнаруженным у людей. Но, как и оригинал, новый CAR также нацелен на CD19., молекула, покрывающая поверхность клеток лимфомы.
В более ранних лабораторных исследованиях исследователи обнаружили, что Т-клетки, оснащенные новым CAR, замедляют рост опухолей у мышей. И по сравнению с исходными Т-клетками CAR, новые Т-клетки CAR продуцировали более низкие уровни веществ, называемых цитокинами.
Ученые не до конца понимают, как Т-клетки CAR вызывают неврологические побочные эффекты, но частично в этом могут быть виноваты цитокины. Цитокины также являются причиной синдрома высвобождения цитокинов, еще одного потенциально опасного для жизни побочного эффекта терапии CAR Т-клетками.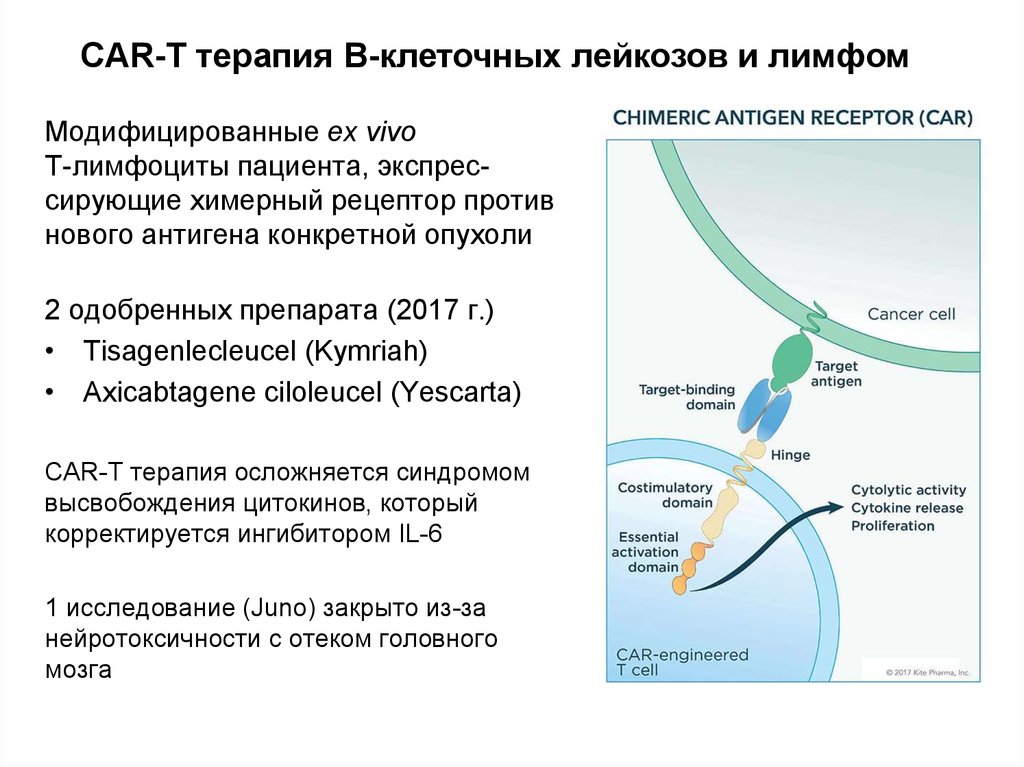
Получив эти многообещающие результаты, команда ученых приступила к первому исследованию реконструированных CAR Т-клеток на людях.
Меньше цитокинов, меньше неврологических побочных эффектов
В новом исследовании д-р Брудно и ее коллеги дали новую терапию Т-клетками CAR 20 пациентам с В-клеточной лимфомой.
В целом у четырех пациентов (20%) наблюдалась некоторая неврологическая токсичность: у трех были легкие эффекты, а у одного (5%) — тяжелые эффекты, которые быстро исчезли после лечения стероидом (лекарством, подавляющим иммунную систему).
В более раннем исследовании оригинальной CAR Т-клеточной терапии с участием 22 человек с В-клеточной лимфомой у 17 (77%) наблюдалась некоторая неврологическая токсичность, в том числе у 11 пациентов (50%) наблюдались тяжелые симптомы.
У двух пациентов (10%) в новом исследовании и у четырех (18%) в более раннем исследовании был тяжелый синдром высвобождения цитокинов. «Кажется благоприятным, что [частоты] схожи, но трудно сказать, действительно ли [синдром высвобождения цитокинов] встречается реже» с новой терапией», — сказал доктор Брудно.
Ученые обнаружили, что уровни цитокинов в крови пациентов, получавших новую терапию, были ниже, чем у пациентов, получавших исходную терапию, что может объяснить, почему новая терапия вызывала меньше неврологических побочных эффектов.
В обоих испытаниях исследователи использовали одни и те же методы для оценки тяжести неврологической токсичности и синдрома высвобождения цитокинов, отметил д-р Брудно.
И хотя между двумя испытаниями есть и другие сходства — например, они проводились в одном и том же учреждении — сложно сравнивать результаты независимых исследований, сказала она.
CAR T-клетки, которые прилипают к телу
Одна из проблем современных методов лечения CAR T-клетками заключается в том, что клетки не сохраняются в организме пациента очень долго. Отчасти это связано с тем, что иммунная система человека может воспринимать мышиные белки как незнакомые и уничтожать CAR-Т-клетки.
Одной из целей группы было создание CAR Т-клеток, которые сохранялись бы дольше. Они пришли к выводу, что Т-клетки с CAR, состоящим только из белков человека, могут существовать дольше, чем клетки с CAR, содержащим мышиные белки.
Они пришли к выводу, что Т-клетки с CAR, состоящим только из белков человека, могут существовать дольше, чем клетки с CAR, содержащим мышиные белки.
Если иммунная система пациента игнорирует CAR, сделанный из белков человека, то CAR Т-клетки могут существовать дольше и быть более эффективными, объяснил доктор Брудно.
Возможно, это относится к новой терапии. Через месяц после лечения уровень CAR Т-клеток в крови пациентов, получавших новую терапию, был выше, чем у пациентов, получавших исходную терапию.
Эти результаты «обнадеживают» и должны быть изучены в будущих исследованиях, сказал доктор Мэлони.
Хотя новые CAR Т-клетки сохраняются дольше, чем исходные CAR Т-клетки, они не оказались более эффективными. В обоих испытаниях более половины (55%) участников достигли полной ремиссии.
Но «радостно» видеть «очень хорошую эффективность этого продукта Т-клеток CAR в дополнение к низкой токсичности», — сказал д-р Брудно.
Информативное изменение дизайна
Терапия CAR T-клетками может привести к целому ряду неврологических эффектов, от очень легких до тяжелых и опасных для жизни, объяснил д-р Брудно.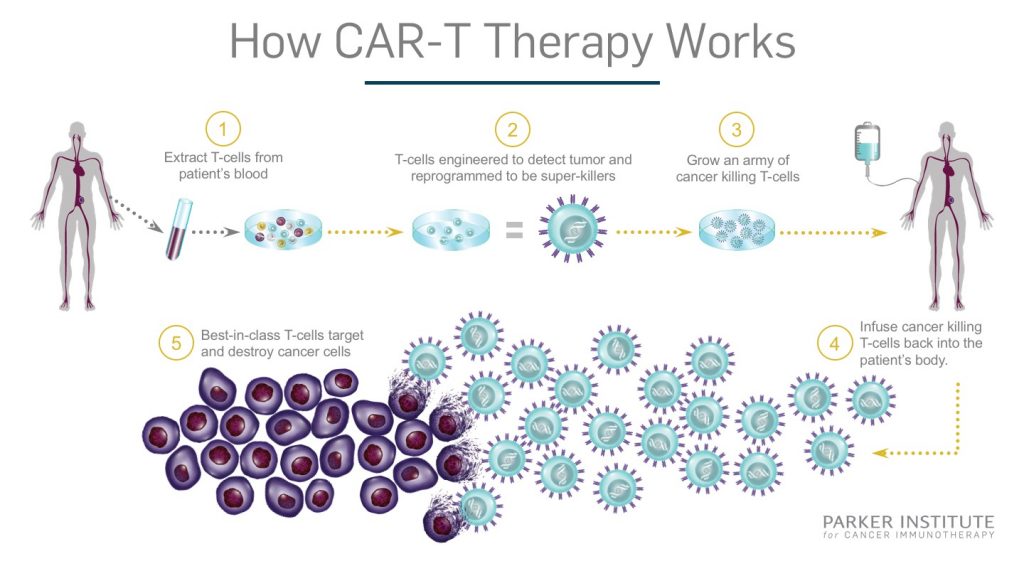
Эти побочные эффекты связаны со всеми доступными в настоящее время CAR Т-клеточными препаратами — двумя одобренными FDA и еще одним, ожидающим одобрения FDA — Dr. — заметил Мэлони. В других исследованиях показатели тяжелой неврологической токсичности колебались от 5% до 50%.
Другие клинические испытания проверяют терапию CAR T-клетками, которые также были переработаны, чтобы сделать их более безопасными, отметил д-р Мэлони. По его словам, новое исследование NCI выявляет аспекты конструкции CAR T-клеток, о которых ранее не было известно, что они влияют на неврологическую токсичность.
«Но как вы преобразуете это в новый коммерческий продукт или модернизируете [существующий] коммерческий продукт — это совсем другой вопрос», — сказал он. Изготовление CAR Т-клеточной терапии для каждого отдельного пациента — сложный и дорогостоящий процесс, который можно осуществить только в узкоспециализированных учреждениях.
На данный момент команда NCI под руководством Джеймса Кохендерфера, доктора медицины, сосредоточена на проведении клинических испытаний различных CAR Т-клеточных терапий для людей с другим типом рака крови, множественной миеломой.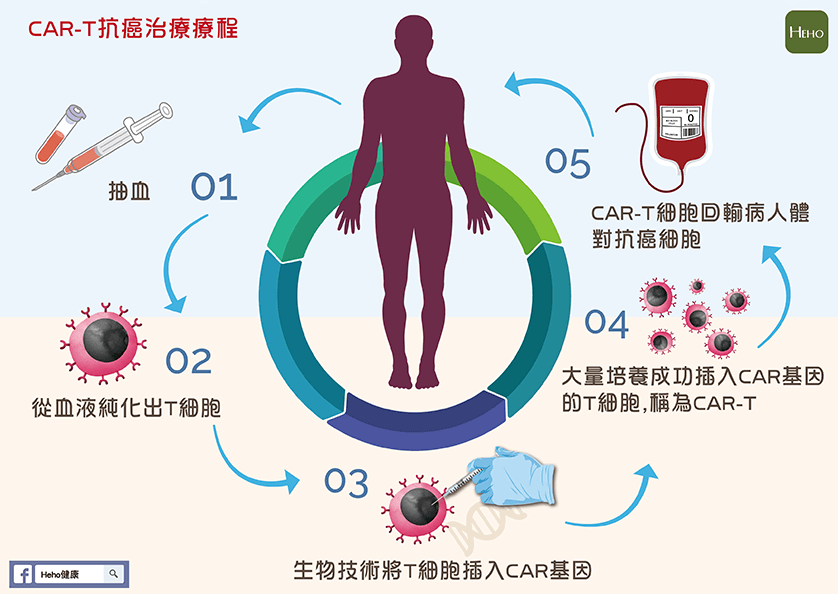
NK-клетки берут на себя управление
Текущие подходы к терапии CAR Т-клетками включают многонедельный и дорогостоящий процесс превращения Т-клеток каждого пациента в персонализированное, единственное в своем роде лечение.
Теперь исследователи из Онкологического центра им. М. Д. Андерсона Техасского университета говорят, что они создали клеточную терапию, которую можно хранить в больших количествах и использовать «готовую» для многих пациентов. В новом лечении использовались иммунные клетки, называемые естественными клетками-киллерами (NK), от здорового донора для проведения терапии «CAR-NK».
В клиническом исследовании с участием 11 пациентов с лимфомой или лейкемией терапия CAR-NK оказалась безопасной и эффективной. Результаты исследования были опубликованы 6 февраля в New England Journal of Medicine .
Восемь пациентов (73%) ответили на лечение, из них у семи была полная ремиссия. Однако многие пациенты получали последующее лечение (например, химиотерапию) вскоре после терапии CAR-NK.
